铝的化合物的性质
- 格式:pdf
- 大小:555.02 KB
- 文档页数:8

一、铝及其化合物(一)铝的化学性质1、与非金属单质发生反应:==2Al2O34Al+3O2、与水发生反应:Al与冷水几乎不反应,与热水反应微弱。
3、与非氧化性酸发生反应:2Al+3H2SO4=Al2(SO4)3+3H2↑2Al+6HCl=2AlCl3+3H2↑4、与强氧化性酸发生反应:2Al+6H2SO4(浓)==Al2(SO4)3+3SO2↑+6H2OAl+6HNO3(浓)== Al(NO3)3+3NO2↑+3H2OAl+4HNO3(稀)=Al(NO3)3+NO↑+2H2O常温下浓H2SO4、浓HNO3使Al表面发生“钝化”,不产生气体,只有在加热条件下才发生以上反应。
5、与强碱溶液发生反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑注意:此反应的实质2Al+6H2O===2Al(OH)3+3H2↑Al(OH)3+NaOH===NaAlO2+2H2O常用于区别铝和不溶于强碱的金属如镁等。
6、铝与Fe2O3的反应:铝热反应镁条和氯酸钾是引燃剂铝热剂:氧化铁(或难熔金属的氧化物,如V2O5、MnO2、Cr2O3)与铝粉的混合物7、铝的冶炼工业上采用电解方法制铝,用熔化的冰晶石(Na3AlF6)作熔剂,使氧化铝在1000℃左右,溶解在液态的冰晶石里,成为冰晶石和氧化铝的熔融体。
然后电解。
(二)氧化铝(Al2O3)1、物理性质,Al2O3是白色固体,其天然晶体叫刚玉,硬度大,熔点高(为2072℃),是很好的耐火材料。
2、化学性质氧化铝是典型的两性氧化物,新制的氧化铝既能跟酸起反应生成铝盐,又能跟碱起反应生成偏铝酸盐。
Al2O3+6HCl=2AlCl3+3H2OAl2O3+2NaOH=2NaAlO2+H2O3、用途:作耐火材料,制耐火管,坩埚等;作冶炼铝的原料;红、蓝宝石。
(三)氢氧化铝(Al(OH)3)1、物理性质:Al(OH)3是白色固体,难溶于水,若溶液中生成,Al(OH)3为白色胶状物,且有吸附水中悬浮物和色素的能力。
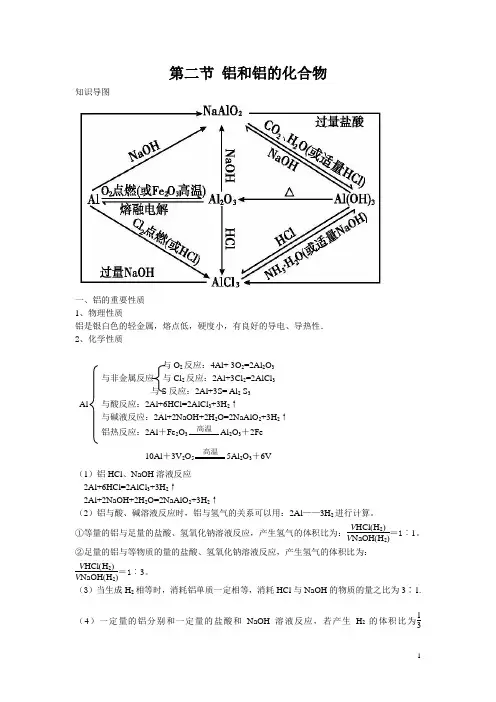
第二节 铝和铝的化合物知识导图一、铝的重要性质1、物理性质铝是银白色的轻金属,熔点低,硬度小,有良好的导电、导热性.2、化学性质与O 2反应:4Al+ 3O 2=2Al 2O 3与非金属反应 与Cl 2反应:2Al+3Cl 2=2AlCl 3与S 反应:2Al+3S= Al 2 S 3Al 与酸反应:2Al+6HCl=2AlCl 3+3H 2↑与碱液反应:2Al+2NaOH+2H 2O=2NaAlO 2+3H 2↑铝热反应:2Al +Fe 2O 3 高温 Al 2O 3+2Fe10Al +3V 2O 5 高温 5Al 2O 3+6V (1)铝HCl 、NaOH 溶液反应2Al+6HCl=2AlCl 3+3H 2↑2Al+2NaOH+2H 2O=2NaAlO 2+3H 2↑(2)铝与酸、碱溶液反应时,铝与氢气的关系可以用:2Al ——3H 2进行计算。
①等量的铝与足量的盐酸、氢氧化钠溶液反应,产生氢气的体积比为:V HCl (H 2)V NaOH (H 2)=1︰1。
②足量的铝与等物质的量的盐酸、氢氧化钠溶液反应,产生氢气的体积比为:V HCl (H 2)V NaOH (H 2)=1︰3。
(3)当生成H 2相等时,消耗铝单质一定相等,消耗HCl 与NaOH 的物质的量之比为3∶1.(4)一定量的铝分别和一定量的盐酸和NaOH 溶液反应,若产生H 2的体积比为13<V HCl (H 2)V NaOH (H 2)<11,则必定是:Al 与HCl 反应时,Al 过量而HCl 不足;Al 与NaOH 溶液反应时,Al 不足而NaOH 溶液过量.二、铝的氧化物(Al 2O 3)1、化学性质与酸反应:Al 2O 3+6HCl=2AlCl 3+3H 2O与碱反应:Al 2O 3+2NaOH=2NaAlO 2+H 2O2、用途:熔点很高,是一种很好的耐火材料(Al 2O 3,MgO ),红宝石,蓝宝石的主要成分是氧化铝。


考点25 铝的化合物聚焦与凝萃1.把握铝的化合物的性质; 2.把握重要铝的化合物的制备方法。
解读与打通 常规考点 1.氧化铝(1)物理性质:白色、难熔固体、难溶于水。
(2)化学性质: 氧化铝难溶于水,却能溶于酸或强碱溶液中。
Al 2O 3 + 6HCl =2AlCl 3 + 3H 2O Al 2O 3 + 2NaOH = 2NaAlO 2 + H 2O因此说Al 2O 3是两性氧化物(既能与酸反应生成盐和水,又能与碱反应生成盐和水的金属氧化物。
) (3)用途:熔点很高,是一种比较好的耐火材料,还可以制作各种宝石。
2.氢氧化铝(1)物理性质:白色胶状不溶于水的固体,有较强的吸附性。
(2)化学性质: ①两性:Al(OH)3+3H +===Al 3++3H 2O Al(OH)3+OH -===AlO -2+2H 2OAl(OH)3具有两性的缘由是Al(OH)3在水中存在两种电离趋势: Al 3++ 3OH-Al(OH)3H + + AlO 2-+ H 2O②不稳定性:2Al(OH)3=====△Al 2O 3+3H 2O (3)试验室制法:①向铝盐中加入氨水,离子方程式:Al 3++3NH 3·H 2O=Al(OH)3↓+3NH +4。
②NaAlO 2溶液中通入足量CO 2,离子方程式:AlO -2+CO 2+2H 2O=Al(OH)3↓+HCO -3。
③NaAlO 2溶液与AlCl 3溶液混合:3AlO -2+Al 3++6H 2O=4Al(OH)3↓。
Al(OH)3是一种两性氢氧化物,可以溶入强酸,也可以溶入强碱溶液,因此Al(OH)3也写成H 3 AlO 3(铝酸)的形式。
但太弱的酸(如H 2CO 3)或太弱的碱(如NH 3·H 2O )与Al(OH)3是不发生反应的。
隐性考点铝盐(1)明矾:由两种不同的金属离子和一种酸根离子组成的复盐。
化学式为KAl(SO 4)2·12H 2O ,它是无色晶体,可溶于水,水溶液pH<7(填“<”、“ >”或“=”)。



铝及铝的化合物性质及应用铝是一种常见的金属元素,化学符号为Al,原子序数为13。
它是周期表中主族元素的一员,属于第13族元素。
铝具有轻巧、耐腐蚀、导电好等优点,因此在工业生产和日常生活中有广泛的应用。
首先,铝的性质:1. 轻巧:铝的相对原子质量为26.98,为周期表中较轻的金属之一。
这使得铝具有很低的密度,大约为2.7g/cm³,是铁的1/3。
因此,铝制品在航空航天、汽车制造和包装行业中得到广泛应用。
2. 导电好:铝是一种优良的导电金属,电导率为273万/(Ω·m),仅次于银和铜。
因此,在电力传输线路和电子设备中常使用铝制导线和电子元件。
3. 耐腐蚀:铝表面形成的致密氧化膜可以保护铝内部不被进一步氧化。
这使得铝具有良好的耐腐蚀性能,在湿润环境中不易被腐蚀,因此广泛应用于建筑材料和食品包装等领域。
其次,铝的化合物性质及应用:1. 氧化铝(Al2O3):作为铝最常见的化合物,氧化铝具有很高的熔点和硬度,常用于制备陶瓷材料、磨料、搪瓷和耐火材料等。
同时,氧化铝还可以用于制备铝粉、催化剂和涂料等。
2. 硫酸铝(Al2(SO4)3):硫酸铝是一种重要的无机化学品,在水处理、纺织、造纸和皮革工业中被广泛使用。
它可以用作沉淀剂、凝固剂和调节剂,用于处理废水和净化水质。
3. 氢氧化铝(Al(OH)3):氢氧化铝是一种白色的沉淀剂,可用于医药制剂中的缓冲剂和抗酸剂。
此外,氢氧化铝还可以用作催化剂、填料和涂料添加剂等。
4. 氟化铝(AlF3):氟化铝是一种重要的助熔剂和催化剂,在铝的冶炼和合成高级材料中得到广泛应用。
5. 硝酸铝(Al(NO3)3):硝酸铝是一种酸性溶液,常用于铝的着色和染色过程中。
它可以用于染色和涂层工艺,用于制备金属颜料和印刷油墨。
总结起来,铝及其化合物具有许多重要的性质和广泛的应用。
铝的轻巧和耐腐蚀性使其成为航空航天和汽车制造业的理想选择。
铝的良好导电性使其成为电力传输和电子设备制造的重要材料。

点燃 铝及其化合物 知识点一. 铝单质的性质1.物理性质:银白色金属,硬度和密度小,具有良好的导电导热性和延展性。
在空气中具有很好的耐腐蚀性。
2.化学性质:(1)与非金属单质反应:A 、2Al+3Cl 2====2AlCl 3B 、铝在空气中缓慢氧化,在氧气中点燃剧烈燃烧。
4Al+3O 2 ========= 2Al 2O 3铝与空气中的氧气反应生成致密的氧化膜并牢固地覆盖在铝表面,阻止了内部的铝与空气接触。
(2)与盐溶液反应:2Al+3CuSO 4 =3Cu+Al 2(SO 4)3(3)与某些氧化物反应—铝热反应:2Al + Fe 2O 3 == 2Fe + Al 2O 3 铝热剂是Al 和 Fe 2O 3(4)与沸水微弱反应:2Al+6H 2O Δ 2Al (OH )3 + 3H 2↑(5)与酸反应::2Al+6HCl ====== 2AlCl 3+H2↑2Al+3H 2SO 4 ====== Al 2(SO 4)3+ 3H2↑注意:铝在冷的浓硫酸、浓硝酸中钝化。
某些金属在常温下遇强氧化性酸如浓硫酸、浓硝酸时在表面生成致密的氧化膜,从而阻止内部金属进一步发生反应,这种现象称为钝化。
(6)与碱反应: 2Al+2NaOH+2H 2O=2NaAlO 2+3H 2↑反应的实质:分两步进行:②Al(OH)3+NaOH ======== NaAlO 2+2H 2O知识点二. 铝的重要化合物1. 氧化铝(Al 2O 3)化合价降低,被还原,得6e —①2Al+6H 2O ====== 2Al(OH)3 + 3H 2↑化合价升高,被氧化,失6e —2Al+6H 2O+2NaOH = 2NaAlO 2+3H 2↑+4H 2O失2×3 e —得6×e —(1)物理性质:白色固体、熔点高(2054℃) 、不溶于水,不与水化合。
常作耐火材料。
刚玉的主要成分是Al 2O 3 ,其中把含少量铬元素的刚玉称为红宝石;含少量的铁和钛元素的刚玉称为蓝宝石。



△ 点燃△ 铝 及 其 化 合 物一、铝得结构:1、原子结构示意图:2、周期表中位置:第三周期ⅢA族镁原子核外有三个电子,在化学反应中,容易失去最外层得三个电子,显+3价。
二、铝单质得性质1、物理性质:银白色金属,硬度与密度小,具有良好得导电导热性与延展性。
在空气中具有很好得耐腐蚀性。
2、化学性质:(1)与非金属单质反应:A 、2Al+3Cl 2====2Al Cl 3B 、铝在空气中缓慢氧化,在氧气中点燃剧烈燃烧。
4A l+3O 2 ========= 2Al 2O 3思考:在金属活泼性顺序中铝排在铁得前面,那为什么铁在空气中易生锈而铝在空气中不易被腐蚀呢?铝与空气中得氧气反应生成致密得氧化膜并牢固地覆盖在铝表面,阻止了内部得铝与空气接触。
(2)与盐溶液反应:2A l+3CuSO 4 =3Cu +Al 2(SO 4)3(3)与某些氧化物反应—铝热反应:2Al + F e2O 3 == 2Fe + Al 2O3铝热剂[现象]:发出耀眼得光芒、放出大量得热、有熔融物生成。
[试一试]:写出Al 分别与M nO2 、V 2O5 得反应方程式(4)与沸水微弱反应:2Al+6H 2O ========= 2A l(OH)3 + 3H 2↑(5)与酸反应::2A l+6HCl ====== 2AlCl 3+H2↑2A l+3H 2S O4 ====== Al 2(SO 4)3+ 3H 2↑注意:铝在冷得浓硫酸、浓硝酸中钝化。
某些金属在常温下遇强氧化性酸如浓硫酸、浓硝酸时在表面生成致密得氧化膜,从而阻止内部金属进一步发生反应,这种现象称为钝化。
(6)与碱反应:2Al+2NaOH +2H 2O=2NaAlO 2+3H 2↑ 反应得实质:分两步进行:(2)A l(OH)3+NaOH ======== NaAl O2+2H 2O化合价降低,被还原,得6e —(1)化合价升高,被氧化,失6e —+4H 2O—得6×e —三、铝得重要化合物1、氧化铝(Al2O3)(1)物理性质:白色固体、熔点高(2054℃) 、不溶于水,不与水化合。
铝及其化合物(一)铝的性质1、物理性质:银白色金属,质较软,但比镁要硬,熔点比镁高。
有良好的导电、导热性和延展性。
2、化学性质:铝是较活泼的金属①通常与氧气易反应,生成致密的氧化物起保护作用。
4Al + 3O2 == 2Al2O3。
同时也容易与Cl2、S等非金属单质反应。
②与酸反应:强氧化性酸,如浓硫酸和浓硝酸在常温下,使铝发生钝化现象;加热时,能反应,但无氢气放出;非强氧化性酸反应时放出氢气。
(2Al+6H+=2Al3++3H2↑)③与强碱溶液反应:2Al + 2NaOH + 2H2O == 2NaAlO2 + 3H2↑(2Al+2OH-+2H2O=2AlO2-+3H2↑ )④与某些盐溶液反应:如能置换出CuSO4、AgNO3等溶液中的金属。
⑤铝热反应:铝与某些金属氧化物的反应(如V、Cr、Mn、Fe的氧化物)叫做铝热反应2Al + Fe2O3高温Al2O3 + 2FeAl 和Fe2O3的混合物叫做铝热剂,利用铝热反应焊接钢轨。
(二)氧化铝(Al2O3)白色固体,熔点高(2054℃),沸点2980℃,常作为耐火材料;是两性氧化物。
我们常见到的宝石的主要成分是氧化铝。
有各种不同颜色的原因是在宝石中含有一些金属氧化物的表现,如红宝石因含有少量的铬元素而显红色,蓝宝石因含有少量的铁和钛元素而显蓝色。
工业生产中的矿石刚玉主要成分是α-氧化铝,硬度仅次于金刚石,用途广泛。
两性氧化物:既能与强酸反应又能与强碱反应生成盐和水的氧化物Al2O3 + 6HCl == 2AlCl3 + 3H2O ,Al2O3 + 2NaOH == 2NaAlO2 + H2OAl2O3是工业冶炼铝的原料,由于氧化铝的熔点高,电解时,难熔化,因此铝的冶炼直到1886年美国科学家霍尔发现在氧化铝中加入冰晶石(Na3AlF6 ),使氧化铝的熔点降至1000度左右,通电铝的冶炼才快速发展起来,铝及其合金才被广泛的应用。
2Al2O3 4Al + 3O2↑(三)氢氧化铝(Al(OH)3)白色难溶于水的胶状沉淀,是两性氢氧化物。
镁、铝及其化合物班级姓名一、铝单质铝元素在地壳中含量丰富,仅次于。
自然界中的铝全部以态存在;铝土矿的主要成分是氧化铝。
(一)物理性质银白色有金属光泽的固体,有良好的、和,是质地的轻金属。
(二)化学性质1、与非金属单质反应(1)与O2反应:常温下,铝表面可形成致密的保护层,故金属铝有一定的抗腐蚀性。
点燃或加热时与O2反应的化学方程式为:。
(2)在点燃或加热的条件下与Cl2、S反应,化学反应方程式分别为:,2、与酸反应(常温下铝遇、能够发生钝化)。
与盐酸反应的化学方程式为:,离子方程式:3、与强碱(如NaOH)溶液反应的化学方程式为:。
离子方程式:4、与某些盐(如CuCl2)溶液反应的化学方程式为:。
离子方程式:5、与金属氧化物(如Fe2O3)反应(铝热反应)的化学方程式为:。
(三)铝的制备通电电解熔融的Al2O3:2Al2O3 4A l+3O2↑二、氧化铝(一)物理性质:白色固体,硬度高,熔沸点高。
刚玉、红宝石、蓝宝石的主要成分为α—氧化铝。
(二)化学性质:两性氧化物:与酸、碱都能反应生成盐和水的氧化物。
1、与盐酸反应的化学方程式为:,离子方程式:2、与NaOH 溶液反应的化学方程式为: 。
离子方程式:(三)用途:用作制造耐火材料如坩锅、耐火管、耐高温的实验仪器等三、氢氧化铝:(一)物理性质:白色固体,难溶于水。
(二)化学性质:1、受热分解:化学反应方程式为: 。
2、两性:有关的化学方程式和离子方程式为:与盐酸的反应: ;离子方程式: 。
与NaOH 的反应: ;离子方程式: 。
(三)用途:1、治疗胃酸过多,其原理可用离子方程式表示为: 。
2、铝盐水解生成的Al(OH)3胶体可净水。
(四)制取:可溶性铝盐与氨水反应的化学方程式: 。
离子方程式: 。
四、镁(一)物理性质:银白色,有金属光泽,熔点低,硬度小,密度小。
(二)化学性质1、能与O2、Cl 2、N 2等非金属单质反应,产物分别为MgO 、MgCl 2、Mg 3N 2。
量变达到质变
金属及其化合物
铝的化合物的化学性质
[知识梳理]
1氧化铝
(1)物理性质
色态:白色固体;硬度:大;熔点:高。
(2)化学性质
①属于两性氧化物,写出下列反应的离子方程式:
(3)用途
熔点很高,是一种较好的耐火材料,天然产刚玉的成分是Al2O3,还可制作各种宝石。
2.氢氧化铝
(1)物理性质
Al(OH)3是一种难溶于水的白色胶状物质,具有较强的吸附能力。
(2)化学性质
①两性
Al(OH)3的电离方程式为
Al(OH)3既能溶于强酸又能溶于强碱,且都生成盐和水。
与强酸反应Al(OH)3+3H+===Al3++3 H2O,
与强碱溶液反应:Al(OH)3+OH—===AlO2−+2 H2O。
②不稳定性
Al(OH)3受热分解:2Al(OH)3=====△
Al 2O 3+3 H 2O 。
(3)制备
①向铝盐中加入氨水,离子方程式为Al 3++3NH 3·H 2O===Al(OH)3↓+3NH 4+。
②NaAlO 2溶液中通入足量CO 2,离子方程式为AlO 2−+CO 2+2 H 2O
===Al(OH)3↓+HCO 3−。
③NaAlO 2溶液与AlCl 3溶液混合:离子方程式为3AlO 2−+Al 3++
6H 2O===4Al(OH)3↓。
3.明矾
明矾的化学式为KAl(SO4)2·12H 2O ,可溶于水
明矾可用于净水,其原因是Al 3+水解产生Al(OH)3胶体,Al(OH)3胶体可以和悬浮于水中的泥沙形成絮状不溶物而沉降下来,使水澄清。
[易错警示]
(1)Al 2O 3、Al(OH)3是中学阶段接触的唯一与碱反应的金属氧化物和氢氧化物,经常应用到除杂、计算题中,所以一定要熟记这两个反应的离子方程式。
(2)Al(OH)3具有两性,能溶于强酸(如盐酸)、强碱(如NaOH 溶液),但不溶于弱酸(如H 2CO 3)、弱碱溶液(如氨水)。
(3)
由Al(OH)3的两式电离以及与酸和碱反应的离子方程式可知:与酸反
应时相当于三元碱,与碱反应时相当于一元酸。
(4) 明矾净水只能除去水中的悬浮杂质,不能杀菌消毒,与氯气消毒原
理不同。
4.“铝三角”转化关系
(1)把强碱溶液逐滴加入到铝盐(Al3+)溶液中至过量
①现象:先有白色沉淀产生,然后沉淀逐渐溶解。
②有关反应:
A→B:Al3++3OH-=== Al(OH)3↓
B→D:Al(OH)3+OH-===AlO2−+2 H2O
③图象:
(2)把铝盐(Al3+)溶液逐滴加入到强碱溶液中至过量
①现象:先无明显现象,然后逐渐产生大量的白色沉淀。
②有关反应:
A→B:Al3++4OH -
===AlO2−+2 H2O
B→C:Al3++3AlO2−+6 H2O ==4Al(OH)3↓③图象:
(3)在AlO2−溶液中逐滴加入强酸至过量
①现象:先生成白色沉淀,然后沉淀逐渐溶解。
②有关反应:
A→B:AlO2−+H +
+H2O == Al(OH)3↓
B→D:Al(OH)3+3 H +
===Al3++3H2O
③图象:
(4)在强酸溶液中逐滴加入AlO2−溶液至过量
①现象:先无明显现象,反应一段时间后逐渐产生白色沉淀。
②有关反应:
A→B:4H +
AlO2−===Al3++2H2O
B→C:Al3++3AlO2−+6 H2O ===4 Al(OH)3↓
③图象:
(5)向含Mg2+与Al3+的酸性溶液中逐滴加入强碱溶液
①现象:无明显现象→出现沉淀→渐多→最多→减少→不变。
②反应:
O→A:H++OH-===H2O
A→B:Al3++3OH-=== Al(OH)3↓、Mg2++2OH-===Mg(OH)2↓B→C:Al(OH)3+OH-==AlO2−+2H2O
③图象[c(Mg2+)=c(Al3+)]
(6)向明矾溶液中逐滴加入Ba(OH)2溶液
O→A:2KAl(SO4)2+3Ba(OH)2===2Al(OH)3↓+3BaSO4↓+K2SO4
A→B:2Al(OH)3+K2SO4+Ba(OH)2===BaSO4↓+2KAlO2+4H2O
[应用体验]
1.铝、氧化铝、氢氧化铝和可溶性铝盐与过量强碱溶液的反应,其生成物有一定的规律,下列说法中正确的是( )
A.都有H2O生成 B.都有H2生成
C.都有AlO2−生成 D.都有Al3+生成
2.下列说法正确的是( )
A.Al2O3难溶于水,不跟水反应,所以它不是Al(OH)3对应的氧化物
B.因为Al2O3是金属氧化物,所以它是碱性氧化物
C.Al2O3属于两性氧化物
D.Al2O3能与所有的酸、碱溶液反应
3.不能只用NaOH溶液除去括号中杂质的是( )
A.Mg(Al2O3) B.Mg(OH)2[Al(OH)3]
C.Fe(Al) D.Fe2O3(FeO)
4.相同质量的下列物质分别与等浓度的NaOH溶液反应,反应至体系中均无
固体物质时,消耗碱量最多的是( )
A.Al B.Al(OH)3 C.AlCl3 D.Al2O3
5.在硝酸铝和硝酸镁的混合溶液中,逐滴加入稀氢氧化钠溶液,直至过量。
下列表示氢氧化钠加入量(x)与溶液中沉淀物的量(y)的关系示意图正确的是( )
6.在溶液中能共存,加入强碱溶液有沉淀析出,加入强酸溶液能放出气体的是( )
A.Na+、AlO2−、Cl−、SO42−
B.K+、Ba2+、NO3−、SO42−
C.Al3+、Ca2+、Na+、Cl−
D.Na+、Mg2+、SO42−、HCO3−
7.(双选题)下列各组物质的稀溶液相互反应,无论是前者滴入后者,还是后者滴入前者,反应现象都相同的是( )
A.NaHSO4和Ba(OH)2
B.AlCl3和NaOH
C.NaAlO2和H2SO4
D.NaHCO3和H2SO4
8.以Al2O3为原料制取氢氧化铝,最好的方法是( )
A.将Al2O3溶于水
B.将Al2O3先溶于盐酸中,之后滴加氢氧化钠溶液
C.将Al2O3先溶于盐酸中,之后滴加氨水
D.将Al2O3先溶于NaOH溶液中,之后滴加盐酸
9.某学生在实验室做了5个实验:请选择符合实际情况的图象:
(1)在铝盐溶液中逐滴加入稀氨水直至过量。
________
(2)铝盐溶液中加入NaOH溶液直至过量。
________
(3)澄清石灰水中通入CO2直至过量。
________
(4)Al2(SO4)3和MgSO4的混合溶液中加入NaOH溶液直至过量。
________
10.某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现如图所示的物质之间的变化:
据此回答下列问题:
(1)Ⅰ、Ⅱ、Ⅲ、Ⅳ四步中对于溶液和沉淀的分离采取的方法是_____________________________________________________________________ ___。
(2)根据上述框图反应关系,写出下列B、C、D、E所含物质的化学式:
固体B________;沉淀C________;沉淀D________;溶液E________。
(3)①反应的化学方程式为
_________________________________________________________________ _______;
②反应的离子方程式为
_________________________________________________________________ _______。