铝及其化合物的性质
- 格式:ppt
- 大小:1.03 MB
- 文档页数:18
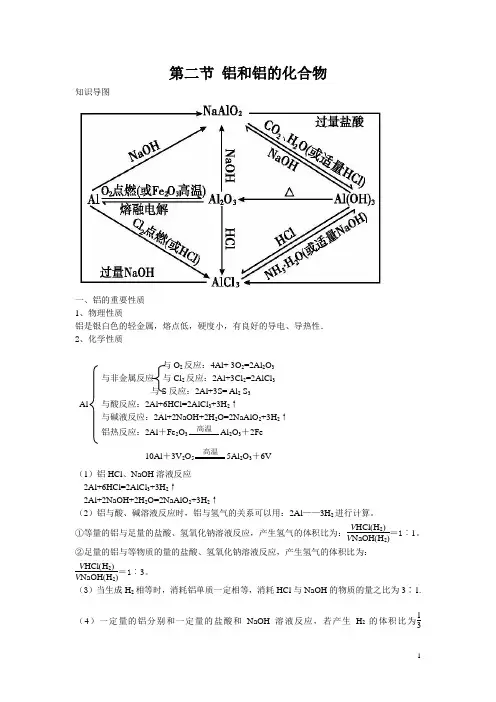
第二节 铝和铝的化合物知识导图一、铝的重要性质1、物理性质铝是银白色的轻金属,熔点低,硬度小,有良好的导电、导热性.2、化学性质与O 2反应:4Al+ 3O 2=2Al 2O 3与非金属反应 与Cl 2反应:2Al+3Cl 2=2AlCl 3与S 反应:2Al+3S= Al 2 S 3Al 与酸反应:2Al+6HCl=2AlCl 3+3H 2↑与碱液反应:2Al+2NaOH+2H 2O=2NaAlO 2+3H 2↑铝热反应:2Al +Fe 2O 3 高温 Al 2O 3+2Fe10Al +3V 2O 5 高温 5Al 2O 3+6V (1)铝HCl 、NaOH 溶液反应2Al+6HCl=2AlCl 3+3H 2↑2Al+2NaOH+2H 2O=2NaAlO 2+3H 2↑(2)铝与酸、碱溶液反应时,铝与氢气的关系可以用:2Al ——3H 2进行计算。
①等量的铝与足量的盐酸、氢氧化钠溶液反应,产生氢气的体积比为:V HCl (H 2)V NaOH (H 2)=1︰1。
②足量的铝与等物质的量的盐酸、氢氧化钠溶液反应,产生氢气的体积比为:V HCl (H 2)V NaOH (H 2)=1︰3。
(3)当生成H 2相等时,消耗铝单质一定相等,消耗HCl 与NaOH 的物质的量之比为3∶1.(4)一定量的铝分别和一定量的盐酸和NaOH 溶液反应,若产生H 2的体积比为13<V HCl (H 2)V NaOH (H 2)<11,则必定是:Al 与HCl 反应时,Al 过量而HCl 不足;Al 与NaOH 溶液反应时,Al 不足而NaOH 溶液过量.二、铝的氧化物(Al 2O 3)1、化学性质与酸反应:Al 2O 3+6HCl=2AlCl 3+3H 2O与碱反应:Al 2O 3+2NaOH=2NaAlO 2+H 2O2、用途:熔点很高,是一种很好的耐火材料(Al 2O 3,MgO ),红宝石,蓝宝石的主要成分是氧化铝。

铝及其化合物1. 简介铝 (Aluminum) 是一种重要的金属元素,原子序数为13,化学符号为Al。
它属于13族元素,位于周期表的p区。
铝是地壳中含量最丰富的金属之一,存在于自然界中的矿石、土壤和岩石中。
2. 物理性质铝是一种具有银白色光泽的轻质金属,具有良好的导电性和导热性。
它的密度相对较低,为2.7 g/cm³,比许多其他金属都要轻。
铝的熔点为660.32℃,沸点为2519℃。
它具有良好的可塑性和可加工性,可以通过冶金工艺进行挤压、拉伸、铸造和轧制等加工过程。
3. 化学性质3.1 抗腐蚀性铝具有良好的抗腐蚀性,因为它能形成致密的氧化物膜表面,可以有效防止进一步的氧化和腐蚀。
3.2 反应性铝与空气中的氧气反应会生成一层薄的氧化铝表面,这一层氧化层可以保护铝的内部不被进一步氧化。
然而,在酸性介质中,铝会被溶解并产生氢气。
铝对碱性介质相对稳定,不会与碱发生剧烈反应。
4. 铝的主要用途4.1 建筑和建材铝是一种轻质金属,因此在建筑和建材领域有广泛的应用。
它可以用于制造铝合金门窗、铝制屋顶和外墙装饰板等。
4.2 包装由于铝的良好腐蚀性和可塑性,它被广泛用于食品和药品的包装材料。
例如,铝制罐头、箔纸和药品包装。
4.3 电力传输铝具有良好的导电性能,用于制造电力传输线路和电缆。
相比同等导电性能的铜导线,铝导线更轻便、成本更低。
4.4 汽车工业铝合金在汽车工业中的应用越来越广泛,可以降低汽车整体重量,提高燃油效率和降低尾气排放。
5. 铝的一些常见化合物5.1 氧化铝 (Al2O3)氧化铝是铝的一种重要化合物,也是一种常见的陶瓷材料。
它具有高熔点、高硬度和良好的绝缘性能,广泛应用于制陶、耐火材料和电子器件等领域。
5.2 氯化铝 (AlCl3)氯化铝是一种重要的无机化合物,通常以无水物的形式存在。
它是一种强酸性物质,可用作催化剂、腐蚀剂和氯化铝铝熔剂的原料。
5.3 硫酸铝 (Al2(SO4)3)硫酸铝是一种白色结晶固体,可溶于水。


铝及其化合物的性质教案第一章:铝的概述1.1 铝的物理性质铝的密度、熔点、沸点铝的色泽、硬度、延展性铝的电导率、热导率1.2 铝的化学性质铝的还原性、氧化性铝与其他元素的反应铝的腐蚀与防护第二章:铝的氧化物2.1 氧化铝的性质氧化铝的分子式、结构氧化铝的熔点、硬度氧化铝的酸碱性2.2 铝的氧化物在工业中的应用铝氧化物的制备方法铝氧化物在陶瓷、玻璃、涂料等领域的应用第三章:铝的氢氧化物3.1 氢氧化铝的性质氢氧化铝的分子式、结构氢氧化铝的溶解性、稳定性3.2 氢氧化铝的应用氢氧化铝在医药、食品、环保等领域的应用第四章:铝的卤化物4.1 铝的卤化物的性质铝的氯化物、溴化物、碘化物的分子式、结构铝的卤化物的熔点、沸点铝的卤化物的反应性4.2 铝的卤化物在工业中的应用铝的氯化物在铝熔炼、催化剂制备等领域的应用铝的溴化物、碘化物在半导体材料、医药等领域的应用第五章:铝的硫化物5.1 铝的硫化物的性质铝的硫化物的分子式、结构铝的硫化物的熔点、硬度铝的硫化物的反应性5.2 铝的硫化物在工业中的应用铝的硫化物在催化剂、耐火材料等领域的应用第六章:铝的氧化铝的性质与应用6.1 氧化铝的制备方法拜耳法、烧结法等氧化铝的纯度、粒度控制陶瓷、玻璃、磨料、催化剂等领域的应用第七章:铝的氢氧化物的制备与应用7.1 氢氧化铝的制备方法沉淀法、溶胶-凝胶法等氢氧化铝的粒度、孔隙结构控制7.2 氢氧化铝的应用医药、食品、环保、催化剂等领域的应用第八章:铝的卤化物的制备与应用8.1 铝的卤化物的制备方法气相法、液相法等铝的卤化物的纯度控制8.2 铝的卤化物的应用铝的氯化物在铝熔炼、催化剂制备等领域的应用铝的溴化物、碘化物在半导体材料、医药等领域的应用第九章:铝的硫化物的制备与应用9.1 铝的硫化物的制备方法直接法、间接法等铝的硫化物的纯度、粒度控制9.2 铝的硫化物的应用催化剂、耐火材料、高性能材料等领域的应用第十章:铝及其化合物的综合应用10.1 铝及其化合物的回收与利用废铝的回收技术铝及其化合物在循环经济中的应用10.2 铝及其化合物在新能源领域的应用铝在电动汽车、太阳能光伏等领域的应用铝及其化合物在核能、航空航天等领域的应用第十一章:铝及其化合物的环境影响与污染控制11.1 铝及其化合物的环境释放途径铝及其化合物的排放来源铝及其化合物在大气、水体、土壤中的迁移和转化11.2 铝及其化合物对环境的影响对生态系统和生物体的毒性对人类健康的影响11.3 铝及其化合物的污染控制与处理排放标准与法规污染治理技术,如吸附、沉淀、膜分离等第十二章:铝及其化合物的安全与健康12.1 铝及其化合物的危险性物理危害、化学危害火灾、爆炸、腐蚀等风险12.2 铝及其化合物的工作场所安全个人防护装备安全操作规程12.3 铝及其化合物的健康影响长期暴露的潜在健康风险职业病预防与控制第十三章:铝及其化合物的实验操作技术13.1 铝及其化合物的样品处理采样方法、样品保存样品的前处理技术,如溶解、过滤、洗涤等13.2 铝及其化合物的分析方法光谱分析、电化学分析原子吸收、X射线荧光等分析技术13.3 实验操作中的注意事项实验室安全规范化学品的正确储存与使用第十四章:铝及其化合物的研究与创新14.1 铝及其化合物的新合成方法绿色合成、可持续合成高效催化剂的研究与应用14.2 铝及其化合物的结构与性能关系材料设计、结构优化性能测试与评价14.3 铝及其化合物的创新应用功能性材料的研究与开发新能源、高性能电子器件等领域的前沿应用第十五章:铝及其化合物的教育与培训15.1 铝及其化合物的教育内容基础知识、应用技术案例分析、实验教学15.2 铝及其化合物的培训方法线上教学、线下授课实操培训、模拟演练15.3 铝及其化合物的教育与培训的重要性提升行业技术水平增强安全意识与环保意识重点和难点解析本文主要介绍了铝及其化合物的性质、制备方法、应用领域、环境影响、安全健康以及实验操作技术等方面的内容。


点燃 铝及其化合物 知识点一. 铝单质的性质1.物理性质:银白色金属,硬度和密度小,具有良好的导电导热性和延展性。
在空气中具有很好的耐腐蚀性。
2.化学性质:(1)与非金属单质反应:A 、2Al+3Cl 2====2AlCl 3B 、铝在空气中缓慢氧化,在氧气中点燃剧烈燃烧。
4Al+3O 2 ========= 2Al 2O 3铝与空气中的氧气反应生成致密的氧化膜并牢固地覆盖在铝表面,阻止了内部的铝与空气接触。
(2)与盐溶液反应:2Al+3CuSO 4 =3Cu+Al 2(SO 4)3(3)与某些氧化物反应—铝热反应:2Al + Fe 2O 3 == 2Fe + Al 2O 3 铝热剂是Al 和 Fe 2O 3(4)与沸水微弱反应:2Al+6H 2O Δ 2Al (OH )3 + 3H 2↑(5)与酸反应::2Al+6HCl ====== 2AlCl 3+H2↑2Al+3H 2SO 4 ====== Al 2(SO 4)3+ 3H2↑注意:铝在冷的浓硫酸、浓硝酸中钝化。
某些金属在常温下遇强氧化性酸如浓硫酸、浓硝酸时在表面生成致密的氧化膜,从而阻止内部金属进一步发生反应,这种现象称为钝化。
(6)与碱反应: 2Al+2NaOH+2H 2O=2NaAlO 2+3H 2↑反应的实质:分两步进行:②Al(OH)3+NaOH ======== NaAlO 2+2H 2O知识点二. 铝的重要化合物1. 氧化铝(Al 2O 3)化合价降低,被还原,得6e —①2Al+6H 2O ====== 2Al(OH)3 + 3H 2↑化合价升高,被氧化,失6e —2Al+6H 2O+2NaOH = 2NaAlO 2+3H 2↑+4H 2O失2×3 e —得6×e —(1)物理性质:白色固体、熔点高(2054℃) 、不溶于水,不与水化合。
常作耐火材料。
刚玉的主要成分是Al 2O 3 ,其中把含少量铬元素的刚玉称为红宝石;含少量的铁和钛元素的刚玉称为蓝宝石。

高中化学铝及其化合物知识点
高中化学铝及其化合物知识点
一、铝的基本性质
铝是一种具有典型金属性的轻金属,具有许多良好的物理化学性质,例如具有较高的导热性和电导率,低密度和良好的可塑性等。
二、铝的制备方法
1. 金刚砂法
2. 电解法
三、铝的氧化物——氧化铝
氧化铝是一种常见的氧化物,也是铝的重要产物。
它具有很高的熔点和硬度,在高温环境下能保持极好的稳定性。
四、铝的氢氧化物——氢氧化铝
氢氧化铝是一种白色无定形粉末,容易吸收水分,也是很常见的铝的化合物。
它常用于制备其他铝化合物,如氧化铝等。
五、铝与酸、碱的反应
铝在一定的条件下与酸发生反应,会产生氢气和相应的铝盐。
与碱的反应则会生成相应的铝盐和氢氧化铝。
六、铝的应用领域
1. 金属材料——铝合金
2. 化工领域——氢氧化铝生产
3. 医疗领域——生物医学器械制造
4. 轻工业——食品包装、建筑材料
七、铝在环境中的影响
铝的大量排放对环境和生态系统造成了很大的负担,铝在水体中的存在会导致生态系统的异常变化和动植物死亡。
同时,铝的废弃物也会污染土地和空气,对人类健康造成不良影响。
八、铝及其化合物的安全问题
铝及其化合物存在一定的安全问题,长期接触铝化合物会对人体神经系统产生影响,增加患上老年痴呆症等疾病的概率。
总之,对于高中化学学生而言,学习铝及其化合物的知识点是非常重要的,理解这些知识将有助于他们更好地掌握化学基础理论,从而为未来更深入地研究化学打下坚实的基础。


铝及其化合物(一)铝的性质1、物理性质:银白色金属,质较软,但比镁要硬,熔点比镁高。
有良好的导电、导热性和延展性。
2、化学性质:铝是较活泼的金属①通常与氧气易反应,生成致密的氧化物起保护作用。
4Al + 3O2 == 2Al2O3。
同时也容易与Cl2、S等非金属单质反应。
②与酸反应:强氧化性酸,如浓硫酸和浓硝酸在常温下,使铝发生钝化现象;加热时,能反应,但无氢气放出;非强氧化性酸反应时放出氢气。
(2Al+6H+=2Al3++3H2↑)③与强碱溶液反应:2Al + 2NaOH + 2H2O == 2NaAlO2 + 3H2↑(2Al+2OH-+2H2O=2AlO2-+3H2↑ )④与某些盐溶液反应:如能置换出CuSO4、AgNO3等溶液中的金属。
⑤铝热反应:铝与某些金属氧化物的反应(如V、Cr、Mn、Fe的氧化物)叫做铝热反应2Al + Fe2O3高温Al2O3 + 2FeAl 和Fe2O3的混合物叫做铝热剂,利用铝热反应焊接钢轨。
(二)氧化铝(Al2O3)白色固体,熔点高(2054℃),沸点2980℃,常作为耐火材料;是两性氧化物。
我们常见到的宝石的主要成分是氧化铝。
有各种不同颜色的原因是在宝石中含有一些金属氧化物的表现,如红宝石因含有少量的铬元素而显红色,蓝宝石因含有少量的铁和钛元素而显蓝色。
工业生产中的矿石刚玉主要成分是α-氧化铝,硬度仅次于金刚石,用途广泛。
两性氧化物:既能与强酸反应又能与强碱反应生成盐和水的氧化物Al2O3 + 6HCl == 2AlCl3 + 3H2O ,Al2O3 + 2NaOH == 2NaAlO2 + H2OAl2O3是工业冶炼铝的原料,由于氧化铝的熔点高,电解时,难熔化,因此铝的冶炼直到1886年美国科学家霍尔发现在氧化铝中加入冰晶石(Na3AlF6 ),使氧化铝的熔点降至1000度左右,通电铝的冶炼才快速发展起来,铝及其合金才被广泛的应用。
2Al2O3 4Al + 3O2↑(三)氢氧化铝(Al(OH)3)白色难溶于水的胶状沉淀,是两性氢氧化物。

铝及其重要化合物一、铝1.物理性质:银白色有金属光泽的固体,有良好的延展性、导电性和传热性等,密度较小,质地柔软。
2.化学性质:(1)与非金属单质的反应:①铝与O 2反应:Al+3O 22Al 2O 3(在纯氧中,剧烈燃烧,发出耀眼的白光)②铝与S 反应:2Al+3SAl 2S3③铝与Cl 2反应:2Al +3Cl 2=====点燃2AlCl 3(2)与金属氧化物的反应(铝热反应):2Al+Fe 2O 32Fe+Al 2O 3 ;4Al+3MnO 23Mn+2Al 2O 3(3)铝与非氧化性酸反应:2Al + 6HCl =2Al Cl 3 + 3H 2↑ 2Al + 3H 2SO 4 =Al 2(SO 4)3 + 3H 2↑(4)铝与氧化性酸反应:遇冷的浓硫酸或浓硝酸钝化。
在加热条件下可与浓硫酸、浓硝酸反应但无H 2产生。
(5)铝与氢氧化钠溶液的反应:铝和碱溶液反应,不是直接和碱反应,而是铝先和强碱溶液中的水反应生成Al(OH)3,然后Al(OH)3再和强碱反应生成偏铝酸盐。
2Al +6H 2O=2Al(OH)3+3H 2↑, Al(OH)3+NaOH=2NaAlO 2+2H 2O总反应化学方程式为:2Al +2H 2O +2NaOH=2NaAlO 2+3H 2↑,其中氧化剂只是H 2O ,而不是NaOH 。
3.制备:工业上采用电解法:2Al 2O 3=====电解4Al +3O 2↑4.用途:纯铝用作导线(不能用作电缆线),铝合金用于制造汽车、飞机、生活用品等。
二、氧化铝(1)物理性质:高熔点,高沸点,高硬度,难溶于水的白色固体。
(2)化学性质:氧化铝难溶于水,却能溶于酸或强碱溶液中。
Al 2O 3 + 6HCl =2AlCl 3 + 3H 2O Al 2O 3 + 2NaOH = 2NaAlO 2 + H 2O因此说Al 2O 3是两性氧化物(既能与酸反应生成盐和水,又能与碱反应生成盐和水的金属氧化物。

镁、铝及其化合物班级姓名一、铝单质铝元素在地壳中含量丰富,仅次于。
自然界中的铝全部以态存在;铝土矿的主要成分是氧化铝。
(一)物理性质银白色有金属光泽的固体,有良好的、和,是质地的轻金属。
(二)化学性质1、与非金属单质反应(1)与O2反应:常温下,铝表面可形成致密的保护层,故金属铝有一定的抗腐蚀性。
点燃或加热时与O2反应的化学方程式为:。
(2)在点燃或加热的条件下与Cl2、S反应,化学反应方程式分别为:,2、与酸反应(常温下铝遇、能够发生钝化)。
与盐酸反应的化学方程式为:,离子方程式:3、与强碱(如NaOH)溶液反应的化学方程式为:。
离子方程式:4、与某些盐(如CuCl2)溶液反应的化学方程式为:。
离子方程式:5、与金属氧化物(如Fe2O3)反应(铝热反应)的化学方程式为:。
(三)铝的制备通电电解熔融的Al2O3:2Al2O3 4A l+3O2↑二、氧化铝(一)物理性质:白色固体,硬度高,熔沸点高。
刚玉、红宝石、蓝宝石的主要成分为α—氧化铝。
(二)化学性质:两性氧化物:与酸、碱都能反应生成盐和水的氧化物。
1、与盐酸反应的化学方程式为:,离子方程式:2、与NaOH 溶液反应的化学方程式为: 。
离子方程式:(三)用途:用作制造耐火材料如坩锅、耐火管、耐高温的实验仪器等三、氢氧化铝:(一)物理性质:白色固体,难溶于水。
(二)化学性质:1、受热分解:化学反应方程式为: 。
2、两性:有关的化学方程式和离子方程式为:与盐酸的反应: ;离子方程式: 。
与NaOH 的反应: ;离子方程式: 。
(三)用途:1、治疗胃酸过多,其原理可用离子方程式表示为: 。
2、铝盐水解生成的Al(OH)3胶体可净水。
(四)制取:可溶性铝盐与氨水反应的化学方程式: 。
离子方程式: 。
四、镁(一)物理性质:银白色,有金属光泽,熔点低,硬度小,密度小。
(二)化学性质1、能与O2、Cl 2、N 2等非金属单质反应,产物分别为MgO 、MgCl 2、Mg 3N 2。
铝的化学知识点总结一、铝的性质1. 物理性质铝是一种银白色、柔软的轻质金属,在常温下具有良好的导电性和导热性。
纯铝的密度为2.7g/cm3,熔点为660°C,沸点为2467°C,具有一定的延展性和塑性,易于加工成各种形状的制品。
2. 化学性质铝是一种较活泼的金属,具有一定的化学活性。
在常温下,铝能与氧、氮、硫等非金属元素反应,在高温下能与氢、氨等元素发生反应。
铝在空气中易被氧化形成一层致密的氧化膜,这层氧化膜可以保护铝不被更多的氧气侵蚀,使铝具有较好的耐腐蚀性。
此外,铝还能与非金属元素形成盐类化合物,如氯化铝、硫酸铝等。
3. 与其他元素的化合物铝与氧形成的氧化铝是最常见的化合物,化学式为Al2O3。
氧化铝具有很强的耐火性和耐腐蚀性,被广泛应用于陶瓷、耐火材料、磨料等工业领域。
此外,铝还能与氯、硫、氮等元素形成不同的盐类化合物,这些化合物在工业生产和日常生活中也有着重要的应用。
二、铝的用途1. 工业领域由于铝具有较好的导电性、导热性和耐腐蚀性,被广泛应用于电力、电子、航空航天等工业领域。
铝及其合金在制造导线、散热器、飞机、汽车等方面有着重要的作用。
2. 包装材料铝具有轻质、不透水、不透气、耐高温等特点,被广泛应用于包装材料的制造。
铝箔、铝包装盒、铝罐等产品在食品、药品、化妆品等行业起着重要的包装保护作用。
3. 建筑领域铝及其合金在建筑领域有着广泛的应用,如制造铝门窗、铝合金型材、铝幕墙等。
铝制品具有轻质、耐腐蚀、美观等特点,能满足建筑材料的需求,受到建筑行业的青睐。
4. 化工领域氧化铝、硫酸铝、氯化铝等铝化合物在化工领域应用广泛,用于制造催化剂、吸附剂、电解铝等产品,具有重要的工业价值。
三、铝的生产铝的生产主要有两种方式,一种是电解法,另一种是氧化铝法。
1. 电解法电解法是目前铝的主要生产方式。
该方法首先需要从矿石中提取氧化铝,随后通过电解法将氧化铝转化为铝金属。
电解法具有生产效率高、产品质量稳定等优点,被广泛应用于工业生产中。
铝及其重要化合物一、铝1.物理性质:银白色有金属光泽的固体,有良好的延展性、导电性和传热性等,密度较小,质地柔软。
2.化学性质:(1)与非金属单质的反应:①铝与O 2反应:Al+3O 22Al 2O 3(在纯氧中,剧烈燃烧,发出耀眼的白光)②铝与S 反应:2Al+3SAl 2S3③铝与Cl 2反应:2Al +3Cl 2=====点燃2AlCl 3(2)与金属氧化物的反应(铝热反应):2Al+Fe 2O 32Fe+Al 2O 3 ;4Al+3MnO 23Mn+2Al 2O 3(3)铝与非氧化性酸反应:2Al + 6HCl =2Al Cl 3 + 3H 2↑ 2Al + 3H 2SO 4 =Al 2(SO 4)3 + 3H 2↑(4)铝与氧化性酸反应:遇冷的浓硫酸或浓硝酸钝化。
在加热条件下可与浓硫酸、浓硝酸反应但无H 2产生。
(5)铝与氢氧化钠溶液的反应:铝和碱溶液反应,不是直接和碱反应,而是铝先和强碱溶液中的水反应生成Al(OH)3,然后Al(OH)3再和强碱反应生成偏铝酸盐。
2Al +6H 2O=2Al(OH)3+3H 2↑, Al(OH)3+NaOH=2NaAlO 2+2H 2O总反应化学方程式为:2Al +2H 2O +2NaOH=2NaAlO 2+3H 2↑,其中氧化剂只是H 2O ,而不是NaOH 。
3.制备:工业上采用电解法:2Al 2O 3=====电解4Al +3O 2↑4.用途:纯铝用作导线(不能用作电缆线),铝合金用于制造汽车、飞机、生活用品等。
二、氧化铝(1)物理性质:高熔点,高沸点,高硬度,难溶于水的白色固体。
(2)化学性质:氧化铝难溶于水,却能溶于酸或强碱溶液中。
Al 2O 3 + 6HCl =2AlCl 3 + 3H 2O Al 2O 3 + 2NaOH = 2NaAlO 2 + H 2O因此说Al 2O 3是两性氧化物(既能与酸反应生成盐和水,又能与碱反应生成盐和水的金属氧化物。