铝及其化合物的性质实验
- 格式:ppt
- 大小:1002.50 KB
- 文档页数:25

《铝及其化合物的性质》教学设计一、学习目标1.知道氧化铝和氢氧化铝的性质,了解它们在生产生活中的作用。
2.了解两性氧化物和两性氢氧化物的概念,知道氧化铝和氢氧化铝分别是两性氧化物和两性氢氧化物。
3.了解红宝石、蓝宝石的主要成分。
二、教学重点及难点重点:氧化铝和氢氧化铝的两性难点:理解物质的两性和铝化合物之间转化的关系三、教法学法分析情境引入法—利用宝石节引入绚丽多彩的宝石从而引入本节课。
讲解讨论法—用于“两性”概念的学习。
实验设计法—课堂中通过小组合作实验探索Al(OH)3的制备和验证Al2O3的两性,体验同伴学习的乐趣。
类比分析法—如氧化物与氢氧化物的区别,酸性和碱性的体现。
自学引导法—在老师的引导下学生自己学习教材上的资料卡内容四、教学过程【创设情境】第九届梧州国际宝石节就要到来了,引入一些关于氧化铝宝石的一些图片,比如红宝石,蓝宝石等。
同时引入坩埚胃舒平的图片,引入本节课的课题。
介绍氧化铝的天然存在形式【播放图片】美丽的宝石等(ppt 1-10)【设问】红、蓝宝石的主要成分是什么?【讲述】氧化铝的存在形式有那些呢?我们看投影。
【播放图片】氧化铝的天然存在形式(ppt12)【设问】通过前面的学习,我们对氧化铝有了初步的了解,请推测其可能性质,并用所给药品进行验证?(现有试剂:氧化铝、10%盐酸、6mol/L的氢氧化钠溶液。
)(ppt13 ) 演示实验1、Al2O3 与H2SO42、Al2O3与NaOH(探究1)将氧化铝与其他碱性氧化物类比,得出什么规律?(探究2)将氧化铝与其他酸性氧化物类比,得出什么规律?【学生活动得出结论】Al2O3既能盐酸反应,又能与氢氧化钠反应。
【讲述】既可以与酸反应又可以与碱反应生成盐和水的氧化物称之为两性氧化物。
【练习】上述离子方程式【过渡】氧化铝的性质如何,哪些应用呢?请同学先阅读课本66页的资料卡:“氧化铝及其应用”,然后归纳性质和应用。
【板书】一、氧化铝的性质:(ppt 15)1.物性:高硬度、高熔点、高沸点2.化性:两性氧化物——既能与酸反应又能碱反应生成盐和水的氧化物a.与酸反应:Al2O3+6HCl==2AlCl3+3H2Ob.与碱反应:Al2O3+2 NaOH==2NaAlO2 +H2O3.用途:可作很好的耐火材料及用做提取铝的原料。


一、实验目的1. 通过实验,了解铝及其化合物的性质。
2. 掌握铝及其化合物的制备方法。
3. 熟悉实验操作技能,提高实验分析能力。
二、实验原理铝是一种具有高活性金属,能与酸、碱等物质发生反应。
本实验主要涉及铝的氧化物、氢氧化物、盐类等化合物的性质研究。
三、实验器材1. 仪器:试管、烧杯、酒精灯、胶头滴管、玻璃棒、铁架台、石棉网等。
2. 试剂:铝片、氢氧化钠溶液、盐酸、硫酸铜溶液、硫酸铝溶液、氯化铁溶液等。
四、实验步骤1. 铝与盐酸反应(1)取一小块铝片,用砂纸打磨表面,去除氧化膜。
(2)在试管中加入少量盐酸,然后将铝片放入试管中。
(3)观察铝片表面有无气泡产生,记录实验现象。
2. 铝与氢氧化钠溶液反应(1)在试管中加入少量氢氧化钠溶液。
(2)将打磨过的铝片放入试管中。
(3)观察铝片表面有无气泡产生,记录实验现象。
3. 铝与硫酸铜溶液反应(1)在试管中加入少量硫酸铜溶液。
(2)将打磨过的铝片放入试管中。
(3)观察铝片表面有无气泡产生,记录实验现象。
4. 铝与氯化铁溶液反应(1)在试管中加入少量氯化铁溶液。
(2)将打磨过的铝片放入试管中。
(3)观察铝片表面有无气泡产生,记录实验现象。
五、实验结果与分析1. 铝与盐酸反应实验现象:铝片表面产生气泡,溶液由无色变为浅绿色。
分析:铝与盐酸反应生成氯化铝和氢气,反应方程式为:2Al + 6HCl = 2AlCl3 + 3H2↑。
2. 铝与氢氧化钠溶液反应实验现象:铝片表面产生气泡,溶液由无色变为无色。
分析:铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,反应方程式为:2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2↑。
3. 铝与硫酸铜溶液反应实验现象:铝片表面产生气泡,溶液由蓝色变为浅绿色。
分析:铝与硫酸铜溶液反应生成硫酸铝和铜,反应方程式为:2Al + 3CuSO4 =Al2(SO4)3 + 3Cu。
4. 铝与氯化铁溶液反应实验现象:铝片表面产生气泡,溶液由黄色变为浅绿色。

课题1铝及其化合物的性质一、铝的性质及实验注意事项1.铝与氧气反应实验的注意事项(1)铝片要薄,使用前用细砂纸轻轻打磨掉氧化膜,可用香烟盒或纸制电容器上的铝箔。
(2)反应放出大量热,生成的固体温度较高,集气瓶瓶底盛有少量水或放入细沙,起隔热作用,防止集气瓶炸裂。
(3)铝箔不易直接点燃,火柴有引燃作用,也可改用镁条引燃。
(4)待火柴快要燃烧完时,将铝条伸入盛有氧气的集气瓶.若插入过早或直接将铝箔插入瓶底,会因火柴燃烧消耗较多的氧气或将部分氧气排出瓶外,使铝箔不能充分燃烧。
2.Al3+、Al(OH)3、Al(OH)错误!间的相互转化由于Al(OH)3具有两性,在不同情况下Al3+、Al(OH)3、Al(OH)错误!间能相互转化,其转化关系如下:此转化有许多重要应用如选择制备Al(OH)3的最佳途径,判断离子共存问题,用于物质的推断、检验,还经常涉及定量计算。
3.铝热反应的实验注意事项注意事项:①Fe2O3粉末与Al粉要选干燥的,Al粉要用未被氧化的,否则,反应难以进行.②Fe2O3与Al的物质的量之比要控制在1∶2,且二者要混合均匀,以保证Fe2O3与Al都完全反应。
③玻璃漏斗内的纸漏斗要厚一些(如四层纸),并要用水润湿,以防损伤玻璃漏斗。
④承接反应物的蒸发皿内要垫适量细沙,一是防止蒸发皿炸裂,二是防止熔融的固体溅出伤人。
⑤实验装置不要距离人群太近,或将实验在玻璃通风橱内操作,防止人体受伤。
【例1】镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)的关系如下图所示。
反应中镁和铝的( )A.物质的量之比为3∶2B.质量之比为3∶2C.摩尔质量之比为2∶3D.反应速率之比为2∶3解析:由图像可知,两个反应中生成的氢气一样多,说明两种金属提供的电子数目一样多,则镁、铝的物质的量之比为3∶2,质量之比为4∶3,A项正确,B项错误。
镁、铝的摩尔质量之比为8∶9,C项错误。
由图像可知,镁、铝与硫酸反应需要的时间之比为2∶3,则二者的速率之比为3∶2,D项错误。

铝及其化合物的性质一.【实验目的】1.了解金属铝的活泼性质,铝和其氧化物、氢氧化物的两性.铝热法还原反应原理。
2.掌握沉淀的生成离心、转移和铝热法的安全操作等实验技能。
二.【实验原理】1.铝是亲氧元素,又是典型的两型元素,其单质,氧化物以及亲氧化物都能与强酸强碱发生反应。
2.当铝接触空气或氧气,其表面会被生成的致密的氧化膜所覆盖,但是当氧化膜被破坏或不能生成时,铝很快就会被氧化成三氧化二铝。
3.铝粉和金属氧化物粉末(如四氧化三铁)按一定比例混合,用引燃剂点燃,铝氧化时放出大量的热,反应剧烈进行,得到氧化铝和还原的金属(如铁),称为铝热还原法。
三.【实验用品】仪器和材料:蒸发皿、试管、离心管、量筒、滴管、离心机、托盘天平、坩埚钳、三角架、泥三角、镊子、细沙、砂纸、滤纸、玻棒、酒精灯、火柴、试管夹、脱脂棉药品:2mol/L HCL、3mol/LH2SO4、2mol/LNaO H、6mol/L NaO H、浓NH3·H2O、0.5mol/LAL2(SO4)、蒸馏水、KClO3固体、Fe3O4固体、铝片、铝屑、铝粉、镁条和硫粉。
实验组织:整个实验四人一组,由于只有一台离心机,所以前5组先在实验室做两性实验,最后4组到实验室外做铝热实验。
做完实验个小组将自己的实验台打扫干净,大家进行讨论完后方可离开实验室,做的过程中不要大声喧哗,并注意安全。
四.实验预习1.了解铝的化学性质,如铝的两性、金属活动性顺序等。
2.氢氧化铝的两性3.了解铝热反应的实验装置及相关工业制铝法。
五实验内容1.铝的氧化――"毛刷"实验将长2cm宽1cm的铝片表面用砂纸打,在放有饱和HgCl2溶液的表面皿中浸泡半分钟,用镊子捏出并用脱脂棉将铝片表面吸干,放入干燥、洁净的试管中,观察实验现象 2.铝与强酸强碱溶液的反应(1)在两支干净的试管,分别放入铝粉少许,向其中一支试管滴加 6mol/L氢氧化钠溶液约6-7滴,加热并在管口用燃着的火柴检验生成的气体。

铝及其化合物(一)铝的性质1、物理性质:银白色金属,质较软,但比镁要硬,熔点比镁高。
有良好的导电、导热性和延展性。
2、化学性质:铝是较活泼的金属①通常与氧气易反应,生成致密的氧化物起保护作用。
4Al + 3O2 == 2Al2O3。
同时也容易与Cl2、S等非金属单质反应。
②与酸反应:强氧化性酸,如浓硫酸和浓硝酸在常温下,使铝发生钝化现象;加热时,能反应,但无氢气放出;非强氧化性酸反应时放出氢气。
(2Al+6H+=2Al3++3H2↑)③与强碱溶液反应:2Al + 2NaOH + 2H2O == 2NaAlO2 + 3H2↑(2Al+2OH-+2H2O=2AlO2-+3H2↑ )④与某些盐溶液反应:如能置换出CuSO4、AgNO3等溶液中的金属。
⑤铝热反应:铝与某些金属氧化物的反应(如V、Cr、Mn、Fe的氧化物)叫做铝热反应2Al + Fe2O3高温Al2O3 + 2FeAl 和Fe2O3的混合物叫做铝热剂,利用铝热反应焊接钢轨。
(二)氧化铝(Al2O3)白色固体,熔点高(2054℃),沸点2980℃,常作为耐火材料;是两性氧化物。
我们常见到的宝石的主要成分是氧化铝。
有各种不同颜色的原因是在宝石中含有一些金属氧化物的表现,如红宝石因含有少量的铬元素而显红色,蓝宝石因含有少量的铁和钛元素而显蓝色。
工业生产中的矿石刚玉主要成分是α-氧化铝,硬度仅次于金刚石,用途广泛。
两性氧化物:既能与强酸反应又能与强碱反应生成盐和水的氧化物Al2O3 + 6HCl == 2AlCl3 + 3H2O ,Al2O3 + 2NaOH == 2NaAlO2 + H2OAl2O3是工业冶炼铝的原料,由于氧化铝的熔点高,电解时,难熔化,因此铝的冶炼直到1886年美国科学家霍尔发现在氧化铝中加入冰晶石(Na3AlF6 ),使氧化铝的熔点降至1000度左右,通电铝的冶炼才快速发展起来,铝及其合金才被广泛的应用。
2Al2O3 4Al + 3O2↑(三)氢氧化铝(Al(OH)3)白色难溶于水的胶状沉淀,是两性氢氧化物。


考点10 铝金属及其化合物的性质实验【考点定位】本考点考查铝金属及其化合物的性质实验,涉及铝及其氧化物、氢氧化物的两性实验,铝热反应的原理与操作要点,以及氢氧化铝的制备和性质探究等,明确含铝及其化合物的混合物分离提纯方法。
【精确解读】 一、铝的燃烧实验探究 实验原理:4Al+3O22Al 2O 3实验步骤:将铝片剪成长5~8 cm 、宽0.2~0.3 cm 的铝条,绕成螺旋状,一端绕紧一根火柴.实验时,用坩埚钳夹紧铝条的另一端,点燃铝条上的火柴,待火柴快要燃烧完时,将铝条伸入盛有氧气的集气瓶(瓶底盛有少量水)中,观察到的现象是发出耀眼的白光,有少量白烟。
二、铝热反应实验探究 1.实验原理:铝热法是一种利用铝的还原性获得高熔点金属单质的方法. 可简单认为是铝与某些金属氧化物(如Fe 2O 3、Fe 3O 4、Cr 2O 3、V 2O 5等)在高热条件下发生的反应.铝热反应常用于冶炼高熔点的金属,并且它是一个放热反应其中镁条为引燃剂,氯酸钾为助燃剂.镁条在空气中可以燃烧,氧气是氧化剂.但插入混合物中的部分镁条燃烧时,氯酸钾则是氧化剂,以保证镁条的继续燃烧,同时放出足够的热量引发金属氧化物和铝粉的反应。
2.实验步骤:①把少量氧化铁和少量铝粉充分混合;②少许的铝热剂与少量完全粉碎的氯酸钾充分混合.将它撒在铝热剂上面;③在铝热剂上插上一根镁条,以使镁带燃烧时产生足够的热量点燃铝热剂.点燃镁条后,戴好墨镜,以防闪光伤眼;④在铝热剂下放一些废铁,可以被铝热剂燃烧时产生大量的热量熔化,变成炙热、亮黄色的铁水,非常壮观.注意安全.⑤实验现象:镁条剧烈燃烧,放出大量热能,使氧化铁粉末和铝粉在高温下发生剧烈的氧化还原反应.最终生成液态的铁和氧化铝。
三、氢氧化铝的制备和性质探究点燃试管中产生白色絮状沉淀 Al 2(SO 4)3+6NH 3•H 2O═2Al(OH)3↓+3(NH 4)2SO 4试管中白色沉淀溶解 Al(OH)3+3HCl═AlCl 3+3H 2O试管中白色沉淀溶解Al(OH)3+NaOH═NaAlO 2+2H 2O【精细剖析】1.铝与酸、碱反应生成H 2的量的关系铝与酸、碱反应的化学方程式分别为2Al +6HCl===2AlCl 3+3H 2↑、2Al +2NaOH +2H 2O===2NaAlO 2+3H 2↑。


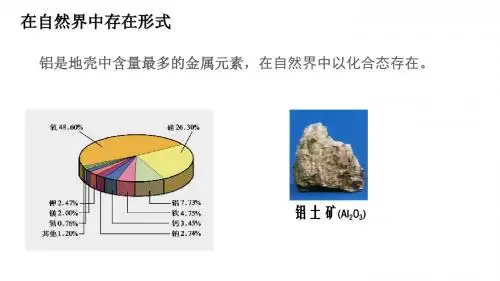
课题一 铝及其化合物的性质【学考报告】知识条目 加试要求①铝片(条)燃烧的方法 b ②铝表面氧化膜的作用b1.铝的结构与性质 (1)结构和存在铝位于元素周期表第3周期ⅢA 族,原子结构示意图为。
铝元素在地壳中含量丰富,仅次于硅。
自然界中的铝全部以化合态存在。
(2)化学性质写出图中有关反应的化学方程式: ①②2Al +3Cl 2=====点燃2AlCl 3③④2Al +2NaOH +6H 2O===2Na[Al(OH)4]+3H 2↑ ⑤2Al +Fe 2O 3=====高温Al 2O 3+2Fe(铝热反应) (3)制备2.铝的化合物的性质 (1)氧化铝①物理性质:白色固体,难溶于水,有很高的熔点。
②化学性质 (2)氢氧化铝 ①物理性质白色胶状不溶于水的固体,有较强的吸附性。
②化学性质 Ⅰ.Ⅱ.Al(OH)3的电离写出图中有关反应的化学方程式或离子方程式: a.Al(OH)3+3H +===Al 3++3H 2O ; b.Al(OH)3+OH -===Al(OH)-4; c.2Al(OH)3=====△Al 2O 3+3H 2O 。
③制备Ⅰ.向铝盐中加入氨水,离子方程式为Al 3++3NH 3·H 2O===Al(OH)3↓+3NH +4。
Ⅱ.Na[Al (OH)4]溶液中通入足量CO 2,离子方程式为Al(OH)-4+CO 2===Al(OH)3↓+HCO -3。
Ⅲ.Na[Al(OH)4]溶液与AlCl 3溶液混合:离子方程式为3Al(OH)-4+Al 3+===4Al(OH)3↓。
(3)常见的铝盐①硫酸铝钾是由两种不同的金属离子和一种酸根离子组成的复盐。
②明矾的化学式为KAl(SO 4)2·12H 2O ,它是无色晶体,可溶于水,水溶液pH<7(填“<”、“>”或“=”)。
明矾可以净水。
其净水的原理是Al3++3H2O Al(OH)3(胶体)+3H+,Al(OH)3胶体吸附水中悬浮杂质形成沉淀而净水。
铝及其重要化合物一、铝1.物理性质:银白色有金属光泽的固体,有良好的延展性、导电性和传热性等,密度较小,质地柔软。
2.化学性质:(1)与非金属单质的反应:①铝与O 2反应:Al+3O 22Al 2O 3(在纯氧中,剧烈燃烧,发出耀眼的白光)②铝与S 反应:2Al+3SAl 2S3③铝与Cl 2反应:2Al +3Cl 2=====点燃2AlCl 3(2)与金属氧化物的反应(铝热反应):2Al+Fe 2O 32Fe+Al 2O 3 ;4Al+3MnO 23Mn+2Al 2O 3(3)铝与非氧化性酸反应:2Al + 6HCl =2Al Cl 3 + 3H 2↑ 2Al + 3H 2SO 4 =Al 2(SO 4)3 + 3H 2↑(4)铝与氧化性酸反应:遇冷的浓硫酸或浓硝酸钝化。
在加热条件下可与浓硫酸、浓硝酸反应但无H 2产生。
(5)铝与氢氧化钠溶液的反应:铝和碱溶液反应,不是直接和碱反应,而是铝先和强碱溶液中的水反应生成Al(OH)3,然后Al(OH)3再和强碱反应生成偏铝酸盐。
2Al +6H 2O=2Al(OH)3+3H 2↑, Al(OH)3+NaOH=2NaAlO 2+2H 2O总反应化学方程式为:2Al +2H 2O +2NaOH=2NaAlO 2+3H 2↑,其中氧化剂只是H 2O ,而不是NaOH 。
3.制备:工业上采用电解法:2Al 2O 3=====电解4Al +3O 2↑4.用途:纯铝用作导线(不能用作电缆线),铝合金用于制造汽车、飞机、生活用品等。
二、氧化铝(1)物理性质:高熔点,高沸点,高硬度,难溶于水的白色固体。
(2)化学性质:氧化铝难溶于水,却能溶于酸或强碱溶液中。
Al 2O 3 + 6HCl =2AlCl 3 + 3H 2O Al 2O 3 + 2NaOH = 2NaAlO 2 + H 2O因此说Al 2O 3是两性氧化物(既能与酸反应生成盐和水,又能与碱反应生成盐和水的金属氧化物。
2-1 铝及其化合物的性质路桥中学梁杏娟实验1.铝与氧气反应的实验探究实验原理:由于铝表面有一层致密的氧化膜的保护,所以铝不易在空气中燃烧。
因此可考虑去保护膜、增加氧气的浓度、增大铝的接触面积等方法使铝能在氧气中燃烧。
探究1:铝片在纯氧中燃烧实验注意点:1、铝片的大小:0.1mm×0.3cm×10cm2、使用前先用砂纸均匀打磨3、缠绕方式:两头缠紧,中间要松4、氧气制取:(量要多一点)原料:双氧水,MnO2集气瓶:250ml收集:排水法5、伸入时间:使火焰包围住铝片,火柴快要燃尽时6、实验现象:耀眼的白光探究2:铝粉在纯氧中燃烧1、在一小片滤纸条上均匀地涂上一层铝粉2、现象:涂有铝粉的滤纸在空气中燃烧即火星四射,放到纯氧中燃烧更加剧烈实验2:铝表面氧化膜的实验探究本实验的目的是希望通过四个对比实验让学生体验到铝表面氧化膜的存在。
与硫酸铜反应的铝片分别是用砂纸除去氧化膜的铝片、用氢氧化钠溶液洗去氧化膜的铝片、未采取去膜处理的铝片,先用砂纸打磨再用浓硝酸钝化的铝片。
注意:1、用氢氧化钠溶液洗铝片时可采取加热措施,看到气泡后还要继续反应。
2、用浓硝酸钝化铝片的时间要3分钟以上教参对该实验现象的描述是:用砂纸除去氧化膜的铝片、用氢氧化钠溶液洗去氧化膜的铝片在放入0.5mol/L 20ml的硫酸铜溶液中后,铝片表面很快出现海绵状的暗红色物质,接下来铝片又产生大量气泡,溶液温度迅速升高。
而未除氧化膜和钝化处理的铝片在短时间内无明显变化。
而我们做出的实验现象却是:半小时才有一点点如教参所述的现象。
我们的疑惑:可见不管有没有除氧化膜的铝片与硫酸铜反应都非常的慢,其原因是铝表面的氧化膜靠磨擦或用氢氧化钠溶液都很难彻底除去,硫酸根会抑制铝表面氧化膜的破坏。
有人曾对此进行了实验探究和理论解释(胡明盛.铝与铜盐溶液反应的研究和建议,化学教育.2006.8:53-55 ),我们把硫酸铜的浓度提高到1.0mol/L,短时间内也未见明显实验现象。