电导率和摩尔电导率
- 格式:ppt
- 大小:763.00 KB
- 文档页数:20


2.1 电解质溶液的电导思考题1. 什么是溶液的电导、电导率和摩尔电导率?它们的相互关系如何?答: 将电解质溶液放入两平行电极间,两电极距离为L ,两电极面积为A ,这时溶液的电导G 是:R G 1= = LA κ 式中电导G 即电阻的倒数,单位为西门子(S 或Ω-1);κ称为电导率,为电极面积为1 m 2,电极距离为1 m 时两极间的电导,亦即电阻率的倒数。
SI 单位为S ·m -1。
摩尔电导率的定义式是该溶液的电导率与其浓度之比。
Λm =cκ (8-19) 其物理意义表示两个相距1 m 的电极间含1 mol 电解质的溶液时两电极间的电导率。
单位为S ·m 2·mol -1。
2. 影响电解质溶液导电能力的因素有哪些?答: 电解质溶液的导电能力与温度、电解质性质、溶剂、溶液的浓度等因素有关。
3. 强、弱电解质的摩尔电导率与浓度的关系有何不同?答: Λm 随浓度变化的规律,强弱电解质各不相同。
强电解质的稀溶液符合科尔劳斯(Kohlrausch F )经验公式:Λm =Λm ∞ - A ×c式中,Λm ∞为无限稀摩尔电导率,A 为常数。
对弱电解质,导电离子数随溶液的稀释、电离度α的增大而增大,当溶液无限稀释时,弱电解质完全电离,α=1,因而有:α==ΛΛ∞数之比电解质溶液中导电离子mol m m14. 结合教材学习和你所完成的实验,谈谈电导率的测定有哪些应用?答: 1.计算弱电解质的解离度和解离常数; 2.测定难溶盐的溶解度; 3. 检验水的纯度;4 应用于动力学研究;5 电导滴定;等等。
2.2 蔗糖水解反应的速率常数测定思考题1. 蔗糖水解反应的反应速率常数k 值与哪些因素有关?答:与温度,催化剂有关。
2. 蔗糖水解反应中H +的作用是什么?答:起催化剂的作用。
3. 一级反应有什么动力学特征?答:① lnc 与 t 成线型关系。
②半衰期与反应物初始浓度无关。

实验十六 电导法测定氯化银的溶度积和溶解度思考题1、电导、电导率和摩尔电导率是如何定义的?三者分别以何符号表示?三者之间有何联系和区别?2、电导池常数K 的物理意义是什么?其数值如何测得?3、在运用公式c m /κ=Λ进行有关计算时,c 的单位是什么?4、极限摩尔电导率∞Λm 的物理意义和用途分别是什么?5、对于强、弱电解质,获得其∞Λm 分别有哪几种方法?6、对于强电解质难溶盐,如何理论计算其m Λ?为什么?7、难溶盐饱和溶液的电导率就是难溶盐的电导率吗?为什么?8、简述难溶盐溶解度和溶度积的区别?9、温度对电解质溶液的电导、电导率和摩尔电导率是否有影响?有何影响?10、科尔劳施公式c A m m -Λ=Λ∞成立的条件是什么?11、电导率的测定为何用交流电而不用直流电?12、简述用DDS-11A 型电导率仪测定溶液电导率的步骤?13、简述用DDS-11A 型电导率仪测定AgCl 溶解度和溶度积的步骤?答案:1、电导G 为电阻R 的倒数,表示导体的导电能力大小。
电导率κ为单位体积导体的电导。
摩尔电导率m Λ为单位浓度电解质溶液的电导率。
三者均反映导体的导电能力,对第二类导体电解质溶液而言,电导对电解质溶液的体积和浓度均没有限制,而电导率和摩尔电导率则分别对电解质溶液有体积限制和浓度限制,分别为单位体积电解质溶液和单位浓度电解质溶液的电导。
2、电导池常数K 为电导池两极之间距离 与极板面积A 之比值,对于指定的电导池,K 为常数。
K 值可通过测定已知电导率κ的电解质溶液的电阻R ,利用公式K= /A=κR 求得。
3、3-⋅m mol 。
4、∞Λm 为无限稀电解质溶液的摩尔电导率,由∞Λm 和m Λ可计算弱电解质稀溶液的电离度=αα,m Λ/∞Λm 。
5、对于强电解质,获得其∞Λm 有实验测定和理论计算两种方法,前者为以m Λ对c 作图,在低浓度下直线在纵轴(即横坐标c =0时)上的截距,后者为∞Λm =∞--∞++Λ+Λm m νν 。




§7.2 电解质溶液的电导率和摩尔电导率1. 电导和电导率通过溶液的电流强度I 与溶液电阻R 和外加电压V 服从欧姆定律R =V/I ;而溶液的电阻率ρ可根据(/)R A l ρ=计算。
通过测量电阻(resistance, R )和电阻率(resistivity, ρ)即可评价电解质溶液的导电能力,不同的是l 为两电极间的距离,而A 则取浸入溶液的电极面积。
习惯上多用电导(conductance ,G )和电导率(conductivity, κ)来表示溶液的导电能力,定义:G =1/R κ=1/ρ电导G 的单位是Ω-1,也记为S(西门子),κ的单位是S·m -1。
电导和电导率间的关系:l G A κ⎛⎫=⎪⎝⎭(7.3)2. 电导的测量通常采用电导率仪(conductometer )来测量电解质溶液的电导,其原理如图7.2。
测量时将电导电极(conductance electrode )插入待测溶液或将待测溶液充入具有两个固定Pt 电极的电导池(conductance cell )M 中,而后将M 连入惠斯登(Wheatstone)电桥的一臂。
测量方法与测定金属的电阻相同但技术上需做一些改进,如测量时不用直流电源而改用1000 Hz 的高频交流电源S ;以耳机或示波器T 来指示桥中零电流;在电桥另一臂的可变电阻R 1上需串联一个可变电容器K 以补偿电导池的电容。
电桥平衡时有314R R RR =3141R G RR R ==(7.4)溶液的电导率可按(7.3)式求算。
式中(l /A)称为电导池常数(conductance cell constant )。
不同的电导池具有不同的电导池常数,即使是同一电导池,其电导池常数也会随时间而改变。
实际测量时多用标准溶液(standard solution )法,即先将一精确已知电导率(κs )的标准溶液充入电导池,在指定温度下测定其电导(G s ),而后再将待测溶液充入该电导池测量其电导(G ),分别带入(7.3)式比较可得:ssG G κκ= (7.5)式中不再出现电导池常数。

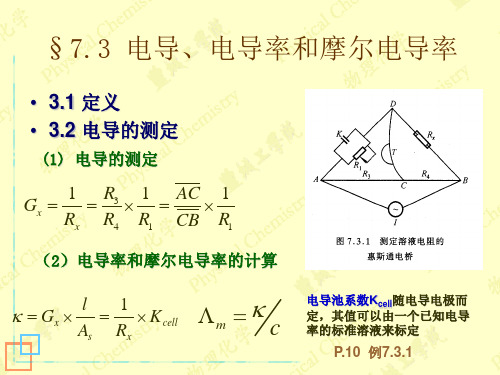
§7.3 电导、电导率和摩尔电导率1、定义(1)电导G :电阻R 的倒数(2)电导率κ:电阻率的倒数(3)摩尔电导率Λm :溶液的电导率与其浓度之比单位:S·m 2·mol -1单位: S (西门子)(Ω-1)Ω★导体的电导率:单位截面积、单位长度时的电导.★电解质溶液的电导率:相距为1m , 面积为1m 2的两个平行板电极之间充满电介质溶液时的电导.1m 21m c κΛ=m s l R ρA =ρκ1=单位: S·m -1∵导体的电阻1G R =1G R ∴=s A l κ=s 1A ρl =×体积为1m 3注意:c 的单位:mol ·m -3(1)电导的测定—惠斯通电桥采用适当频率的交流电源接通电源,移动接触点C ,使CD 间的电流为零。
此时,电桥平衡:431=R R R R x 溶液的电导溶液的电导率电导池系数(2)电导率、摩尔电导率的计算◆测定已知电导率为κ的溶液电阻(电导),求电导池系数K cell 。
◆同法测待测溶液电阻(电导),可计算电导率◆当待测溶液浓度c 已知时,可计算摩尔电导率待测电阻可变电容(抵消电导池电容)交流电源检零器电阻箱电阻R 3、R 4为AC 与CB 的电阻cκΛ=m 2、电导的测定4例:25℃时在一电导池中盛以c 为0.02 mol ⋅dm −3的KCl 溶液,测得其电阻为82.4 Ω。
若在同一电导池中盛以c 为0.025 mol ⋅dm −3的K 2SO 4溶液,测得其电阻为326.0 Ω。
已知25℃时0.02 mol ⋅dm −3的KCl 溶液的电导率为0.2768 S ⋅m -1。
试求:(1)电导池系数K cell ;(2) 0.0025 mol ⋅dm −3K 2SO 4溶液的电导率和摩尔电导率。
解:(1)电导池系数K cell =l /A s =κ(KCl).R (KCl)=(0.2768×82.4)m -1=22.81m -1(2)0.0025 mol/dm 3的K 2SO 4 溶液的电导率κ(K 2SO 4)= K cell /R (K 2SO 4)=(22.81/326.0) S ·m -1=0.06997S ·m -10.0025 mol/dm 3的K 2SO 4的溶液的摩尔电导率Λm (K 2SO 4) = κ(K 2SO 4)/c = (0.06997/2.5) S·m 2 ·mol -1= 0 .02799 S·m 2 ·mol -13.摩尔电导率与浓度的关系#强电解质①溶液浓度↓,摩尔电导率↑②溶液浓度→零,曲线→直线,摩尔电导率趋于极限值,称无限稀释时的摩尔电导率,也称极限摩尔电导率由图可知:无论是强或弱电解质,摩尔电导率均随溶液的稀释而增大。

电导率和摩尔电导率的关系嘿,你问电导率和摩尔电导率的关系呀,那咱就来唠唠。
电导率呢,简单说就是衡量物质导电能力的一个指标。
就好比一条路,电导率高呢,就像这条路很宽很平坦,电流在上面走得就顺畅;电导率低呢,就像这条路又窄又崎岖,电流走起来就费劲。
而摩尔电导率呢,是在电导率的基础上,考虑了物质的量的因素。
它就像是给电导率加上了一个“小秤砣”,用来衡量每摩尔物质的导电能力。
这俩家伙的关系呢,有点像亲兄弟。
电导率是比较直观地反映整体的导电情况,而摩尔电导率呢,更细致地从物质的量的角度去看导电能力。
比如说,同样是一种溶液,浓度不一样的时候,电导率会变化,但是摩尔电导率能更清楚地告诉我们,每摩尔溶质对导电的贡献有多少变化。
一般来说呢,随着溶液浓度的增加,电导率会先上升,因为溶质多了嘛,导电的离子也多了。
但是摩尔电导率呢,可能会先上升后下降。
为啥呢?一开始浓度增加,每摩尔溶质提供的离子多了,所以摩尔电导率上升。
但是浓度太高的时候,离子之间的相互作用就变强了,就像一群人挤在一起走不动路一样,反而会让导电变得困难,所以摩尔电导率就下降了。
我给你举个例子哈。
就像煮一锅汤,一开始加点盐,汤会变得更有味道,导电能力也像汤的味道一样变强了,这就是电导率增加。
但是如果不停地加盐,汤就会变得太咸,反而不好喝了。
同样的,溶液浓度太高的时候,导电也会受到影响。
而摩尔电导率呢,就像是在看每一勺盐对汤味道的贡献。
如果加了很多盐,虽然汤整体更咸了,但是每一勺盐对味道的提升可能没有一开始那么大了。
所以啊,电导率和摩尔电导率既有联系又有区别,它们一起帮我们更好地理解物质的导电性能呢。




一. 实验目的及要求1、理解溶液的电导、电导率和摩尔电导率的概念。
2、掌握由强电解质稀溶液的电导率测定极限摩尔电导率的方法。
3、用电导仪测定KCl溶液的摩尔电导率,并用作图外推求其极限摩尔电导。
二.实验原理1.电导、电导率与摩尔电导率(1)电导:(conductance) 物体导电的能力可用电阻R (resistance,单位为欧姆,用符号Ω表示)或电导G来表示。
G为电阻R的倒数,即G =1/R,单位为西门子(siemens),用S或Ω-1表示。
(2)电导率( conductivity ):电导率κ为电阻率ρ的倒数,即由上式可知,κ的单位是S · m-1。
其物理意义是电极面积各为1m2、两极间相距1m时溶液的电导。
其数值与电解质的种类、溶液浓度及温度等因素有关。
(3)摩尔电导率(molar conductivity) :摩尔电导率是指在相距为1m的两个平行电极之间充入含1mol电解质的溶液时所具有的电导,用公式表示为式中V m为含有1mol电解质的溶液的体积(单位为m · mol ),c为电解质溶液的物质的量浓度(单位为mol · m ),所以的单位为S · m2· mol-1。
注意:在使用摩尔电导率时,要注明所取的基本单元。
如以1mol 元电荷的量为基本单元,则(1/2CuSO4)=7.17×10S · m2· mol-1。
2. 强电解质溶液的摩尔电导率与浓度的关系柯尔劳施(Kohlrausch)根据实验结果得出结论:在很稀的溶液中,强电解质的摩尔电导率与其浓度的平方根成直线关系,即—无限稀释时的摩尔电导率Λ∞mA —常数下图为几种电解质的摩尔电导率对浓度的平方根的图。
由图可见,无论是强电解质,还是弱电解质,其摩尔电导率均随 c→0 而增大。
对于强电解质,c→0 ,离子间引力减小,离子运动速度增加,所以摩尔电导增加。

第二节 电导、电导率与摩尔电导率 电解质溶液和金属导体一样,服从下列关系V R I = l R Aρ= R 、ρ越小,导体的导电能力越好。
但是,对于电解质溶液,其导电能力通常用电导G 和电导率κ来描述。
一、电导及电导率1.电导1 def G R(6-4) G 的单位为1()S -Ω=西门子。
当溶液中有多种电解质时,则溶液的总电导是所有电解质的电导之和,即123G G G G =+++2.电导率(以前也称比电导)11def l G A l R A ρκ== (6-5)式中l 为两电极间的距离,A 为电极面积。
κ的单位为11/m S m --Ω⋅=。
令l A l K A= 称为电导池常数,与电导池几何特征有关。
⑴物理意义由上式可知,当A =1m 2,l =1m 时,G =κ。
因此,κ就是长1m 、截面积为1m 2的导体所具有的电导。
对电解质溶液来说,其κ就是相距1m ,电极面积为1m 2的两个平行板电极间放置1m 3电解质溶液时的电导。
⑵与浓度的关系由图可以看出以下两点:Ⅰ. 当浓度相同时,强酸的电导率最大,强碱次之,盐类较低,弱电解质最低。
这是由于H +和OH -的电迁移率远远大于其它离子,至于弱电解质,则是由于单位体积内参加导电的离子很少。
Ⅱ. κ-c 曲线上存在极大点。
但弱电解质的变化不明显。
实际上,除了那些溶解度较低的盐类,它们在没有到达极大点时就已经饱和了,其它的电解质都有类似的情况。
在较稀的浓度范围内,随浓度增加单位体积溶液中的离子数目增加,κ逐渐增大。
当浓度足够大以后,离子间的静电作用将使离子的迁移速度大大减小,另外正、负离子还可能缔合成荷电量较少的或中性的离子对,因而会出现随浓度增大κ值减少的情况。
至于弱电解质溶液,单位体。
