摩尔电导率
- 格式:ppt
- 大小:493.50 KB
- 文档页数:34

无限稀释摩尔电导率和电导率的关系下载提示:该文档是本店铺精心编制而成的,希望大家下载后,能够帮助大家解决实际问题。
文档下载后可定制修改,请根据实际需要进行调整和使用,谢谢!本店铺为大家提供各种类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by this editor. I hope that after you download it, it can help you solve practical problems. The document can be customized and modified after downloading, please adjust and use it according to actual needs, thank you! In addition, this shop provides you with various types of practical materials, such as educational essays, diary appreciation, sentence excerpts, ancient poems, classic articles, topic composition, work summary, word parsing, copy excerpts, other materials and so on, want to know different data formats and writing methods, please pay attention!关于无限稀释摩尔电导率和电导率的关系,可以从以下几个方面进行阐述:1. 无限稀释摩尔电导率的定义。
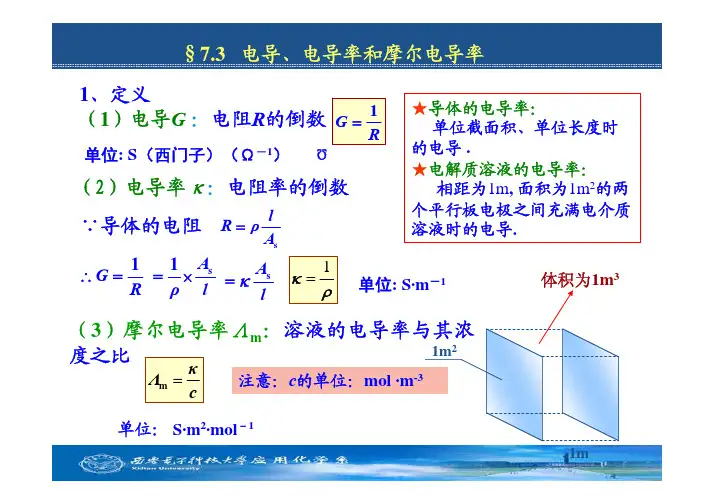
§7.3 电导、电导率和摩尔电导率1、定义(1)电导G :电阻R 的倒数(2)电导率κ:电阻率的倒数(3)摩尔电导率Λm :溶液的电导率与其浓度之比单位:S·m 2·mol -1单位: S (西门子)(Ω-1)Ω★导体的电导率:单位截面积、单位长度时的电导.★电解质溶液的电导率:相距为1m , 面积为1m 2的两个平行板电极之间充满电介质溶液时的电导.1m 21m c κΛ=m s l R ρA =ρκ1=单位: S·m -1∵导体的电阻1G R =1G R ∴=s A l κ=s 1A ρl =×体积为1m 3注意:c 的单位:mol ·m -3(1)电导的测定—惠斯通电桥采用适当频率的交流电源接通电源,移动接触点C ,使CD 间的电流为零。
此时,电桥平衡:431=R R R R x 溶液的电导溶液的电导率电导池系数(2)电导率、摩尔电导率的计算◆测定已知电导率为κ的溶液电阻(电导),求电导池系数K cell 。
◆同法测待测溶液电阻(电导),可计算电导率◆当待测溶液浓度c 已知时,可计算摩尔电导率待测电阻可变电容(抵消电导池电容)交流电源检零器电阻箱电阻R 3、R 4为AC 与CB 的电阻cκΛ=m 2、电导的测定4例:25℃时在一电导池中盛以c 为0.02 mol ⋅dm −3的KCl 溶液,测得其电阻为82.4 Ω。
若在同一电导池中盛以c 为0.025 mol ⋅dm −3的K 2SO 4溶液,测得其电阻为326.0 Ω。
已知25℃时0.02 mol ⋅dm −3的KCl 溶液的电导率为0.2768 S ⋅m -1。
试求:(1)电导池系数K cell ;(2) 0.0025 mol ⋅dm −3K 2SO 4溶液的电导率和摩尔电导率。
解:(1)电导池系数K cell =l /A s =κ(KCl).R (KCl)=(0.2768×82.4)m -1=22.81m -1(2)0.0025 mol/dm 3的K 2SO 4 溶液的电导率κ(K 2SO 4)= K cell /R (K 2SO 4)=(22.81/326.0) S ·m -1=0.06997S ·m -10.0025 mol/dm 3的K 2SO 4的溶液的摩尔电导率Λm (K 2SO 4) = κ(K 2SO 4)/c = (0.06997/2.5) S·m 2 ·mol -1= 0 .02799 S·m 2 ·mol -13.摩尔电导率与浓度的关系#强电解质①溶液浓度↓,摩尔电导率↑②溶液浓度→零,曲线→直线,摩尔电导率趋于极限值,称无限稀释时的摩尔电导率,也称极限摩尔电导率由图可知:无论是强或弱电解质,摩尔电导率均随溶液的稀释而增大。

电导率和摩尔电导率的关系嘿,你问电导率和摩尔电导率的关系呀,那咱就来唠唠。
电导率呢,简单说就是衡量物质导电能力的一个指标。
就好比一条路,电导率高呢,就像这条路很宽很平坦,电流在上面走得就顺畅;电导率低呢,就像这条路又窄又崎岖,电流走起来就费劲。
而摩尔电导率呢,是在电导率的基础上,考虑了物质的量的因素。
它就像是给电导率加上了一个“小秤砣”,用来衡量每摩尔物质的导电能力。
这俩家伙的关系呢,有点像亲兄弟。
电导率是比较直观地反映整体的导电情况,而摩尔电导率呢,更细致地从物质的量的角度去看导电能力。
比如说,同样是一种溶液,浓度不一样的时候,电导率会变化,但是摩尔电导率能更清楚地告诉我们,每摩尔溶质对导电的贡献有多少变化。
一般来说呢,随着溶液浓度的增加,电导率会先上升,因为溶质多了嘛,导电的离子也多了。
但是摩尔电导率呢,可能会先上升后下降。
为啥呢?一开始浓度增加,每摩尔溶质提供的离子多了,所以摩尔电导率上升。
但是浓度太高的时候,离子之间的相互作用就变强了,就像一群人挤在一起走不动路一样,反而会让导电变得困难,所以摩尔电导率就下降了。
我给你举个例子哈。
就像煮一锅汤,一开始加点盐,汤会变得更有味道,导电能力也像汤的味道一样变强了,这就是电导率增加。
但是如果不停地加盐,汤就会变得太咸,反而不好喝了。
同样的,溶液浓度太高的时候,导电也会受到影响。
而摩尔电导率呢,就像是在看每一勺盐对汤味道的贡献。
如果加了很多盐,虽然汤整体更咸了,但是每一勺盐对味道的提升可能没有一开始那么大了。
所以啊,电导率和摩尔电导率既有联系又有区别,它们一起帮我们更好地理解物质的导电性能呢。

35℃时醋酸的极限摩尔电导率
我们要找出35℃时醋酸的极限摩尔电导率。
首先,我们需要了解什么是极限摩尔电导率。
极限摩尔电导率(Λ∞)是指在无限稀释的溶液中,每摩尔离子所具有的电导率。
它与溶液的离子浓度和离子迁移率有关。
对于一个特定的电解质,极限摩尔电导率是一个常数,它不依赖于溶液的浓度。
数学公式表示为:
Λ∞= k ×(1 + 0.5×z^2/RT)
其中,k是离子迁移率,z是离子的化合价,R是气体常数,T 是绝对温度。
对于醋酸(HAc),它是一个弱电解质,在35℃时的离子化合价z=1,k值约为0.02S·m^2/mol。
我们可以使用上述公式来计算极限摩尔电导率。
计算结果为:35℃时醋酸的极限摩尔电导率为0.020004 S·m^2/mol。


§7.2 电解质溶液的电导率和摩尔电导率1. 电导和电导率通过溶液的电流强度I 与溶液电阻R 和外加电压V 服从欧姆定律R =V/I ;而溶液的电阻率ρ可根据(/)R A l ρ=计算。
通过测量电阻(resistance, R )和电阻率(resistivity, ρ)即可评价电解质溶液的导电能力,不同的是l 为两电极间的距离,而A 则取浸入溶液的电极面积。
习惯上多用电导(conductance ,G )和电导率(conductivity, κ)来表示溶液的导电能力,定义:G =1/R κ=1/ρ电导G 的单位是Ω-1,也记为S(西门子),κ的单位是S·m -1。
电导和电导率间的关系:l G A κ⎛⎫=⎪⎝⎭(7.3)2. 电导的测量通常采用电导率仪(conductometer )来测量电解质溶液的电导,其原理如图7.2。
测量时将电导电极(conductance electrode )插入待测溶液或将待测溶液充入具有两个固定Pt 电极的电导池(conductance cell )M 中,而后将M 连入惠斯登(Wheatstone)电桥的一臂。
测量方法与测定金属的电阻相同但技术上需做一些改进,如测量时不用直流电源而改用1000 Hz 的高频交流电源S ;以耳机或示波器T 来指示桥中零电流;在电桥另一臂的可变电阻R 1上需串联一个可变电容器K 以补偿电导池的电容。
电桥平衡时有314R R R R = 3141R G R R R ==(7.4) 溶液的电导率可按(7.3)式求算。
式中(l /A)称为电导池常数(conductance cell constant )。
不同的电导池具有不同的电导池常数,即使是同一电导池,其电导池常数也会随时间而改变。
实际测量时多用标准溶液(standard solution )法,即先将一精确已知电导率(κs )的标准溶液充入电导池,在指定温度下测定其电导(G s ),而后再将待测溶液充入该电导池测量其电导(G ),分别带入(7.3)式比较可得:ssGG κκ= (7.5) 式中不再出现电导池常数。

无限稀溶液的摩尔电导
无限稀溶液是指溶液中溶质的浓度非常低,可以近似看作是无限小的溶液。
在这种情况下,溶液的电导率与溶质的浓度成正比,即溶质浓度越低,电导率越小。
而摩尔电导是指单位浓度的溶液的电导率,因此在无限稀溶液中,摩尔电导可以用来描述溶液的电导性质。
一、摩尔电导的定义
摩尔电导是指单位浓度的溶液的电导率,通常用符号Λ表示。
在国际单位制中,摩尔电导的单位是西门子·米/摩尔(S·m²/mol),其中西门子是电导率的单位,米是长度的单位,摩尔是物质的量的单位。
摩尔电导的计算公式为Λ = κ/c,其中κ是电导率,c是溶液的浓度。
二、在无限稀溶液中,溶质的浓度非常低,可以近似看作是无限小的溶液。
在这种情况下,溶液的电导率与溶质的浓度成正比,即溶质浓度越低,电导率越小。
因此,在无限稀溶液中,摩尔电导可以用来描述溶液的电导性质。
三、摩尔电导的应用
摩尔电导是描述溶液电导性质的重要参数,广泛应用于化学、生物、医学等领域。
在化学中,摩尔电导可以用来确定电解质的浓度和电离度,从而推断化学反应的平衡常数和反应机理。
在生物和医学中,摩尔电导可以用来测定生物体内的电解质浓度和离子交换,从而研究生
物体内的代谢和生理功能。
四、结论
无限稀溶液的摩尔电导是描述溶液电导性质的重要参数,可以用来推
断化学反应的平衡常数和反应机理,以及研究生物体内的代谢和生理
功能。
在实际应用中,需要注意溶液的浓度和温度对摩尔电导的影响,以保证测量结果的准确性。

强弱电解质溶液的摩尔电导率与浓度的关系引言电解质溶液是由带电的离子和非离子溶质构成的溶液。
根据电离的能力,电解质可以分为强电解质和弱电解质。
强电解质在溶液中能够完全电离,产生大量的离子,而弱电解质只能部分电离,在溶液中离子的浓度较低。
电解质溶液的电导率是衡量其导电性能的重要指标,而摩尔电导率则与溶液中溶质的浓度有关。
本文将探讨强弱电解质溶液的摩尔电导率与浓度之间的关系。
电导率与浓度的基本概念电导率电导率是描述电解质溶液导电性的物理量。
它用符号Λ表示,单位是S⋅m2⋅mol−1。
电解质溶液导电的原理是离子在溶液中的运动,因此离子的浓度和迁移率是导电性的两个重要因素。
电导率可以用下列公式表示:Λ=κc其中,κ代表电解质溶液的电导度,单位是S⋅m−1;c是电解质的浓度,单位是mol⋅m−3。
电导率随着浓度的变化而变化。
摩尔电导率摩尔电导率是描述电解质单个离子的运动能力的物理量。
它用符号Λm表示,单位是S⋅m2⋅mol−1。
摩尔电导率与电解质的浓度有关。
当电解质溶液中只有一种离子时,摩尔电导率可以由电导率和浓度计算得到:Λm=Λc当电解质有多个离子时,可以通过实验测得各个离子的摩尔电导率来计算总的摩尔电导率。
强电解质溶液的摩尔电导率与浓度关系强电解质溶液能够完全电离为离子,因此其溶液中离子浓度较高。
强电解质溶液的摩尔电导率与浓度之间有一定的关系。
根据强电解质的电离程度,可以将其摩尔电导率与浓度的关系分为以下几种情况。
1. 随浓度增加而线性增加对于一些强电解质溶液,摩尔电导率与浓度之间呈现线性关系。
随着浓度的增加,溶液中离子的数量增多,导致摩尔电导率的增加。
例如,KCl溶液在较低浓度范围内,其摩尔电导率与浓度呈线性关系。
浓度 (mol/L) 摩尔电导率 (S⋅m2⋅mol−1)0.1 69.90.2 138.80.3 207.70.4 277.60.5 346.52. 随浓度增加而趋于稳定对于某些溶解度较低的电解质溶液,其摩尔电导率会随着浓度的增加而趋于稳定。


氢离子极限摩尔电导率一、引言在电化学领域中,离子电导率是一个重要的参数,它反映了物质传输电荷的能力。
氢离子极限摩尔电导率是其中一种特殊的电导率,主要涉及到氢离子的传输行为。
本文将重点探讨氢离子极限摩尔电导率的定义、计算方法、影响因素、应用与展望以及结论。
二、氢离子极限摩尔电导率的定义与计算氢离子极限摩尔电导率是指在一定的温度和压力下,单位时间内通过单位面积的氢离子数与相应的电压梯度之比。
其数学表达式为:Λₐ=σₐ/(εrV),其中,σₐ为氢离子极限摩尔电导率,εr为相对介电常数,V为摩尔体积。
该参数的测量需要利用相应的电解池,并通过电流-电压曲线法或者电化学阻抗谱等方法进行测量。
三、影响因素氢离子极限摩尔电导率受到多种因素的影响,主要包括温度、压力、电解质浓度和材料性质等。
1.温度:随着温度的升高,离子的运动速度加快,因此氢离子极限摩尔电导率也会相应增大。
2.压力:压力的变化对氢离子极限摩尔电导率的影响较小,但在高压下,可能会影响电解质的浓度和离子间的相互作用,从而对氢离子极限摩尔电导率产生影响。
3.电解质浓度:电解质浓度对氢离子极限摩尔电导率有明显的影响。
随着电解质浓度的增加,离子的浓度增大,碰撞频率增加,从而使得氢离子极限摩尔电导率增大。
4.材料性质:不同材料的相对介电常数和电子传导性能存在差异,这也会对氢离子极限摩尔电导率产生影响。
此外,材料的孔隙结构和表面性质等因素也可能影响离子的传输行为。
四、应用与展望氢离子极限摩尔电导率在诸多领域中有广泛的应用价值。
例如,在燃料电池和电解槽中,氢离子的传输行为直接影响其效率和性能。
通过对氢离子极限摩尔电导率的研究,可以深入了解相关材料的离子传输性质,从而优化其电化学性能。
此外,该参数的测量对于评估新型电解质材料、催化剂以及相关器件的性能具有重要意义。
未来,随着新能源和环境问题的日益突出,对于高效、低成本和环保的电解技术需求更加迫切。
因此,深入研究氢离子极限摩尔电导率的机理和影响因素,开发新型电解质材料和优化电解工艺具有重要的现实意义和广阔的应用前景。
摩尔电导率表摩尔电导率表名称:摩尔电导率表。
摩尔电导率表是以各元素的电子在物质中所占的相对百分数而得到的比例。
摩尔电导率表可以将两种不同物质的分界线或混合物中各组成成分的相对含量变化状况一目了然地显示出来。
本实验主要用于测定溶液的电导率,制作电导率表等方面的应用。
下面请大家跟随我做这个实验吧!它可以把两种不同物质的分界线或混合物中各组成成分的相对含量变化状况一目了然地显示出来。
通过读取电导率值,就可以计算出被测液体中某种离子的百分含量。
用的工具很简单,那就是一支试剂瓶、一张玻璃板和一些蒸馏水。
首先我们需要准备好所需材料:试剂瓶一个、橡胶管两根、烧杯若干、玻璃板一块、蒸馏水少许。
好,准备好之后我们开始进行实验吧!首先,在一张玻璃板上用铅笔画好直角三角形,以此作为摩尔电导率表的底座,也可以称其为定标点,然后将另一张玻璃板倒扣在底座上,用小刀切掉多余部分。
第二步,用酒精棉球擦拭底座,以使其保持清洁。
接着,我们用清水清洗底座及玻璃板,再用自来水冲洗干净。
第三步,在一个新的烧杯里放入适量的蒸馏水,并注入足够量的蒸馏水,放置在底座的中心位置。
然后,在另一个新的烧杯里装入1/10体积的自来水,并注入适量的蒸馏水。
这样,当然是为了确保每个摩尔电导率表的电导率范围都是一样的。
第四步,在第三个烧杯里放入准备好的待测液,液面与底座上的切点齐平。
注意,因为水会蒸发,所以水位高度应高于底座上的切点0.5厘米。
第五步,拿出带有刻度的量筒,量出体积为100毫升的待测液在这个烧杯中的体积。
(1)极谱图的制作(2)基线图的制作(3)光谱图的制作,我们先观察第一张电导率表的标准曲线。
虽然实验中没有使用玻璃棒,但是由于定标点和量筒的原因,当然也包括在空气中,电导率值是不断减小的。
但是,如果再往量筒里加水,再观察电导率表的曲线就会发现,电导率值是不断增加的。
因为,电解时要有自由移动的电子参加反应,而电子运动会消耗能量,在减小的过程中,电子的能量变得越来越少,因而也就越来越难以到达测量电导率的点,所以曲线的斜率也就越来越大。
醋酸的摩尔电导率醋酸,化学式为CH3COOH,是一种常见的有机酸。
在水溶液中,醋酸完全解离成CH3COO-离子和H+离子。
醋酸的摩尔电导率指的是单位浓度下的电导率,它是衡量溶液中溶质离子导电能力的一个重要指标。
醋酸的摩尔电导率与浓度的关系可以通过科里-亨弗尔得定律来描述。
根据该定律,该物质的摩尔电导率(Λ)等于物质的电导率(κ)除以物质的摩尔浓度(c)的比值,即Λ = κ/c。
摩尔电导率是摩尔浓度为1mol/L时的电导率值。
醋酸在水溶液中的电导率是由溶质离子的数量和移动速度所决定的。
在醋酸溶液中,CH3COO-和H+是主要的离子组分。
这两种离子在水溶液中具有不同的迁移能力和电荷数。
对于醋酸来说,H+离子扮演着更重要的角色,因为它会直接贡献到溶液的电导率中。
醋酸的摩尔电导率一般是通过实验测定获得的。
实验中,需要先将水溶液制备成一系列不同浓度的溶液,然后测定每个溶液的电导率。
最后,可以通过将测得的电导率值除以相应的浓度值来得到醋酸的摩尔电导率。
醋酸在水中的摩尔电导率随着浓度的增加而减小,这是因为在高浓度下,溶液中溶质之间会发生交互作用,导致离子迁移能力降低。
此外,在醋酸浓度较高的溶液中,溶剂分子(水)与溶质分子(醋酸)之间会形成氢键,使溶液的电导率降低。
另外,温度对醋酸的摩尔电导率也有影响。
一般来说,随着温度的升高,溶液中离子的迁移速率加快,从而导致电导率的增加。
这是由于高温会导致溶液中分子的运动加剧,从而使溶质离子更容易迁移。
总结起来,醋酸的摩尔电导率是表示醋酸溶液中电解质离子迁移能力的一个指标。
其值可以通过实验测定得到,并且会受到溶液浓度和温度的影响。
醋酸的摩尔电导率随着浓度的增加而降低,在高浓度下溶液中的电导率较低。
而随着温度的升高,醋酸溶液的电导率会增加。
这些特性在实际应用中对了解醋酸的电导性质和溶液行为具有重要意义。
弱电解质的解离度(ionization degree)与其摩尔电导率(molar conductivity)之间存在一定的关系。
解离度是指溶液中电解质分子解离生成离子的程度,通常用α表示。
解离度越高,说明电解质在溶液中的离子化程度越高。
摩尔电导率是衡量电解质在单位浓度下导电能力的物理量。
它是电导率除以电解质的摩尔浓度,并以西门子·米/摩尔(S·m²/mol)为单位表示。
对于弱电解质,可以使用独立粒子假设(independent particle approximation)来估计解离度与摩尔电导率之间的关系。
这个假设认为,在稀溶液中,弱电解质分子的解离是相互独立发生的。
根据独立粒子假设,弱电解质的摩尔电导率可以表示为:
Λ= Λ₀+ α^2 ×ΔΛ
其中,Λ₀是纯溶剂的摩尔电导率,ΔΛ是由于解离产生的额外摩尔电导率,α是解离度。
这个公式表明,弱电解质的摩尔电导率随着解离度的增加而增加。
当解离度接近于1时,摩尔电导率达到最大值。
因此,可以通过测量溶液中弱电解质的摩尔电导率并结合解离度的计算来确定其解离程度。
外推法求极限摩尔电导率摩尔电导率是描述溶液中电导性的物理量,表示单位体积的溶液中的电导率。
摩尔电导率可以通过外推法来求解,外推法是一种数值计算方法,通过利用已知浓度范围内的电导率数据,预测未知浓度下的电导率。
在使用外推法求解摩尔电导率时,首先需要收集已知浓度范围内的电导率数据。
这些数据可以通过实验测量获得,或者是从文献中查找得到。
收集到的数据应该包括不同浓度下的电导率值,可以根据需要选择合适的浓度范围。
接下来,需要对收集到的电导率数据进行处理。
一种常用的处理方法是将浓度和对数电导率之间的关系进行线性化处理。
可以采用如下公式进行线性化处理:lg(κ) = a + b·lg(c)其中,κ表示电导率,c表示浓度,a和b为待求参数。
在数学上,可以使用最小二乘法来拟合出a和b的值,从而得到线性化的关系。
在得到线性化的关系后,就可以利用外推法进行计算了。
外推法是一种利用已知数据点外的数据点进行预测的方法。
在求解摩尔电导率时,我们可以利用线性化后的关系,通过已知的浓度范围外的浓度值,来预测对应的电导率值。
具体来说,我们可以选择一个较小的浓度值,通过线性化的关系计算出对应的对数电导率值。
然后,再通过反向计算,得到对应浓度下的摩尔电导率值。
需要注意的是,外推法的准确性和可靠性取决于所采用的线性化关系的合理性。
因此,在选择浓度范围和拟合参数时,需要进行合理的判断和选择,以保证外推结果的准确性。
总结起来,外推法是一种用于求解摩尔电导率的数值计算方法。
通过收集已知浓度范围内的电导率数据,进行线性化处理,并利用外推法进行预测,可以得到未知浓度下的摩尔电导率值。
在实际应用中,外推法可以用于溶液浓度的测定和溶解度的计算等领域。