λ噬菌体载体
- 格式:doc
- 大小:503.00 KB
- 文档页数:8

λ噬菌体载体是一种广泛应用于分子生物学和基因工程领域的载体,用于将外源DNA序列引入细菌细胞中。
噬菌体是一种寄生性病毒,可以感染细菌并在其内部复制。
而λ噬菌体是其中最为常见和常用的一种。
λ噬菌体载体通常由数万个碱基对的环状DNA组成,其中包含了多个重要的功能区域。
其中,最重要的功能区域是Origins of Replication(ORI),即复制起始点,负责引导DNA的复制。
此外,载体还包含了选择性标记基因,如抗生素抗性基因,以便在细菌培养基中筛选带有该载体的细菌。
λ噬菌体载体还含有多个限制内切酶切位点,这些切位点可以用于将外源DNA序列插入到载体的特定位置上。
通过将外源DNA与载体进行限制性内切酶切割,然后使用DNA连接酶进行连接,可以将外源DNA序列插入到载体的DNA链上。
这一过程称为重组。
一旦重组完成,λ噬菌体载体可以通过转化的方式引入到宿主细菌中。
转化是指将外源DNA 导入到细菌细胞中的过程。
一旦载体进入到细菌细胞中,它会在细菌细胞内部复制,并产生大量的噬菌体颗粒。
这些噬菌体颗粒可以感染其他细菌细胞,并将携带的外源DNA序列传递给它们。
λ噬菌体载体在分子生物学和基因工程研究中具有广泛的应用。
它可以用于构建基因文库,即将外源DNA序列插入到载体上,并通过转化的方式导入到细菌细胞中。
这样,研究人员就可以通过筛选和分析细菌细胞中的载体来获得感兴趣的外源DNA序列。
此外,λ噬菌体载体还可以用于基因表达,即将外源DNA序列插入到载体的表达位点上,以便在细菌细胞中大量产生特定的蛋白质。
总之,λ噬菌体载体是一种在分子生物学和基因工程领域中被广泛使用的载体。
它具有多个重要的功能区域,可以用于将外源DNA序列引入到细菌细胞中,并在其中进行复制和表达。
通过利用λ噬菌体载体,研究人员可以进行基因库构建、基因表达和其他相关研究,为生物技术的发展提供了重要的工具和平台。


3、λ噬菌体载体的优缺点:•优点:包装的λ噬菌体感染大肠杆菌要比质粒转化细菌的效率高。
•缺点:λ噬菌体载体的克隆操作要比质粒载体复杂。
•用途:λ噬菌体载体比质粒载体能插入的DNA长得多,常用于构建cDNA文库或基因组文库。
第一章分子克隆的工具酶和载体•第八节噬菌体载体•一、λ噬菌体•(一)λ噬菌体•(二)λ噬菌体载体的改造•(三)λ噬菌体载体举例(三)λ噬菌体载体举例•Lambda gt10•Lambda gt11•EMBL3和EMBL4Lambda gt10概述:•Lambda gt10是一种插入载体。
•在噬菌体阻遏基因cI内有单一的EcoRⅠ克隆位点。
用于插入小的cDNA片段(约6kb),构建cDNA文库或基因文库。
•该载体克隆效率很高。
•在构建cDNA文库时,利用Oligo(dT)或随机引物合成的cDNA经过EcoRⅠadaptors或Linkers修饰后,就可以和λgt10连接起来。
•克隆到λgt10的噬菌体,可用核酸探针进行筛选。
Lambda gt10map宿主:•建议用C600 and C600hf1作受体菌。
筛选:•如果有外源DNA插入,cI基因失活,该噬菌体进入裂解生长途径,在培养皿形成噬菌斑。
反之,若无插入,cI基因表达,噬菌体进入溶原生长途径,不形成噬菌斑。
•核酸探针杂交。
Insertional cloning•Insertional cloning into the cI gene of thelambda -gt10 cDNA cloning vector (DNA inserts of ~1-5 kb) can be selected in hfl (highfrequency of lysogeny ) mutant strains of E. coli. In hflA strains of E. coli, expression of the lambda cII gene is elevated, resulting in transcriptional induction of the lambda cI repressor gene which promotes lysogeny . Disruption of the lambda cI codingsequence by DNA insertion into the unique EcoRI site of the lambda gt10 cDNA cloningvector, blocks the lysogenic pathway leading to cell lysis and plaque formation.Lambda gt11•λgt 载体系列:是插入型载体。

λde3 核苷酸序列
λde3(或λDE3)是一个常用于分子生物学和基因工程研究的噬菌体载体。
它是基于λ噬菌体的衍生体,经过改造以容纳外源DNA片段并允许在大肠杆菌中进行高效复制和表达。
λde3噬菌体载体特别之处在于它包含了一个由T7噬菌体来源的强启动子驱动的克隆位点,这使得在含有T7 RNA聚合酶的大肠杆菌宿主细胞中,插入的外源基因可以被高效转录和翻译。
λde3噬菌体载体的核苷酸序列通常包括以下几个部分:
λ噬菌体复制原点:这是保证噬菌体DNA在大肠杆菌中复制所必需的序列。
T7启动子:这是一个强大的启动子,位于克隆位点上游,用于启动外源基因的高效转录。
克隆位点:这是用于插入外源DNA片段的区域,通常包含多个限制酶切位点,便于外源DNA的插入和克隆。
选择性标记基因:如氨苄青霉素抗性基因(Amp^R)或卡那霉素抗性基因(Kan^R),用于在含有相应抗生素的培养基中选择含有λde3噬菌体载体的宿主细胞。
λ噬菌体包装信号:这是指导噬菌体DNA包装的序列,确保外源DNA被正确地包装进噬菌体颗粒中。
λde3噬菌体载体的核苷酸序列长度通常超过5000个核苷酸,包括上述所有组件。
由于具体的序列会根据不同的构建和实验室的要求而有所不同,因此这里无法提供一个确切的、通用的λde3噬菌体载体核苷酸序列。
如果你需要一个具体的λde3噬菌体载体核苷酸序列,你可以参考商业供应商(如New England Biolabs, Thermo Fisher Scientific等)提供的产品信息,或者查询相关的学术文献和数据库(如NCBI的GenBank数据库),那里通常会有详细的序列信息。



基因工程的载体载体的特征:在寄主细胞中能够自主复制;有一种或多种限制酶的单一切割位点,并在此位点插入外源基因片段;在基因组中有遗传标记,为寄主细胞提供易于检测的表型特征;载体分子较小,以便体外基因操作;对于表达型载体还应具有与宿主细胞相适应的启动子、增强子、加尾信号等基因表达元件;载体的类型⏹质粒⏹噬菌体⏹其他载体(如:酵母人工染色体、细菌人工染色体、植物Ti质粒、动物病毒)质粒(plasmid): 多数情况下,质粒是存在于细菌染色体外的小的双链闭合环状DNA分子,能自主复制,并在细胞分裂时遗传给子代细胞⏹并不是所有的质粒都是环状分子, 在多种细菌中都发现有线性质粒⏹质粒广泛存在于原核生物中, 其大小从相对分子量小于1X106 到大于200X106质粒的形态1) cccDNA—双链闭合环状DNA2) ocDNA—开环DNA3) cDNA—线形DNA(L型)在DNA促旋酶(gyrase)作用下成负超螺旋构型, 在拓扑异构酶I的作用下解旋。
溴化乙锭(ethidium bromide,EtBr)也有解旋作用溴化乙锭插入DNA超螺旋的作用随着插入的溴化乙锭数目增加,双螺旋解旋,导致超螺旋减少直至产生环状分子的开放形式. 进一步的插入在双螺旋中引入了过多的螺旋,导致反义的超螺旋(注意B和D处的螺旋方向). 为了清楚起见,只表示了双螺旋的一条单链质粒DNA的复制类型⏹严紧型质粒这些质粒的复制是在寄主细胞严格控制之下的,与寄主细胞的复制偶联同步。
所以,往往在一个细胞中只有一份或几份拷贝⏹松弛型质粒这些质粒的复制是在寄主细胞的松弛控制之下的,每个细胞中含有10-200份拷贝,如果用一定的药物处理抑制寄主蛋白质的合成才会使质粒拷贝数增至几千份。
如较早的质粒pBR322即属于严紧型质粒,要经过氯霉素处理才能达到更高拷贝数穿梭载体(shuttle vector) 可以在两种生物体内复制的载体分子质粒的命名规则⏹小写字母p表示质粒(plasmid)⏹p后面的两个大写字母表示发现或者构建该质粒的作者或者实验室名称⏹数字表示编号⏹例:pBR322、pET21、pGEM-T质粒的宿主范围⏹质粒只编码少数几个其自身复制所需要的蛋白质,甚至在许多情况下只编码其中一个蛋白质⏹所有其他复制所需的蛋白,包括DNA聚合酶、DNA连接酶、解旋酶等都是由宿主细胞提供的⏹质粒所编码的复制蛋白质定位在ori 附近,因此只有ori 周围的一小部分区域是复制所必需的⏹因此,把质粒的其他部分删除掉,把外源序列加到质粒上,复制仍然可以继续进行⏹质粒的宿主范围是由它的ori 决定的质粒的不相容性⏹在没有选择压力的情况下,两种质粒不能共存于同一个宿主细胞内⏹如果质粒拥有相同的复制调控机制,它们就不相容显性质粒和隐蔽质粒⏹显性质粒(表达型质粒)----除了携带与本身复制和转移有关的基因外, 还携带一些其他的基因, 宿主细胞由于含有这样的质粒而呈现出新的性状, 这样的质粒称为显性质粒⏹隐蔽质粒----无异常性状表现出来克隆载体例:pBR322、pUC18、pUC19、pGEM-T表达载体例:pET-21、pGEX⏹质粒DNA的制备碱裂解法、煮沸法、层析柱过滤法碱裂解法原理:在高pH的碱性条件下,染色体DNA和蛋白质变性,质粒DNA由于其超螺旋共价闭合环状结构,尽管其DNA的大部分氢键也断裂,但是双链DNA仍然不会分离,当恢复到中性时,染色体DNA复性,并聚集形成不可溶的网架。

λDNAλDNA,就是λ噬菌体中的DNA,但是λDNA也分很多种情况的,有正常的,有突变的,还有整合了宿主染色体的。
λDNA是一种溶原性的染色体序列,可以整合到宿主的染色体组上,也可以脱离下来,他的整合和脱离所产生的失误可产生宿主的基因重组现象,所以可以用于局限转导,是一种基因转化的载体。
柯斯质粒载体目录一.柯斯质粒载体的来源二.柯斯质粒载体的特点三.柯斯克隆四.柯斯克隆的优点一.柯斯质粒载体的来源1978年由collins和hohn改建的一种新型大肠杆菌克隆载体,用正常的质粒与噬菌体λ的cos位点构成。
“cosmld”一词是由英文“cos site-carrying plasmid”缩写而成的,其原意是指带有粘性末端位点(cos)的质粒。
所谓柯斯质粒,乃是一类由人工构建的含有λ DNA的cos序列和质粒复制子的特殊类型的质粒载体。
诸如右图所示的柯斯质粒载体pHC79,就是由λ DNΑ片段和pBR322质粒DNA联合组成的。
一般长度4~6kb。
含有Amp和Tet选择标记基因。
其上的cos位点可识别噬菌体外壳蛋白。
凡具有cos位点的任何DNA分子只要在长度上相当于噬菌体的基因组,就可以同外壳蛋白结合而被包装成类似噬菌体λ的颗粒。
因此,插入柯斯质粒载体的外源DNA片段的长度可大于40kb,从而大大增加了载体的携带能力。
二.柯斯质粒载体的特点柯斯载体的特点大体上可归纳成如下四个方面:第一,具有λ噬菌体的特性。
柯斯质粒载体在克隆了合适长度的外源DNA,并在体外被包装成噬菌体颗粒之后,可以高效地转导对λ噬菌体敏感的大肠杆菌寄主细胞。
第二,具有质粒载体的持性。
柯斯质粒载体具有质粒复制子,因此在寄主细胞内能够像质粒DNA一样进行复制,并且在氯霉素作用下,同样也会获得进一步的扩增。
此外,柯斯质粒载体通常也都具有抗菌素抗性基因,可供作重组体分子表型选择标记。
第三,具有高容量的克隆能力。
柯斯质粒载体的分子仅具有一个复制起点,一两个选择记号和COS位点等三个组成部分,其分子量较小,一般只有5~7kb左右。

生命科学学院病毒生物学λ噬菌体综述摘要:噬菌体是一类温和噬菌体,它们感染大肠杆菌后能进行溶菌性生长(Lytic growth)和溶源性生长(Lysogenic growth)。
其溶源特性对基因重组与遗传工程研究有很大帮助。
本文就λ噬菌体的基因组结构、溶关键词:λ噬菌体溶原性溶菌性基因克隆引言:大肠杆菌噬菌体λ为长尾噬菌体科,是一类中等大小的大肠杆菌病毒,其基因组为双链线状DNA,由48502对碱基组成,分子量3.2×107 ,约50个基因,特点是相关基因成簇排列,形成若干个操纵子。
基因组两端为粘性末端,中间有相当长的DNA片段是裂解生长非必需的,这就为其作为外源基因的克隆载体提供了方便。
λ噬菌体由头和尾构成,其基因组组装在头部蛋白质外壳内部,其序列已被全部测出。
感染时吸附位点为细胞壁。
属温和性感染;感染的DNA环化并整合于宿主基因组中。
以θ环双向复制,然后通过滚环机制单向复制。
用于感染大肠杆菌的λ噬菌体改造成的载体应用最为广泛。
1、The discovery of bacteriophage lambda1951年J. Lederberg的妻子Esther Lederberg第一个证明了 J. Lederberg和Tatum用来杂交的K-12中有原噬菌体,并命名为λ,经10年的研究搞清了溶原化的实质。
从此之后,λ噬菌体被广泛用于模式物种;1962年Esther Lederberg的同事并且还是她最好的朋友Allan Campbell首次发现了λDNA整合到细菌DN A的机制;之后由λ噬菌体改造后的载体广泛的用于基因工程。
2、The characteristics of bacteriophage lambda2.1、结构特点:λ为大肠杆菌温和性噬菌体,属长尾噬菌体科,头壳为直径约50nm的二十面体,其内包裹一长线状双链DNA分子(46500bp),因分子两端各有一含12个核苷酸的黏性末端,故又可黏合成环状分子。
λ噬菌体(综述)目录1. 简介1.1 发现历史及简介2. 形态结构3. 生活史 3.1 溶源化状态的建立4. 基因组 4.1 环化DNA4.2 特殊基因位点5. 侵染过程 5.1 吸附5.2 侵入5.3 脱壳5.4 大分子合成6. 特殊性质7. 两种类型7.1 插入型载体7.2 替换型载体8. 实际应用9. 相关资料简介1951年J. Lederberg的妻子Esther Lederberg证明了J. Lederberg 和Tatum用来杂交的K12中有原噬菌体,并命名为λ,经10年的研究搞清了溶原化的实质。
λ噬菌体是一种温和噬菌体,即在感染其寄主细胞后,呈现溶源及溶菌两种方式。
λ噬菌体的基因组长达50 kb,共61个基因,其中38个较为重要。
其生活史可分为裂解周期和溶原周期。
在E.coli K12中是有原噬菌体的存在。
Jacob和Wollman(1956年)发现了合子诱导(zygotic induction)现象,并利用合子诱导确定了几个E.coli染色体上原噬菌体的整合位点。
他们发现Hfr(λ)×F-所得到的重组子频率要比Hfr×F-(λ)或Hfr (λ)×F-(λ)要低得多。
这是由于在Hfr(λ)×F-的杂交中,原噬菌体进入无阻遏物的受体细胞质中,进行大量复制使受体细胞裂解,因此不易得到重组子,此现象就称为合子诱导。
现在我们再回过头来查阅一下传递等级作图,中断杂交实验以及重组作图都是采用Hfr×F-(λ)就是不致产生合子诱导的缘故。
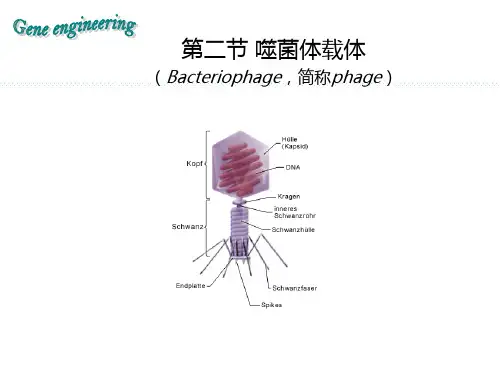
形态结构λ噬菌体由头和尾构成,其基因组组装在头部蛋白质外壳内部,其序列已被全部测出。
用感染大肠杆菌的λ噬菌体改造成的载体应用最为广泛。
λ噬菌体感染时,通过尾管将基因组DNA注入大肠杆菌,而将其蛋白质外壳留在菌外。
图1 有尾噬菌体形态结构模式图图2 λ噬菌体电镜照片λ大肠杆菌的一种温和噬菌体。
蝌蚪状,尾部细管状,不可收缩,头部为二十面体衣壳,其内包裹一长线状双链DNA分子(46500bp),因分子两端各有一含12个核苷酸的黏性末端,故又可黏合成环状分子。
基因⼯程的载体种类基因⼯程的载体对于外源基因的复制、扩增、传代乃⾄表达⾄关重要,其必需具备以下条件:①具有有效运载能⼒,能够进⼊宿主细胞;②对多种限制酶有单⼀或较少的切点,最好是单⼀切点,即本⾝是⼀个复制⼦,携带外源基因前后均能在宿主细胞内⾃主复制,或者能够整合到宿主细胞中;③在宿主中能控制外源基因的表达活动;④要有筛选标记,鉴定⽅便,装卸⼿续简单;⑤容易控制,安全可靠。
在基因⼯程(DNA重组)中,使⽤的载体有:①克隆载体(clone vector),即以繁殖DNA分⼦为⽬的的载体;②穿梭载体(shuttle vecto),⽤于真核⽣物DNA⽚段在原核⽣物中增殖,然后在转⼊真核⽣物细胞宿主表达;③表达载体(express vector),⽤于⽬的基因的表达。
现在对载体提出了更⾼的要求,如:⾼拷贝数、具有强启动⼦和稳定的mRNA、具有⾼的分离稳定性和结构稳定性、转化频率⾼、宿主范围⼴、插⼊外源基因容量⼤且可以重新完整地复制与转录、和宿主细胞匹配等。
此外,载体在宿主不⽣长或低⽣长速率时仍能⾼⽔平地表达⽬的基因。
但达到上述要求的载体很少,尤其是当动物细胞作为宿主细胞时,⽬前能⽤的主要时病毒,进⼊宿主的⽬的基因⼀般只能是⼀个基因,⽽以基因组或多个基因同时进⾏重组还有⼀定困难。
⼀、质粒克隆载体除酵母杀伤质粒(killer plasmid)为RNA外,其他质粒多位环状DNA分⼦,每个质粒都有⼀段DNA复制起始点的序列,帮助实现质粒的复制。
质粒⼀般决定抗⽣素的抗性、产⽣抗⽣素酶系、糖酵解酶系、降解芳⾹族化合物酶系、肠毒素及限制-修饰酶系等。
其中严紧型复制控制质粒的复制与宿主染⾊体同步,并与宿主蛋⽩质合成有关,与DNA聚合酶I活性⽆关,蛋⽩质合成停⽌,质粒与宿主染⾊体复制亦停⽌,故只有1个或少数⼏个拷贝;⽽松弛型复制控制质粒的复制与宿主染⾊体复制不同步,与蛋⽩质合成⽆关,与DNA聚合酶I活性有关,蛋⽩质合成停⽌,质粒仍可复制,故可以在宿主有10—206个拷贝。
第二章 DNA重组克隆的单元操作练习题噬菌体载体(练习题)一、填空题1.噬菌体之所以被选为基因工程载体,主要有两方面的原因:一是;二是。
2.第一个报道的全测序的单链DNA 噬菌体是φX174,DNA 长5386 个碱基对,共个基因,为一环状DNA 分子,基因组的最大特点是。
3.λ噬菌体的基因组DNA 为kb,有多个基因。
在体内,它有两种复制方式,扩增时(早期复制)按复制,成熟包装(晚期复制)则是按复制。
它有一个复制起点,进行向复制。
λ噬菌体的DNA 既可以以线性存在又可以环状形式存在,并且能够自然成环。
其原因主要是在λ噬菌体线性DNA 分子的两端各有一个个碱基组成的天然黏性末端。
这种黏性末端可以自然成环。
成环后的黏性末端部位就叫做位点。
4.根据噬菌体的包装能力,将野生型λ噬菌体的基因组DNA 改造成插入型载体,该载体的最小分子大小约为kb,插入的外源片段最大不超过kb。
5.野生型的M13 不适合用作基因工程载体,主要原因是和。
6.黏粒(cosmid)是质粒—噬菌体杂合载体,它的复制子来自、COS 位点序列来自,最大的克隆片段达到kb。
7.有两类改造型的λ噬菌体载体,即插入型和取代型。
从酶切点看,插入型为个,取代型为个。
8.野生型的丸噬菌体DNA 不宜作为基因工程载体,原因是:(1) (2) (3) 。
9.M13 单链噬菌体的复制分为三个阶段:(1) (2) (3) 。
10.噬菌粒是由质粒和噬菌体DNA 共同构成的,其中来自质粒的主要结构是,而来自噬菌体的主要结构是。
11 .M13 单链噬菌体基因2 和基因4 之间的IG 区有三个最重要的功能,即(1)(2) (3) 。
12.野生型的M13 有10 个基因,分为三个功能集团,其中与复制有关的两个基因是:和。
13.以λ噬菌体载体和黏粒载体构建文库时,起始DNA 的长度是不同的,前者为kb,后者为kb。
14.λ噬菌体载体由于受到包装的限制,插入外源DNA 片段后,总的长度应在噬菌体基因组的的范围内。
λ噬菌体载体
λ噬菌体,一种大肠杆菌双链RNA噬菌体。
是一种中等大小的温和噬菌体。
迄今已经定位的λ噬菌体的基因至少有61个,其中有一半左右参与了噬菌体生命周期的活动,我们称这类基因为λ噬菌体的必要基因;另一部分基因,当它们被外源基因取代之后,并不影响噬菌体的生命功能,我们称这类基因为λ噬菌体的非必要的基因。
一.λ噬菌体的分子生物学概述
(1)λ噬菌体基因组的结构
在λ噬菌体线性双链 DNA分子的两端,各有一条由12个核劳酸组成的彼此完全互补的5′单链突出序列,即通常所说的粘性末端。
注入到感染寄主细胞内的λ噬菌体的线性DNA分子,会迅速地通过粘性末端之间的互补作用,形成环形双链DNA分子。
随后在DNA连接酶的作用下,将相邻的5′-P和3′-OH基团封闭起来,并进一步超盘旋化。
这种由粘性末端结合形成的双链区段称为cos 位点(略语cos,系英语cohesive-end site的缩写,即粘性末端位点之意)(如图)。
在环化的状态下,λ噬菌体DNA分子的长度为48 502碱基对。
(2)λ噬菌体DNA的复制
在λ噬菌体感染的早期,环形的λ DNA分子按θ形式从双向进行复制。
到了感染的晚期,控制滚环复制机理的开关被启动了,合成出了由一系列线性排列的人基因组oxA组成的长多连体分子。
(3)λ噬菌体DNA的整合与删除
λ噬菌体基因组的整合作用,是通过它的附着位点att,同大肠杆菌染色体DNA的局部同源位点之间的重组反应实现的。
整合作用需要int基因的表达,它是一种可逆的过程。
的复制子,这种过程叫做原噬菌体的删除作用。
λ噬菌体的删除,需要噬菌体xis基因和bio基因的协同作用才能实现。
(4)λ噬菌体DNA的转录与转译
在溶菌周期,λ噬菌体DN A的转录是在三个时期,即早期、中期和晚期发生的。
大体的情况是,早期基因转录确立起溶菌周期;中期基因转录的结果导致DNA进行复制和重组;晚期基因的转录最终使DNA被包装为成熟的噬菌体颗粒。
二.λ噬菌体载体的构建及其主要类型
(1)构建λ噬菌体载体的基本原理
构建λ噬菌体载体的基本原理是多余限制位点的删除。
按照这一基本原理构建的λ噬菌体的派生载体,可以归纳成两种不同的类型:
一种是插入型载体(insertion vectors),只具有一个可供外源DNA插入的克隆位点(如图)。
另一种是替换型载体(rePlacement vectors),具有成对的克隆位点,在这两个位点之间的人 DNA区段可以被外源插入的 DNA片段所取代。
在基因克隆中的二者的用途不尽相同。
插入型载体只能承受较小分子量(一般在10kb以内)的外源DNA片段的插入,广泛应用于cDNA及小片段DNA的克隆。
而替换型载体则可承受较大分子量的外源DNA片段的插入,所以适用于克隆高等真核生物的染色体DNA(如图)。
(2)λ噬菌体载体的主要类型
(i)插入型载体
外源的DNA克隆到插入型的λ载体分子上,会使噬菌体的某种生物功能丧失效力,即所谓的插入失活效应。
插入型的λ载体又可以分为免疫功能失活的(inactivatiort of immunityfunction)和大肠杆菌β-半乳糖苷酶失活的(inactlvatlon of E.coli β-galactosidase)两种亚型。
①免疫功能失活的插入型载体:在这类插入型载体的基因组中有一段免疫区,其中带有一两种核酸内切限制酶的单切割位点。
当外源DNA片段插入到这种位点上时,就会使载体所具有的合成活性阻遏物的功能遭受破坏,而不能进入溶源周期。
因此,凡带有外源DNA插入的λ重组体都只能形成清晰的噬菌斑,而没有外源DNA插入的亲本噬菌体就会形成混浊的噬菌斑。
②β-半乳糖苷酶失活的插入型载体:它们的基因组中含有一个大肠杆菌的lac5区段,其中编码着β半乳糖着酶基因lacZ。
由这种载体感染的大肠杆菌lac-指示菌,涂布在补加有IPTG和Xgal的培养基平板上,会形成蓝色的噬菌斑。
如果外源DNA插入到lac5区段上,阻断了β-半乳糖着酶基因lacZ的编码序列,不能合成β-半乳糖昔酶,只能形成无色的噬菌斑。
(ii)替换型载体
替换型载体又叫做取代型载体(substitution vector),是一类在λ噬菌
体基础上改建的、在其中央部分有一个可以被外源插入的DNA分子所取代的DNA 片段的克隆载体。
λNM781便是其中的一个代表。
在这个替换型载体中,可取代的EcoRI片段,编码有一个supE基因(大肠杆菌突变体tRNA基因),由于这种λNM781噬菌体的感染,寄主细胞lacZ基因的琥珀突变更被抑制了,能在乳糖麦康基氏(MacConkey)琼脂培养基上产生出红色的噬菌斑,或是在Xgal琼脂培养基上产生出蓝色的噬菌斑。
如果这个具有supE基因的EcoRI片段被外源DNA取代了,那么所形成的重组体噬菌体,在上述这两种指示培养基上都只能产生出无色的噬菌斑。
用替换型载体克隆外源DNA包括三个步骤:
第一,应用适当的核酸内切限制酶消化λ载体,除去基因组中可取代的DNA 区段。
第二,将上述所得的人 DNA臂同外源DNA片段连接。
第三,对重组体的λDN A分子进行包装和增殖,以得到有感染性的λ重组噬菌体。
三.λ重组体DNA分子的体外包装
(1)λ重组体DNA分子的转染作用
用λ重组体DNA分子直接感染大肠杆菌,使之侵入寄主细胞内。
这种由寄主细胞捕获裸露的噬菌体DNA的过程叫做转染(transfection),它有别于以噬菌体颗粒为媒介的转导(kransduction)。
λDNA的转染作用,是一种低效的过程。
即便是使用未经任何基因操作处理的新鲜制备的λ DNA,其典型的转染效率(即每微克λDNA转染产生的噬菌斑数目),也仅为 105~106之间。
体外连接的结果,转染效率便下降到了104~103左右。
(2)λDNA的体外包装
λDNA的体外包装作用,在离体条件下,将重组体DNA包入噬菌体等病毒颗粒中的过程,以形成有功能的病毒载体。
根据体外互补作用研究发现,λ噬菌体的头部和尾部的装配是分开进行的。
头部基因发生了突变的噬菌体只能形成尾部,而尾部基因发生了突变的噬菌体则只能形成头部。
将这两种不同突变型的噬菌体的提取物混合起来,便能够在体外装配成有生物活性的噬菌体颗粒。
这就是噬菌体体外包装所依据的基本原理。
(图5-8)
(3)λ噬菌体DNA的包装限制问题
λ噬菌体头部外壳蛋白质容纳DNA的能力是有一定限度的。
上限不得超过其正常野生型DNA总量的5%左右,而低限又不得少于正常野生型DNA总量的75%。
按野生型λDNA分子长度为 48kb计算,λ噬菌体的包装上限是 51kb。
编码必要基因的DNA区段占28kb,因此λ载体克隆外源DNA的理论极限值应是23kb。
图:λDNA的体外包装。