工业接触法制硫酸
- 格式:ppt
- 大小:1.26 MB
- 文档页数:30


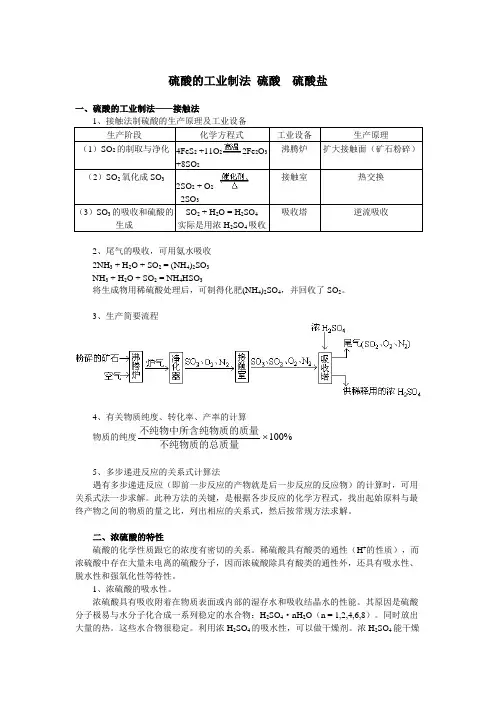
硫酸的工业制法硫酸硫酸盐一、硫酸的工业制法——接触法1、接触法制硫酸的生产原理及工业设备生产阶段化学方程式工业设备生产原理(1)SO2的制取与净化4FeS2+11O22Fe2O3+8SO2沸腾炉扩大接触面(矿石粉碎)(2)SO2氧化成SO32SO2 + O22SO3接触室热交换(3)SO3的吸收和硫酸的生成SO2 + H2O = H2SO4实际是用浓H2SO4吸收吸收塔逆流吸收2、尾气的吸收,可用氨水吸收2NH3 + H2O + SO2 = (NH4)2SO3NH3 + H2O + SO2 = NH4HSO3将生成物用稀硫酸处理后,可制得化肥(NH4)2SO4,并回收了SO2。
3、生产简要流程4、有关物质纯度、转化率、产率的计算物质的纯度不纯物中所含纯物质的质量不纯物质的总质量100%5、多步递进反应的关系式计算法遇有多步递进反应(即前一步反应的产物就是后一步反应的反应物)的计算时,可用关系式法一步求解。
此种方法的关键,是根据各步反应的化学方程式,找出起始原料与最终产物之间的物质的量之比,列出相应的关系式,然后按常规方法求解。
二、浓硫酸的特性硫酸的化学性质跟它的浓度有密切的关系。
稀硫酸具有酸类的通性(H+的性质),而浓硫酸中存在大量未电离的硫酸分子,因而浓硫酸除具有酸类的通性外,还具有吸水性、脱水性和强氧化性等特性。
1、浓硫酸的吸水性。
浓硫酸具有吸收附着在物质表面或内部的湿存水和吸收结晶水的性能。
其原因是硫酸分子极易与水分子化合成一系列稳定的水合物:H2SO4·nH2O(n = 1,2,4,6,8)。
同时放出大量的热。
这些水合物很稳定。
利用浓H2SO4的吸水性,可以做干燥剂。
浓H2SO4能干燥H 2、O 2、CO 等中性气体,也能干燥SO 2、Cl 2、CO 2、HCl 、HF 等酸性气体;但不能干燥NH 3等碱性气体,也不能干燥HBr 、HI 、H 2S 等有强还原性的气体。
2、浓硫酸的脱水性。

第一节接触法制硫酸●教学目标1.了解接触法制硫酸的化学原理、原料、生产流程和典型设备。
2.通过二氧化硫接触氧化条件的讨论,复习巩固关于化学反应速率和化学平衡的知识,训练学生应用理论知识分析和解决问题的能力。
一、反应原理1.S+O2===SO23.SO3+H2O===H2SO4现阶段我国硫酸的生产原料以黄铁矿(主要成分为FeS2)为主,部分工厂用有色金属冶炼厂的烟气、矿产硫黄或从石油、天然气脱硫获得硫黄作原料。
4FeS2+11O2高温=====2Fe2O3+8SO2如以石膏为原料的第一步反应就是:2CaSO4+C∆====2CaO+2SO2↑+CO2二、工业制硫酸的生产流程。
工业上制硫酸主要经过以下几个途径:1、以黄铁矿为原料制取SO2的设备叫沸腾炉。
沸腾炉示意图矿石粉碎成细小的矿粒,是为了增大与空气的接触面积,通入强大的空气流为使矿粒燃烧得更充分,从而提高原料的利用率。
[设问]黄铁矿经过充分燃烧,以燃烧炉里出来的气体叫做“炉气”。
但这种炉气往往不能直接用于制取SO3,这是为什么呢?这是因为炉气中常含有很多杂质,如N2,水蒸气,还有砷、硒的化合物及矿尘等。
这些杂质有些是对生产不利的,如砷硒的化合物、矿尘能够使下一步氧化时的催化剂中毒,水蒸气对设备也有不良影响,因此炉气必须经过净化、干燥处理。
问题:1.N2对硫酸生产没有用处,为什么不除去?2.工业生产上为什么要控制条件使SO2、O2处于上述比例呢?[答案]1.N2对硫酸的生产没有用处,但也没有不利之处,若要除去,势必会增加生产成本,从综合经济效益分析没有除去的必要。
2.这样的比例是增大反应物中廉价的氧气的浓度,而提高另一种反应物二氧化硫的转化率,从而有利于SO2的进一步氧化。
三、生产设备及工艺流程2.接触室根据化学反应原理,二氧化硫的氧化是在催化剂存在条件下进行的,目前工业生产上采用的是钒催化剂。
二氧化硫同氧气在钒催化剂表面上与其接触时发生反应,所以,工业上将这种生产硫酸的方法叫做接触法制硫酸。

工业上接触法制硫酸化学方程式
工业上制备硫酸的方法是接触法,该方法是利用催化剂将二氧化硫和氧气在高温下进行氧化反应。
接触法制备硫酸的化学方程式如下所示:
2SO2 + O2 → 2SO3。
SO3 + H2O → H2SO4。
在第一个方程式中,二氧化硫和氧气在催化剂的作用下发生反应生成二氧化硫。
在第二个方程式中,生成的二氧化硫与水蒸气反应生成硫酸。
这两个反应是工业上制备硫酸的关键步骤。
需要注意的是,工业上的接触法制备硫酸是一个复杂的过程,涉及到催化剂、温度、压力等多个因素的影响。
此外,为了提高反应效率和减少能源消耗,工业生产中还会采用一系列工艺控制和设备来优化这一过程。


硫酸的工业制法———接触法制硫酸
⑴接触法制硫酸的过程和原理(完成化学方程式):
(1)造气:4FeS2+11O2==2Fe2O3+8SO2(在沸腾炉中进行);
(2)接触氧化:2SO2+O2==2SO3(在接触室中进行);
(3)SO3的吸收:SO3+H2O==H2SO4(在吸收塔中进行)。
量空气。
⑶煅烧黄铁矿制得的炉气中含有SO2、O2、N2、水蒸气及砷、硒等化合物和矿尘,
需要除尘、__洗涤____和干燥,避免催化剂中毒。
条件下进行有利?
①使用催化剂:V2O5
②温度的选择:400℃--500℃
③压强的选择:常压
⑸接触氧化过程,应用了热交换器设备,其优点是预热炉气、冷却反应后生成的气体。
⑹工业上用98%浓硫酸吸收SO3,是因为防止形成酸雾,以便使三氧化硫吸收完全,提高三氧化硫的吸收效率。
⑺硫酸工业“三废”的处理和利用:
①尾气中的SO2,用氨水吸收,可得到氮肥。
反应方程式是SO2+2NH3+H2O=(NH4)2SO3
(NH4)2SO3+H2SO4=(NH4)2SO4+SO2↑+H2O。
②污水中含有硫酸,可用石灰乳吸收,反应方程式是Ca(OH)2+H2SO4=CaSO4+2H2O
③废渣的利用。
矿渣一般可用来作为制造水泥的原料或用于制砖
含铁品位高的矿渣,经处理后可以炼铁。
④硫酸生产过程中的三个反应是放热反应。
⑤如果要筹建一间硫酸厂,你认为应该考虑哪些因素?
硫酸厂靠近消费中心比靠近原料产地更为有利
硫酸厂不应建在人口稠密的居民区和环保要求高的地区。
生产过程示意图。


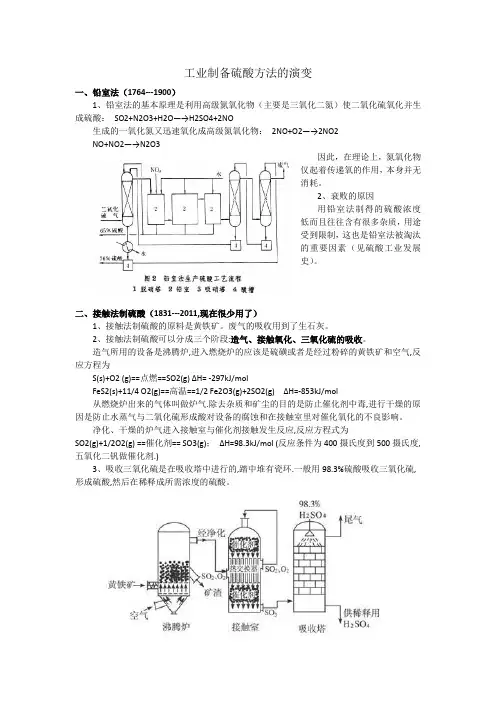
工业制备硫酸方法的演变一、铅室法(1764---1900)1、铅室法的基本原理是利用高级氮氧化物(主要是三氧化二氮)使二氧化硫氧化并生成硫酸:SO2+N2O3+H2O—→H2SO4+2NO生成的一氧化氮又迅速氧化成高级氮氧化物:2NO+O2—→2NO2NO+NO2—→N2O3因此,在理论上,氮氧化物仅起着传递氧的作用,本身并无消耗。
2、衰败的原因用铅室法制得的硫酸浓度低而且往往含有很多杂质,用途受到限制,这也是铅室法被淘汰的重要因素(见硫酸工业发展史)。
二、接触法制硫酸(1831---2011,现在很少用了)1、接触法制硫酸的原料是黄铁矿。
废气的吸收用到了生石灰。
2、接触法制硫酸可以分成三个阶段:造气、接触氧化、三氧化硫的吸收。
造气所用的设备是沸腾炉,进入燃烧炉的应该是硫磺或者是经过粉碎的黄铁矿和空气,反应方程为S(s)+O2 (g)==点燃==SO2(g) ΔH= -297kJ/molFeS2(s)+11/4 O2(g)==高温==1/2 Fe2O3(g)+2SO2(g) ΔH=-853kJ/mol从燃烧炉出来的气体叫做炉气.除去杂质和矿尘的目的是防止催化剂中毒,进行干燥的原因是防止水蒸气与二氧化硫形成酸对设备的腐蚀和在接触室里对催化氧化的不良影响。
净化、干燥的炉气进入接触室与催化剂接触发生反应,反应方程式为SO2(g)+1/2O2(g) ==催化剂== SO3(g);ΔH=98.3kJ/mol (反应条件为400摄氏度到500摄氏度,五氧化二钒做催化剂.)3、吸收三氧化硫是在吸收塔中进行的,踏中堆有瓷环.一般用98.3%硫酸吸收三氧化硫,形成硫酸,然后在稀释成所需浓度的硫酸。

接触法制硫酸如果我问你:“你知道什么是接触法制硫酸吗?”,相信你会一头雾水。
其实很简单,接触法制硫酸就是用含有硫酸根离子或者硫酸氢根离子的物质作原料,经过化学变化制取硫酸的方法。
为了考察反应,我还特意做了实验:先将5克硫酸钠溶解在500毫升的水中,再将6克硫酸亚铁溶解在300毫升的水中,然后加热,得到的溶液便是硫酸亚铁硫酸溶液。
我拿出试剂瓶,将反应产生的气体导入试剂瓶中,把反应液倒入水中,可见固体消失。
这时我按照文献中写的方法加入石灰水,再观察它们反应的现象,只见生成的气体逐渐减少,最终消失。
同时,我还发现,反应完毕后剩余的物质都呈无色状态,而且放置后又重新恢复无色状态。
这些实验是在高温、高压的环境下完成的。
因此,在实验室里通常使用铁制的反应器皿来进行反应。
另外,我也查阅了资料,找到了以下两种制取硫酸的方法:第一种是用黄铁矿粉在氯气流中加热至600 ℃进行分解,再用氨水中和得到硫酸铵;第二种是用锌粉与盐酸反应生成氯化锌和氢气,再加热至400 ℃使氯化锌分解,与氧气共同加热至600 ℃生成硫酸锌和水。
现在,我们再来了解硫酸的用途吧!硫酸的主要用途是作为一种强酸。
化肥,人造纤维,染料,医药,炸药等的主要原料。
而且硫酸的用途非常广泛。
其中,最基本的就是用于工业生产上。
在钢铁厂里,用硫酸来对铁矿石进行酸洗;在建筑行业中,用来对混凝土和沙石等进行酸洗;在纺织业中,用来对棉花进行漂白。
在塑料工业中,用硫酸来对聚丙烯、聚乙烯、聚氯乙烯、 ABS树脂等进行蚀刻。
在电镀行业中,用来对电镀铜、镍、铬等金属时的添加剂进行去除。
在食品工业中,用来处理罐头类产品,防止腐蚀和微生物的繁殖。
在电子工业中,用来清洁集成电路板,并作为蚀刻和去除膜厚的溶液。
在石油化工中,用来对芳烃、苯、醇类、醚类等各种有机溶剂进行稀释或者作为萃取剂。
在橡胶工业中,用来制备合成橡胶,如丁苯橡胶、顺丁橡胶、乙丙橡胶等。
在制药工业中,用来制造青霉素和红霉素等抗生素。
接触法制硫酸最全版课题:第⼀节接触法制硫酸教学⽬的要求:1、使学⽣掌握接触法制硫酸的化学原理、原料、主要反应、主要设备和流程2、通过SO2接触法氧化的适合条件的选择的讨论,复习巩固关于化学反应速率和化学平衡的知识,并能解释硫酸⽣产中的简单问题。
3、培养学⽣处理信息、分析问题的能⼒,提⾼学⽣的语⾔表达能⼒和⽂字表达能⼒。
4、培养学⽣的创新精神、探索精神,能⽤科学的⽅法研究和解决问题,树⽴理论联系实际的辩证唯物主义的思想。
教学重点:接触法制硫酸的化学原理教学难点; SO2的接触法氧化的适宜条件的选择教学⽅法;多谋体动画演⽰和学⽣⾃主讨论课时安排;共2教时第⼀教时教学过程;【设问】硫酸在⼯业和农业⽣产⼯具中的⽤途有哪些?【学⽣看书回答】略【导⼊】硫酸在⼯农业⽣产⼯具中有重要的作⽤,⼤家学习硫酸的⼯业制法.【设问】请同学们根据所学的化学知识写出⽣产硫酸的化学⽅程式.倒推法:H2SO4←SO3←SO2←S(或FeS2)【板书】⼀、原料和原理1、三种原料;(1)硫黄、硫铁矿(FeS2)、⽯膏、有⾊冶⾦烟⽓(SO2)(2)空⽓、(3)⽔。
2、三个主要反应:(我国主要是以硫铁矿为主要原料,硫黄矿的含量少)⑴、4FeS2(s) + 11O2(g)△==2Fe2O3(s) + 8SO2(g)△H== -3412KJ·mol-1或;S(s) + O2(g) SO2(g)(由学⽣学习化学⽅程式的配平,标出电⼦转移的⽅向和数⽬)⑵、2SO2(g) + O2(g)催化剂———→←——— 2SO3(g)△H== -196.6KJ·mol-1⑶、SO3(g)+ H2O(l) === H2SO4(l)△H== -130.3KJ·mol-1⼆、⽣成过程中的三个阶段(⼀)、造⽓1、反应;4FeS2(s) + 11O2(g)△==2Fe2O3(s) + 8SO2(g)△H== -3412KJ·mol-1或;S(s) + O2(g) SO2(g)2、设备;沸腾炉(出⽰沸腾炉模型)3、⼯作原理;将矿⽯粉碎(问为什么?——增加和空⽓的接触⾯积,加快反应速率,使原料充分利⽤)→进⼊沸腾炉→强空⽓流从沸腾炉的底端吹⼊→矿⽯如沸腾的点燃液体→作⽤;矿⽯燃烧得较充分,提⾼反应速率、提⾼原料的利⽤率。
文章标题:深度解析接触法制硫酸的关键反应:SO2的催化氧化催化机理1. 接触法制硫酸的关键反应:SO2的催化氧化催化机理在工业生产中,接触法是一种常用的制备硫酸的方法。
而接触法制硫酸的关键反应之一即是SO2的催化氧化反应。
SO2的催化氧化催化机理是制备硫酸过程中的核心环节,了解其机理对于提高硫酸生产效率、降低能耗、减少环境污染等方面具有重要意义。
2. SO2的催化氧化反应原理SO2的催化氧化反应是一种重要的气相反应,在工业中由催化剂协助下进行。
这一反应可以用如下方程式表示:2SO2 + O2 → 2SO3。
3. 催化剂在SO2的氧化反应中的作用催化剂在SO2的氧化反应中发挥着至关重要的作用。
它能够提高反应速率,降低反应活化能,同时还能够调控反应的选择性,使产物选择性地生成所需的SO3。
催化剂的种类、结构和表面性质对于催化活性、稳定性和选择性起着决定性的影响。
4. 接触法制硫酸SO2的催化氧化催化机理接触法制硫酸中SO2的催化氧化催化机理涉及多种反应步骤和中间产物,其中涉及复杂的物理化学过程和催化作用。
在实际生产中,需要根据催化剂性能、反应条件等因素进行优化,以实现高效、稳定的SO2的氧化反应,进而提高硫酸产率。
5. 个人观点和理解在我看来,对于SO2的催化氧化催化机理的深入探究不仅可以帮助理解接触法制硫酸的工艺原理,更有助于发展更高效的催化剂和改进工艺条件,从而提高硫酸生产的效率和环保性。
总结:在本文中,我深入探讨了接触法制硫酸的关键反应:SO2的催化氧化催化机理。
首先介绍了SO2的催化氧化反应原理,接着分析了催化剂在反应中的重要作用,最后针对接触法制硫酸SO2的催化氧化催化机理进行了详细的解析和讨论。
我也共享了个人观点和理解。
通过本文的阅读,读者能够全面、深刻地了解接触法制硫酸的关键反应,以及SO2的催化氧化催化机理。
:从SO2的催化氧化反应原理到催化剂在反应中的作用,再到接触法制硫酸SO2的催化氧化催化机理的详细解析,我们已经了解了接触法制硫酸的关键反应的重要性以及其复杂的物理化学过程和催化作用。