直接碘量法测定维生素C含量
- 格式:docx
- 大小:38.10 KB
- 文档页数:3

碘量法测定维生素C碘量法测定维生素C原理维生素C又称抗坏血酸Vc,分子式C6H8O6。
Vc具有还原性,可被I2定量氧化,因而可用I2标准溶液直接测定。
其滴定反应式:C6H8O6+I2= C6H6O6+2HI用直接碘量法可测定药片,注射液,饮料,蔬菜,水果等的V含量。
I2微溶于水而易溶于KI溶液,但在稀的KI溶液中溶解得很慢,所以配制I2溶液时不能过早加水稀释,应先将I2和KI混合,用少量水充分研磨,溶解完全后再加水稀释。
I与KI间存在如下平衡:I2+I-=I3-游离I2容易挥发损失,这是影响碘溶液稳定性的原因之一。
因此溶液中应维持适当过量的I-离子,以减少I2的挥发。
空气能氧化I-离子,引起I2浓度增加:4 I-+O2+4H+=2I2+2H2O此氧化作用缓慢,但能为光,热,及酸的作用而加速,因此I2溶液应处于棕色瓶中置冷暗处保存。
I2能缓慢腐蚀橡胶和其他有机物,所以I应避免与这类物质接触。
I2溶液的标定用Na2S2O3标定。
而Na2S2O3一般含有少量杂质,在PH=9-10间稳定,所以在Na2S2O3溶液中加入少量的Na2CO3,Na2S2O3见光易分解可用棕色瓶储于暗处。
碘量法的基本反应式:2S2O32-+I2=S4O62-+2I-由于Vc的还原性很强,较容易被溶液和空气中的氧氧化,在碱性介质中这种氧化作用更强,因此滴定宜在酸性介质中进行,以减少副反应的发生。
考虑到I2在强酸性中也易被氧化,故一般选在PH为3-4的弱酸性溶液中进行滴定。
三、试剂配制I2溶液:6.6g I2和18.5g KI,置于研钵中加少量水,在通风橱中研磨。
待I2全部溶解后,将溶液转入棕色试剂瓶,加水稀释至250ML,摇匀,放置暗处保存。
Na2S2O3溶液(0.1mol·dm-3)的配制:称取26g硫代硫酸钠(Na2S2O3·5H2O)(或无水硫代硫酸钠16g),加入1000ml新煮沸并冷却的蒸馏水,溶解后,加入约0.2g 的Na2CO3 ,(浓度为0.02%)贮存于棕色试剂瓶中,取上层清液标定。

直接碘量法测定药片中维生素C的含量11化学曾凯平11218022一实验目的1.掌握碘标准溶液的配制注意事项。
2. 通过维生素C的测定了解直接碘量法的过程。
二实验原理维生素C又叫抗坏血酸,分子式C6H4O6。
由于分子中的烯二醇基具有还原性,能被I2定量地氧化成二酮基,其反应式为:碱性条件下可使反应向右进行完全,但因维生素C还原性很强,在碱性溶液中尤其易被空气氧化,在酸性介质中较为稳定,故反应应在稀酸(如稀乙酸、稀硫酸或偏磷酸)溶液中进行,并在样品溶于稀酸后,立即用碘标准溶液进行滴定。
由于碘的挥发性和腐蚀性,不宜在分析天平上直接称取,需采用间接配制法;通常用基准As2O3对I2溶液进行标定。
As2O3不溶于水,溶于NaOH:As2O3+6NaOH═2Na3AsO3+3H2O由于滴定不能在强碱性溶液中进行,需加H2SO4中和过量的NaOH,并加入NaHCO3使溶液的pH=8。
I2与亚砷酸之间的反应为:AsO32-+I2+H2O═AsO43-+2I-+2H+三器皿和试剂酸式滴定管;NaHCO3、KI、I2(以上为AR),As2O3(于105 C 干燥至恒重),6mol·L-1NaOH,0.5mol·L-1H2SO4,10%HAc,1%淀粉溶液,维生素C片剂。
四实验步骤1. 0.1mol·L-1I2标准溶液的配制称取10.8gKI,溶于10mL蒸馏水中,再用表面皿称取I2约6.5g,溶于上述KI溶液,加1滴浓盐酸,加水稀释至300mL,摇匀,用玻璃漏斗过滤,贮存于棕色试剂瓶中并置于暗处。
2.0.1mol·L-1I2标准溶液的标定准确称取基准As2O30.15g,加6mol·L-1NaOH溶液10mL,微热使溶解,加水20mL,加甲基橙指示剂1滴,加0.5mol·L-1H2SO4试液至溶液由黄色变为粉红,再加NaHCO32g、水30mL、淀粉指示剂2mL,用碘标准溶液滴定至蓝色,半分钟内不褪色,计算I2的浓度。



实训x :直接碘量法测定维生素C 片的含量一、目的要求:通过实训掌握直接碘量法测定Vc 片含量的原理及其操作。
熟悉片剂通过滴定分析测定含量时的处理方法。
二、原理:维生素C(C 6H 8O 6),分子结构中的烯二醇基具有还原性,能被I 2定量地氧化成二酮基,抗坏血酸分子中的二烯醇基被I 2完全氧化后,则I 2与淀粉指示剂作用而使溶液变蓝,因此当滴定到溶液出现蓝色时即为终点。
维生素C 在空气中极易被氧化,尤其在碱性介质中更甚,故该滴定反应在稀HAc 中进行,以减少维生素C 的副反应。
该反应产物HI 为酸性,醋酸酸性条件下不利于反应向右进行,但由于维生素C 的还原性很强,即使在弱酸性条件下,上述反应也进行得相当完全。
三、操作步骤:直接碘量法:取本品10片,精密称定,研细,精密称取适量(约相当于维生素C0.2g ),置100ml 锥形瓶中,加新沸过的冷水100ml 与稀醋酸10ml 的混合液适量,振摇使维生素C溶解并稀释至刻度,迅速滤过,精密量取续滤液50ml ,加淀粉指示液1ml ,立即用碘滴定液(0.05mol ·L -1)滴定,至溶液显蓝色并持续30秒钟不褪。
每1ml 碘 滴定液(0.05mol ·L -1)相当于8.806mg 的C 6H 8C 6。
平行测定3份,计算含量。
四、计算:维生素C 含量以标示量来计算,按下式计算: F (I 2)×V (I 2)×T (C 6H 8O 6)×W 平%(C 6H 8O 6)=—————————————————×100% m ×规格F-----滴定液浓度有效因数V-----供试品消耗碘滴定液的体积 T-----滴定度W 平-----平均片重g m------供试品取用量g 五、注意点:1、在稀醋酸酸性介质中,维生素C 受空气中氧的氧化速度减慢,但供试品溶于稀醋酸后仍应立即进行滴定。
2、溶剂使用新沸过的冷水以减少水中溶解氧对测定的影响。

实 验 报 告姓名: 班级: 同组人: 自评成绩:项目: 直接碘量法测定维生素C 的含量 课程: 学号:一、实验目的1. 熟悉直接碘量法的操作步骤及注意事项。
2. 了解维生素C 的测定原理及条件。
二、实验原理维生素C 又称抗坏血酸,其分子中的烯二醇基具有较强的还原性,能被I 2定量氧化成二酮基,所以可用直接碘量法测定其含量。
反应方程式如下:OHOOHO C H OHCH 2OH + I 2O O C HHOCH 2OH + 2HI OO在中性或碱性条件下,维生素C 易被空气中的O 2氧化而产生误差,尤其在碱性条件下,误差更大。
故该滴定反应在酸性溶液中进行,以减慢副反应的速度。
注意事项:1. I 2具有挥发性,取完后应立即盖好瓶塞。
2. 维生素C 易被空气氧化而引入误差,所以不要3份同时移取。
3. 滴定近终点时应充分振摇,并放慢滴定速度。
三、仪器和药品仪器:分析天平,酸式滴定管(25mL ,棕色),吸量管(2mL),量筒(15mL 、5mL),碘量瓶(250mL)。
试剂:维生素C 注射液(20mL : 2.5g),I 2标准溶液(0.05mol/L),醋酸(2mol/L ),丙酮,淀粉指示剂(1%)。
四、内容及步骤精密量取维生素C 注射液1.6mL(约相当于维生素C0.2g),置于250mL 碘量瓶中,加新煮沸并放冷至室温的蒸馏水15mL 与丙酮2mL ,摇匀,放置5min ,加2mol/L 醋酸4mL 与淀粉指示剂1mL ,用I 2标准溶液(0.05mol/L)滴定,至溶液显蓝色并持续30s 不褪色,即为终点。
记录所消耗的I 2标准溶液的体积。
平行测定3次,以上平行测定3次的算术平均值为测定结果。
五、实验结果记录与计算 1、数据记录%100.61202.51000%/68622O H C I I C ⨯⨯⨯=M V c 维生素ω (2.1176686O H C =M )六、思考题:1、为何要用新煮沸的蒸馏水?2、若在碱性条件下测定,所产生的误差是正误差还是负误差?教师评语:年月日如有侵权请联系告知删除,感谢你们的配合!。

维生素C 药片中含量的测定(碘量法)一、实验目的1、 掌握直接碘量法测定的原理及其操作。
2、 掌握碘标准溶液的配制及标定。
3、 掌握维生素C 的测定方法。
二、实验原理 (一)碘量法碘量法是以I 2的氧化性和I -的还原性为基础的滴定分析方法。
在一定条件下,用碘离子来还原,定量的析出碘单质,然后用2S 2O 3 标准溶液来滴定析出的I 2。
这种方法叫做间接碘量法。
本实验采用间接碘量法测碘的浓度。
以淀粉为指示剂,2S 2O 3 标准溶液来滴定析出的I 2,以蓝色消失为终点,即可算出碘的浓度。
维生素C 又称抗坏血酸,分子式C 6H 8O 6。
具有还原性,可被I 2定量氧化,因而可用I 2标准溶液直接测定。
其滴定反应式:(二)碘溶液的配制与标定OHOOHO CH OH CH 2OH +I 2OOOO C H OH CH 2OH +2HIHOAcI 2微溶于水而易溶于溶液,但在稀的溶液中溶解得很慢,所以配制I 2溶液时不能过早加水稀释,应先将I 2和混合,用少量水充分研磨,溶解完全后再加水稀释。
I 2 溶液的标定可以用2O 3或2S 2O 3标定,因为2O 3是剧毒物质,我们用2S 2O 3来标定。
(三)硫代硫酸钠溶液的配制与标定2S 2O 3一般含有少量杂质,在9-10间稳定,所以在2S 2O 3溶液中加入少量的23,2S 2O 3见光易分解可用棕色瓶储于暗处,经一周后,用K 2C 2O 7做基准物间接碘量法标定2S 2O 3溶液的浓度。
根据K 2C 2O 7标准溶液的物质的量浓度和滴定消耗的体积,就可计算出溶液中2S 2O 3的浓度。
其过程为:K 2C 2O 7与先反应析出I 2:析出的I 2再用标准的2S 2O 3溶液滴定:从而求得2S 2O 3的浓度。
这个标定2S 2O 3的方法为间接碘量法。
碘量法的基本反应式:2S 2O 32-+I 24O 62-+2I - 标定2S 2O 3溶液时有:6I -+2O 72-+14H +=23++3I 2+7H 2O 2S 2O 32-+I 24O 62-+2I -2S 2O 3标定时有(K 2C 2O 7): n(2S 2O 3)=1:6三、实验药品及仪器 实验药品和试剂:I 2分析纯 溶液100g ·1 2S 2O 3·5H 2O 溶液 0.01701K 2C 2O 7溶液 淀粉指示剂5 g ·1 23 固体 溶液 6 1 冰醋酸 维生素C 药片 主要仪器:分析天平、天平、量筒、烧杯、酸式碱式滴定管、表面皿、容量瓶(250)、锥形瓶(250)、碘量瓶(250)、移液管(25)、洗瓶等常规分析仪器 四、实验步骤(一)、2S 2O 3 溶液的配制及标定1、配制0.10 2S 2O 3溶液500 称取132S 2O 3·5H 2O ,溶于500新煮沸的蒸馏水中,加入0.123,保存于棕色瓶中,放置一周后进行标定。


一.真验手段之阳早格格创做1.掌握碘尺度溶液的配造战标定要领;2.相识曲交碘量法测定维死素C 的本理战要领. 两.真验本理维死素C (Vc )又称抗坏血酸,分子式686O H C ,分子量1mol •176.1232/g -.Vc具备还本性,可被2I 定量氧化,果而可用2I 尺度溶液曲交滴定.其滴定反应式为:.由于Vc 的还本性很强,较易被溶液战气氛中的氧氧化,正在碱性介量中那种氧化效率更强,果此滴定宜正在酸性介量中举止,以缩小副反应的爆收.思量到-I 正在强酸性溶液中也易被氧化,故普遍选正在pH=3~4的强酸性溶液中举止滴定. 三.主要试剂1.2I 溶液(约1L •0.05mol -):称与2I 战5g KI ,置于研钵中,加少量火,正在透气橱中研磨.待2I 局部溶解后,将溶液转进棕色试剂瓶中,加火密释至250mL ,充分摇匀,搁暗淡处保存.2.322O S Na 尺度溶液(1L •0.1127mol -) 3.HAc (1L •2mol -) 4.淀粉溶液 5.维死素C 片剂 6.KI 溶液 四.真验步调 1.2I 溶液的标定322O S Na 尺度溶液于250mL 锥形瓶中,加40mL 蒸馏火,4mL 淀粉溶液,而后用2I 溶液滴定至溶液呈浅蓝色,30s 内没有褪色即为末面.仄止标定3份,估计12L •)/m ol (I -c .2.维死素C 片剂中Vc 含量的测定准确称与2片维死素C 药片,置于250mL 锥形瓶中,加进100mL 新煮沸过并热却的蒸馏火,10mLHAc 溶液战5mL 淀粉溶液,坐时用2I 尺度溶液滴定至出现宁静的浅蓝色,且正在30s 内没有褪色即为末面,记下消耗的)/m L (I 2V .仄止滴定3份,估计试样中的Vc 的品量分数.五.数据记录与处理 1.2I 溶液的标定2.维死素C 片剂中Vc 含量的测定六.真验归纳标定得)L •04825(mol .0)(I 12-=c ,测得%52.84)Vc (=ω.七.分解计划1.KI I 2-溶液呈深棕色,正在滴定管中较易辨别凸液里,但是液里最下面较领会,所以常读与液里最下面,读时应安排眼睛的位子,使之与液里最下面前后正在共一火仄位子上.2.使用碘量法时,该当用碘量瓶,预防2I 、322O S Na 、Vc 被氧化,效率真验截止的准确性.3.由于真验中没有克没有及预防天摇动锥形瓶,果此气氛中的氧会将Vc 氧化,使截止偏偏矮. 八.思索题1.溶解2I 时,加进过量KI 的效率是什么?问:查得,碘正在火中的溶解度为O)00gH g/(02.02 .果此,溶解度很矮.加进过量的KI ,可减少2I 正在火中的溶解度,反应式如下:2.维死素C 固体试样溶解时为何要加进新煮沸并热却的蒸馏火? 问:Vc 有强还本性,为预防火中溶解的氧氧化Vc ,果此要将蒸馏火煮沸,以与消火中溶解的氧;为预防Vc 的结构被损害,果此要将煮沸的蒸馏火热却.3.碘量法的缺面根源有哪些?应采与哪些步伐缩小缺面?问:(1)读数缺面,由于碘尺度溶液颜色较深,溶液凸液里易以辨别;但是液里最下面较领会,所以常读数液里最下面,读时应安排眼睛的位子,使之与液里最下面前后正在共一火仄位子上.(2)反应物简单被气氛中的氧氧化;滴定历程中用碘量瓶,而没有必锥形瓶,预防剧烈天摇动.。
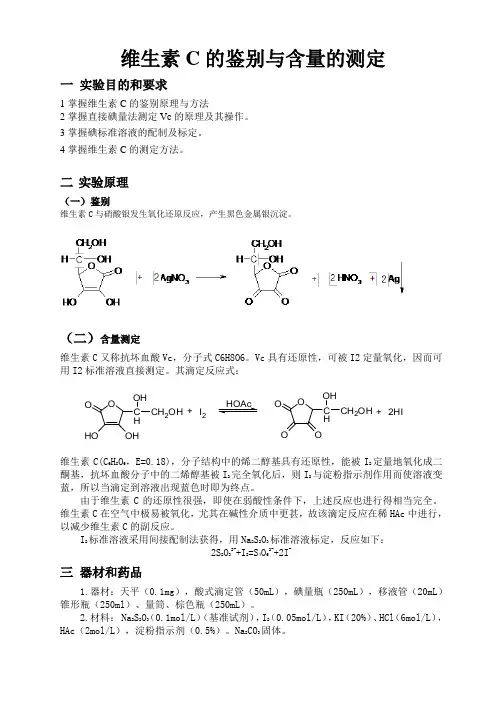
维生素C 的鉴别与含量的测定一 实验目的和要求1掌握维生素C 的鉴别原理与方法2掌握直接碘量法测定Vc 的原理及其操作。
3掌握碘标准溶液的配制及标定。
4掌握维生素C 的测定方法。
二 实验原理(一)鉴别维生素C 与硝酸银发生氧化还原反应,产生黑色金属银沉淀。
(二)含量测定维生素C 又称抗坏血酸Vc ,分子式C6H8O6。
Vc 具有还原性,可被I2定量氧化,因而可用I2标准溶液直接测定。
其滴定反应式:维生素C(C 6H 8O 6,E=0.18),分子结构中的烯二醇基具有还原性,能被I 2定量地氧化成二酮基,抗坏血酸分子中的二烯醇基被I 2完全氧化后,则I 2与淀粉指示剂作用而使溶液变蓝,所以当滴定到溶液出现蓝色时即为终点。
由于维生素C 的还原性很强,即使在弱酸性条件下,上述反应也进行得相当完全。
维生素C 在空气中极易被氧化,尤其在碱性介质中更甚,故该滴定反应在稀HAc 中进行,以减少维生素C 的副反应。
I 2标准溶液采用间接配制法获得,用Na 2S 2O 3标准溶液标定,反应如下:2S 2O 32-+I 2=S 4O 62-+2I -三 器材和药品1.器材:天平(0.1mg ),酸式滴定管(50mL ),碘量瓶(250mL ),移液管(20mL )锥形瓶(250ml )、量筒、棕色瓶(250mL )。
2.材料: Na 2S 2O 3(0.1mol/L )(基准试剂),I 2(0.05mol/L ),KI (20%)、HCl (6mol/L ),HAc (2mol/L ),淀粉指示剂(0.5%)。
Na 2CO 3固体。
OHOOHO C H OH CH 2OH +I 2OOOO C H OH CH 2OH +2HIHOAc四实验内容:(一)鉴别方法取该注射液0.5ml,加硝酸银试液5滴,即生成金属银的黑色沉淀。
(二)含量测定方法1、配制0.1mol/LNa2S2O3标准溶液称取12.5gNa2S2O3·5H2O,溶于500mL新煮沸并冷却的蒸馏水中,加入0.1gNa2CO3使溶液呈碱性,以防止Na2S2O3的分解,保存于棕色瓶中,即可配得的基准试剂0.1mol/LNa2S2O3标准溶液2.0.5%淀粉溶液的配制称取1g淀粉于小烧杯中,加少许水调成浆,搅拌下加到200mL沸水中,冷却后备用3. 配制与标定I2标准溶液1)I2标准溶液的配制称取3.3gI2和5gKI置于小烧杯中,加少量水,搅拌至I2全部溶解,转入250mL棕色瓶中,加水至250mL,混合均匀。
维⽣素C的含量测定(直接碘量法)维⽣素C含量测定维⽣素C⽚含量的测定⽅法很多,各种⽅法各有其特点,如:(直接/间接)碘量法;2,6-⼆氯靛酚法;紫外可见分光光度法和⾼效液相⾊谱法。
《中国药典》2010年版⼆部采⽤碘量法测含量,此法虽然操作简单,但因制剂中常有还原性物质存在,对此法⼲扰明显,且由于碘具有挥发性,碘离⼦易被空⽓所氧化⽽使滴定产⽣误差。
常见的其他滴定法存在滴定终点难以准确判断,如2,6-⼆氯靛酚法:2,6-⼆氯靛酚是⼀种染料,其氧化型在酸性介质中为红⾊,碱性介质中为蓝⾊,与维⽣素C反应后,⽣成⽆⾊的还原型酚亚胺,因此,在酸性条件下,⽤2,6-⼆氯靛酚滴定⾄溶液显玫瑰红⾊,即为终点;⽆需另加指⽰剂。
分光光度法运⽤维⽣素C的旋光性能进⾏含量测定,但操作费时,⽽⾼效液相⾊谱法是⽬前发展较为迅速的⼀种⽅法,灵敏度⾼,选择性好,是⼀个准确⾼效的测定维⽣素C含量的⽅法。
我们主要介绍的是直接碘量法。
直接碘量法⼀.实验原理维⽣素C是⼈体重要的维⽣素之⼀,它影响胶元蛋⽩的形成,参与⼈体多种氧化-还原反应,并且有解毒作⽤。
⼈体不能⾃⾝制造维⽣素C,所以⼈体必须不断地从⾷物中摄⼊维⽣素C,通常还需储藏能维持⼀个⽉左右的维⽣素C。
缺乏时会产⽣坏⾎病,故⼜称抗坏⾎酸。
维⽣素C属⽔溶性维⽣素,分⼦式C6H8O6。
分⼦中的烯⼆醇基具有还原性,能被I2定量地氧化成⼆酮基,因⽽可⽤I2标准溶液直接测定。
简写为:C6H8O6+I2= C6H6O6+2HI使⽤淀粉作为指⽰剂,⽤直接碘量法可测定药⽚、注射液、饮料、蔬菜、⽔果中维⽣素C的含量。
由于维⽣素C的还原性很强,较容易被溶液和空⽓中的氧氧化,在碱性介质中这种氧化作⽤更强,因此滴定宜在酸性介质中进⾏,以减少副反应的发⽣。
考虑到I - 在强酸性中也易被氧化,故⼀般选在pH为3~4的弱酸性溶液中进⾏滴定。
由于碘具有挥发性,碘离⼦易被空⽓所氧化⽽使滴定产⽣误差;⼜由于碘的挥发性和腐蚀性,使碘标准滴定溶液的配制及标定⽐较⿇烦。
直接碘量法测定维生素c含量
维生素C,也被称为抗坏血酸,是一种水溶性维生素。
它在许多生物体内起着重要的生理作用,并且对人体有益。
维生素C含量测定是基于一种叫做碘量法的化学方法。
该方法利用碘酸钾溶液与维生素C反应的化学性质,通过了解反应后剩余的碘酸钾的含量来测定维生素C含量。
碘量法测定维生素C的过程如下:
准备样品:将要测定的样品加入到3%的浓磷酸中,并将其加热到约80℃,然后再冷却。
制备碘酸钾溶液:将20克的碘酸钾加入到1000毫升的蒸馏水中,并充分搅拌,以制备出0.1N的碘酸钾溶液。
测定过程:将取出的样品加入到定容瓶中,加入足够的蒸馏水,直至瓶子充满为止。
然后取出1毫升的样品溶液,并将其加入到滴定瓶中。
加入几滴淀粉溶液。
此时,溶液会变成淡蓝色。
准备滴定剂:将制备好的碘酸钾溶液滴加到另一个滴定瓶中,并加入适量的酒精。
通过滴加,将滴定剂加入到样品溶液中,直至溶液变成深蓝色。
读取数据:记录滴定剂滴入样品溶液的次数,并且根据已知的滴定剂浓度计算出维生素C的含量。
利用碘量法可以准确地测定含有维生素C的食物以及药品的维生素C含量。
然而,由于该测量方法需要使用化学试剂和复杂的实验过程,所以在实践中不太实用。
为了更加方便测量维生素C的含量,也出现了其他测量方法,例如高效液相色谱法和光谱法。
无论使用哪种方法测量维生素C的含量,都可以帮助人们了解他们摄入的营养成分,以及制定更加健康的膳食计划。
实验四直接碘量法测定维生素C的含量一、实验目的1.掌握碘标准溶液的配制与标定方法。
2.了解直接碘量法的操作步骤及注意事项。
3.掌握直接碘量法的基本操作。
二、实验原理电对电位低的较强还原性物质,可用碘标准溶液直接滴定,这种滴定方法,称为直接碘量法。
维生素C(C6H8O6)又称抗坏血酸,其分子中的烯二醇基具有较强的还原性,能被I2定量氧化成二酮基,所以可用直接碘量法测定其含量。
其反应式如下:从反应式可知,在碱性条件下,有利于反应向右进行。
但由于维生素C的还原性很强,即使在弱酸性条件下,此反应也能进行得相当完全。
在中性或碱性条件下,维生素C易被空气中的O2氧化而产生误差,尤其在碱性条件下,误差更大。
故该滴定反应在酸性溶液中进行,以减慢副反应的速度。
三、实验器材、药品器材:分析天平,酸式滴定管(25mL,棕色),吸量管(2mL),量筒(15mL、5mL),锥形瓶(250m1)。
药品:维生素C注射液(20mL 2.5g),I2标准溶液(0.05mol·L-1),稀醋酸,丙酮,淀粉指示剂。
四、实验操作步骤1、I2标准溶液(0.05mol·L-1)的配制取KI 10.8g于小烧杯中,加水约15mL,搅拌使其溶解。
再取I2 3.9g,加入上述KI溶液中,搅拌至I2完全溶解后,加盐酸1滴,转移至棕色瓶中,用蒸馏水稀释至300mL,摇匀,用垂熔玻璃滤器过滤。
2、I2标准溶液(0.05mol·L-1)的标定精密称取在105℃干燥至恒重的基准物质As2O33份,每份在0.1080~0.1320g之间,置于3个锥形瓶中,各加NaOH溶液(1mol·L-1)4.00mL使溶解,加蒸馏水20.00mL与酚酞指示剂1滴,滴加H2SO4溶液(1mol·L-1)至粉红色褪去,再加NaHCO3 2g,蒸馏水30.00mL及淀粉指示剂2mL,用待标定的I2标准溶液滴定至溶液显浅蓝紫色,即为终点,记录所消耗碘标准溶液的体积。
直接碘量法测VC一.实验目的1.掌握碘标准溶液的配制和标定方法;2.了解直接碘量法测定维生素C 的原理和方法。
二.实验原理维生素C (Vc )又称抗坏血酸,分子式686O H C ,分子量1mol •176.1232/g 。
Vc 具有还原性,可被2I 定量氧化,因而可用2I 标准溶液直接滴定。
其滴定反应式为:。
由于Vc 的还原性很强,较易被溶液和空气中的氧氧化,在碱性介质中这种氧化作用更强,因此滴定宜在酸性介质中进行,以减少副反应的发生。
考虑到-I 在强酸性溶液中也易被氧化,故一般选在pH=3~4的弱酸性溶液中进行滴定。
使用淀粉作为指示剂,用直接碘量法可测定水果中维生素C 的含量。
I 2标准溶液采用间接配制法获得,用Na 2S 2O 3标准溶液标定,反应如下: 2S 2O 32-+I 2 = S 4O 62-+2I-器材和药品1.器材 天平(0.1mg ),碱式滴定管(50 mL)、酸式滴定管(50mL ),碘量瓶(250mL ),移液管(20mL )锥形瓶(250ml )、量筒、棕色瓶(250mL )。
从此以下未整理2.药品 果汁、K 2Cr 2O 7(基准试剂),Na 2S 2O 3(0.02mol·L-1),I 2(0.01 mol·L-1),KI (20%)、HCl,(6mol·L-1),HAc (2mol·L-1),淀粉指示剂(0.5%)。
Na2CO3固体 以上试剂未说明均为分析纯,水为蒸馏水所需试剂的用量及配制方法:1、 0.1 mol·L-1Na 2S 2O 3标准溶液的配制称取25g Na 2S 2O 3·5H 2O ,溶于1000mL 新煮沸并冷却的蒸馏水中,加入0.2gNa2CO3使溶液呈碱性,以防止Na 2S 2O 3的分解,保存于棕色瓶中,放置10天后过滤,再标定.放置长时间后,再用前应重新标定。
2、K 2Cr 2O 7标准溶液的配制准确称取基准试剂K 2Cr2O 7 0.26—0.28g 于小烧杯中,加入少量蒸馏水溶解后,移入200ml 容量瓶中,用蒸馏水稀释至刻度,摇匀.3、0.1 mol·L-1Na2S2O3标准溶液的标定用移液管吸取上述标准溶液20. 00ml 于250ml 碘瓶中,加8ml 6 mol·L HCl,5-8ml 20%KI 溶液,盖上表面皿,在暗处放5分钟后,加100ml 水,立即以用待标定的Na2S2O3溶液滴定至淡黄色,再加入2ml 0.5%淀粉溶液, 继续滴至溶液呈亮绿色为终点.平行滴定3次。
一.实验目的
1.掌握碘标准溶液的配制和标定方法;
2.了解直接碘量法测定维生素C 的原理和方法。
二.实验原理
维生素C (Vc )又称抗坏血酸,分子式686O H C ,分子量1mol •176.1232/g -。
Vc 具有还原性,可被2I 定量氧化,因而可用2I 标准溶液直接滴定。
其滴定反应式为:。
由于Vc 的还原性很强,较易被溶液和空气中的氧氧化,在碱性介质中这种氧化作用更强,因此滴定宜在酸性介质中进行,以减少副反应的发生。
考虑到-I 在强酸性溶液中也易被氧化,故一般选在pH=3~4的弱酸性溶液中进行滴定。
三.主要试剂
1.2I 溶液(约1L •0.05mol -):称取3.3g 2I 和5g KI ,置于研钵中,加少量水,在
通风橱中研磨。
待2I 全部溶解后,将溶液转入棕色试剂瓶中,加水稀释至250mL ,充分摇匀,放阴暗处保存。
2.322O S Na 标准溶液(1L •0.1127mol -) 3.HAc (1L •2mol -) 4.淀粉溶液 5.维生素C 片剂 6.KI 溶液
四.实验步骤
1.2I 溶液的标定
用移液管移取322O S Na 标准溶液于250mL 锥形瓶中,加40mL 蒸馏水,4mL 淀粉溶液,然后用2I 溶液滴定至溶液呈浅蓝色,30s 内不褪色即为终点。
平行标定3份,计算12L •)/m ol (I -c 。
2.维生素C 片剂中Vc 含量的测定
准确称取2片维生素C 药片,置于250mL 锥形瓶中,加入100mL 新煮沸过并冷却的蒸馏水,10mLHAc 溶液和5mL 淀粉溶液,立即用2I 标准溶液滴定至出现稳定的浅蓝色,且在30s 内不褪色即为终点,记下消耗的)/m L (I 2V 。
平行滴定3份,计算试样中的Vc 的质量分数。
五.数据记录与处理
1.2I 溶液的标定
2.维生素C 片剂中Vc 含量的测定
六.实验总结
标定得)L •04825(mol .0)(I 12-=c ,测得%52.84)Vc (=ω。
七.分析讨论
1.KI I 2-溶液呈深棕色,在滴定管中较难分辨凹液面,但液面最高点较清楚,所以常读取液面最高点,读时应调节眼睛的位置,使之与液面最高点前后在同一水平位置上。
2.使用碘量法时,应该用碘量瓶,防止2I 、322O S Na 、Vc 被氧化,影响实验结果的准确性。
3.由于实验中不能避免地摇动锥形瓶,因此空气中的氧会将Vc 氧化,使结果偏
低。
八.思考题
1.溶解2I 时,加入过量KI 的作用是什么
答:查得,碘在水中的溶解度为O)00gH g/(02.021。
因此,溶解度很低。
加入过量
的KI ,可增加2I 在水中的溶解度,反应式如下:
2.维生素C固体试样溶解时为何要加入新煮沸并冷却的蒸馏水
答:Vc有强还原性,为防止水中溶解的氧氧化Vc,因此要将蒸馏水煮沸,以除去水中溶解的氧;为防止Vc的结构被破坏,因此要将煮沸的蒸馏水冷却。
3.碘量法的误差来源有哪些应采取哪些措施减少误差
答:(1)读数误差,由于碘标准溶液颜色较深,溶液凹液面难以分辨;但液面最高点较清楚,所以常读数液面最高点,读时应调节眼睛的位置,使之与
液面最高点前后在同一水平位置上。
(2)反应物容易被空气中的氧氧化;滴定过程中用碘量瓶,而不用锥形瓶,避免剧烈地摇动。