直接碘量法测定维生素c含量
- 格式:ppt
- 大小:259.00 KB
- 文档页数:14

直接碘量法测定药片中维生素C的含量11化学曾凯平11218022一实验目的1.掌握碘标准溶液的配制注意事项。
2. 通过维生素C的测定了解直接碘量法的过程。
二实验原理维生素C又叫抗坏血酸,分子式C6H4O6。
由于分子中的烯二醇基具有还原性,能被I2定量地氧化成二酮基,其反应式为:碱性条件下可使反应向右进行完全,但因维生素C还原性很强,在碱性溶液中尤其易被空气氧化,在酸性介质中较为稳定,故反应应在稀酸(如稀乙酸、稀硫酸或偏磷酸)溶液中进行,并在样品溶于稀酸后,立即用碘标准溶液进行滴定。
由于碘的挥发性和腐蚀性,不宜在分析天平上直接称取,需采用间接配制法;通常用基准As2O3对I2溶液进行标定。
As2O3不溶于水,溶于NaOH:As2O3+6NaOH═2Na3AsO3+3H2O由于滴定不能在强碱性溶液中进行,需加H2SO4中和过量的NaOH,并加入NaHCO3使溶液的pH=8。
I2与亚砷酸之间的反应为:AsO32-+I2+H2O═AsO43-+2I-+2H+三器皿和试剂酸式滴定管;NaHCO3、KI、I2(以上为AR),As2O3(于105 C 干燥至恒重),6mol·L-1NaOH,0.5mol·L-1H2SO4,10%HAc,1%淀粉溶液,维生素C片剂。
四实验步骤1. 0.1mol·L-1I2标准溶液的配制称取10.8gKI,溶于10mL蒸馏水中,再用表面皿称取I2约6.5g,溶于上述KI溶液,加1滴浓盐酸,加水稀释至300mL,摇匀,用玻璃漏斗过滤,贮存于棕色试剂瓶中并置于暗处。
2.0.1mol·L-1I2标准溶液的标定准确称取基准As2O30.15g,加6mol·L-1NaOH溶液10mL,微热使溶解,加水20mL,加甲基橙指示剂1滴,加0.5mol·L-1H2SO4试液至溶液由黄色变为粉红,再加NaHCO32g、水30mL、淀粉指示剂2mL,用碘标准溶液滴定至蓝色,半分钟内不褪色,计算I2的浓度。

![直接碘量法测定维生素c含量[整理版]](https://uimg.taocdn.com/448c533b5022aaea988f0f26.webp)
直接碘量法测定维生素c含量[整理版] 一(实验目的1(掌握碘标准溶液的配制和标定方法;2(了解直接碘量法测定维生素C的原理和方法。
二(实验原理,1维生素C(Vc)又称抗坏血酸,分子式,分子量。
Vc具有还原性,可CHO176.1232/g•mol686被定量氧化,因而可用标准溶液直接滴定。
其滴定反应式为:。
II22由于Vc的还原性很强,较易被溶液和空气中的氧氧化,在碱性介质中这种氧化作用更强,因此滴定,宜在酸性介质中进行,以减少副反应的发生。
考虑到在强酸性溶液中也易被氧化,故一般选在pH=3~4I的弱酸性溶液中进行滴定。
三(主要试剂,1KI0.05mol•L 1(溶液(约):称取3.3g和5g,置于研钵中,加少量水,在通风橱中研磨。
待 III222全部溶解后,将溶液转入棕色试剂瓶中,加水稀释至250mL,充分摇匀,放阴暗处保存。
,10.1127mol•LNaSO 2(标准溶液() 223,12mol•L 3(HAc()4(淀粉溶液5(维生素C片剂6(KI溶液四(实验步骤I 1(溶液的标定 2NaSO 用移液管移取20.00mL标准溶液于250mL锥形瓶中,加40mL蒸馏水,4mL淀粉溶液,223,1然后用溶液滴定至溶液呈浅蓝色,30s内不褪色即为终点。
平行标定3份,计算。
Ic(I)/mol•L222(维生素C片剂中Vc含量的测定准确称取2片维生素C药片,置于250mL锥形瓶中,加入100mL新煮沸过并冷却的蒸馏水,10mLHAc溶液和5mL淀粉溶液,立即用标准溶液滴定至出现稳定的浅蓝色,且在30s内不褪色即为终点,记下I2消耗的。
平行滴定3份,计算试样中的Vc的质量分数。
V(I)/mL2五(数据记录与处理1(溶液的标定 I21 2 3 项目序号,1 c(NaSO)/mol•L0.1127 223V(NaSO)/mL20.00 223V(I)/mL23.39 23.35 23.33 2,1 0.04818 0.04827 0.04831 c(I)/mol•L2,1平均0.04825 c(I)/mol•L2dr/% 0.15 0.04 0.120.10 dr/%2(维生素C片剂中Vc含量的测定1 2 3 项目序号,1 0.04825 c(I)/mol•L2m(药片)/g0.2408 0.2395 0.2377V(I)/mL23.92 23.82 23.67 2,(Vc)/%84.41 84.52 84.62平均 ,(Vc)/%84.52dr/% 0.13 0 0.120.08 dr/%六(实验总结,1,(Vc),84.52%标定得,测得。

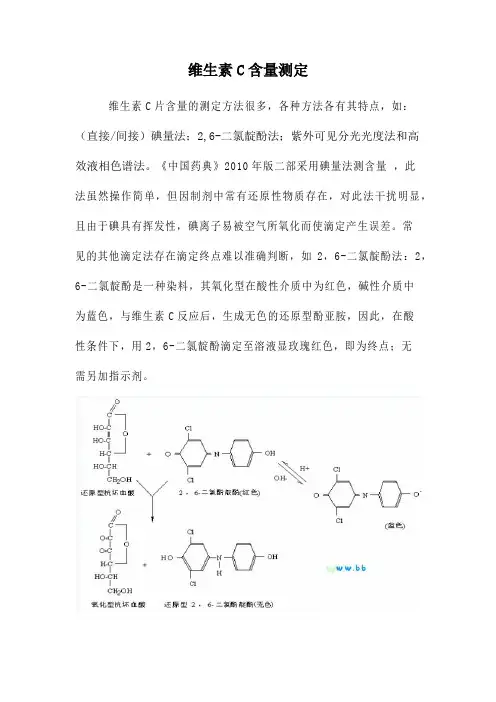
维生素C含量测定维生素C片含量的测定方法很多,各种方法各有其特点,如:(直接/间接)碘量法;2,6-二氯靛酚法;紫外可见分光光度法和高效液相色谱法。
《中国药典》2010年版二部采用碘量法测含量,此法虽然操作简单,但因制剂中常有还原性物质存在,对此法干扰明显,且由于碘具有挥发性,碘离子易被空气所氧化而使滴定产生误差。
常见的其他滴定法存在滴定终点难以准确判断,如2,6-二氯靛酚法:2,6-二氯靛酚是一种染料,其氧化型在酸性介质中为红色,碱性介质中为蓝色,与维生素C反应后,生成无色的还原型酚亚胺,因此,在酸性条件下,用2,6-二氯靛酚滴定至溶液显玫瑰红色,即为终点;无需另加指示剂。
分光光度法运用维生素C的旋光性能进行含量测定,但操作费时,而高效液相色谱法是目前发展较为迅速的一种方法,灵敏度高,选择性好,是一个准确高效的测定维生素C含量的方法。
我们主要介绍的是直接碘量法。
直接碘量法一.实验原理维生素C是人体重要的维生素之一,它影响胶元蛋白的形成,参与人体多种氧化-还原反应,并且有解毒作用。
人体不能自身制造维生素C,所以人体必须不断地从食物中摄入维生素C,通常还需储藏能维持一个月左右的维生素C。
缺乏时会产生坏血病,故又称抗坏血酸。
维生素C属水溶性维生素,分子式C6H8O6。
分子中的烯二醇基具有还原性,能被I2定量地氧化成二酮基,因而可用I2标准溶液直接测定。
简写为:C6H8O6+I2= C6H6O6+2HI使用淀粉作为指示剂,用直接碘量法可测定药片、注射液、饮料、蔬菜、水果中维生素C的含量。
由于维生素C的还原性很强,较容易被溶液和空气中的氧氧化,在碱性介质中这种氧化作用更强,因此滴定宜在酸性介质中进行,以减少副反应的发生。
考虑到I - 在强酸性中也易被氧化,故一般选在pH为3~4的弱酸性溶液中进行滴定。
由于碘具有挥发性,碘离子易被空气所氧化而使滴定产生误差;又由于碘的挥发性和腐蚀性,使碘标准滴定溶液的配制及标定比较麻烦。

直接碘量法测定维生素c含量
维生素C,也被称为抗坏血酸,是一种水溶性维生素。
它在许多生物体内起着重要的生理作用,并且对人体有益。
维生素C含量测定是基于一种叫做碘量法的化学方法。
该方法利用碘酸钾溶液与维生素C反应的化学性质,通过了解反应后剩余的碘酸钾的含量来测定维生素C含量。
碘量法测定维生素C的过程如下:
准备样品:将要测定的样品加入到3%的浓磷酸中,并将其加热到约80℃,然后再冷却。
制备碘酸钾溶液:将20克的碘酸钾加入到1000毫升的蒸馏水中,并充分搅拌,以制备出0.1N的碘酸钾溶液。
测定过程:将取出的样品加入到定容瓶中,加入足够的蒸馏水,直至瓶子充满为止。
然后取出1毫升的样品溶液,并将其加入到滴定瓶中。
加入几滴淀粉溶液。
此时,溶液会变成淡蓝色。
准备滴定剂:将制备好的碘酸钾溶液滴加到另一个滴定瓶中,并加入适量的酒精。
通过滴加,将滴定剂加入到样品溶液中,直至溶液变成深蓝色。
读取数据:记录滴定剂滴入样品溶液的次数,并且根据已知的滴定剂浓度计算出维生素C的含量。
利用碘量法可以准确地测定含有维生素C的食物以及药品的维生素C含量。
然而,由于该测量方法需要使用化学试剂和复杂的实验过程,所以在实践中不太实用。
为了更加方便测量维生素C的含量,也出现了其他测量方法,例如高效液相色谱法和光谱法。
无论使用哪种方法测量维生素C的含量,都可以帮助人们了解他们摄入的营养成分,以及制定更加健康的膳食计划。

维生素c含量测定碘量法实验报告
实验目的:
本实验旨在通过维生素c含量测定碘量法,掌握测定维生素c的方法和技能,同时加深对维生素c的认识。
实验原理:
碘量法是一种常用的测定维生素c含量的方法。
其原理是利用维生素c在氯化亚铁和碘酸钾的存在下,被氧化为脱氢抗坏血酸,然后用碘量法测定反应结束时残余的碘量,从而计算出维生素c的含量。
实验步骤:
1.将维生素c样品溶解于少量水中,加入5%的氯化亚铁溶液,使其完全还原。
2.加入2ml的碘酸钾溶液,并用0.1mol/L的氢氧化钠溶液调节溶液pH值为2-3。
3.用0.1mol/L的硫酸滴定溶液滴定反应液,直至溶液呈浅黄色,再加入几滴淀粉指示剂,继续滴定至溶液呈蓝色。
4.测量反应液的体积,计算出维生素c的含量。
实验结果:
在本实验中,我们测定了三个不同维生素c含量的样品,分别为0.1g、0.2g和0.3g。
在滴定过程中,我们发现反应液颜色会在滴定末几滴发生明显变化,这时需谨慎滴加滴定液,避免过度滴定。
最终的实验结果表明,三个样品的维生素c含量分别为0.096g、0.192g和0.284g。
实验结论:
通过本实验,我们掌握了维生素c含量测定碘量法的方法和技能,同时加深了对维生素c的认识。
实验结果表明,维生素c含量与样品添加量成正比,可以通过碘量法准确测定。
实验注意事项:
1.在实验过程中,应注意安全,避免溶液溅出,避免接触皮肤和眼睛。
2.在滴定时,应注意滴定液的速度,避免过度滴定。
3.实验前应检查所用试剂的质量和纯度,避免影响实验结果。
4.实验后应及时清洗实验器材,保持实验室卫生。




实验四直接碘量法测定维生素C的含量一、实验目的1.掌握碘标准溶液的配制与标定方法。
2.了解直接碘量法的操作步骤及注意事项。
3.掌握直接碘量法的基本操作。
二、实验原理电对电位低的较强还原性物质,可用碘标准溶液直接滴定,这种滴定方法,称为直接碘量法。
维生素C(C6H8O6)又称抗坏血酸,其分子中的烯二醇基具有较强的还原性,能被I2定量氧化成二酮基,所以可用直接碘量法测定其含量。
其反应式如下:从反应式可知,在碱性条件下,有利于反应向右进行。
但由于维生素C的还原性很强,即使在弱酸性条件下,此反应也能进行得相当完全。
在中性或碱性条件下,维生素C易被空气中的O2氧化而产生误差,尤其在碱性条件下,误差更大。
故该滴定反应在酸性溶液中进行,以减慢副反应的速度。
三、实验器材、药品器材:分析天平,酸式滴定管(25mL,棕色),吸量管(2mL),量筒(15mL、5mL),锥形瓶(250m1)。
药品:维生素C注射液(20mL 2.5g),I2标准溶液(0.05mol·L-1),稀醋酸,丙酮,淀粉指示剂。
四、实验操作步骤1、I2标准溶液(0.05mol·L-1)的配制取KI 10.8g于小烧杯中,加水约15mL,搅拌使其溶解。
再取I2 3.9g,加入上述KI溶液中,搅拌至I2完全溶解后,加盐酸1滴,转移至棕色瓶中,用蒸馏水稀释至300mL,摇匀,用垂熔玻璃滤器过滤。
2、I2标准溶液(0.05mol·L-1)的标定精密称取在105℃干燥至恒重的基准物质As2O33份,每份在0.1080~0.1320g之间,置于3个锥形瓶中,各加NaOH溶液(1mol·L-1)4.00mL使溶解,加蒸馏水20.00mL与酚酞指示剂1滴,滴加H2SO4溶液(1mol·L-1)至粉红色褪去,再加NaHCO3 2g,蒸馏水30.00mL及淀粉指示剂2mL,用待标定的I2标准溶液滴定至溶液显浅蓝紫色,即为终点,记录所消耗碘标准溶液的体积。
直接碘量法测VC一.实验目的1.掌握碘标准溶液的配制和标定方法;2.了解直接碘量法测定维生素C 的原理和方法。
二.实验原理维生素C (Vc )又称抗坏血酸,分子式686O H C ,分子量1mol •176.1232/g 。
Vc 具有还原性,可被2I 定量氧化,因而可用2I 标准溶液直接滴定。
其滴定反应式为:。
由于Vc 的还原性很强,较易被溶液和空气中的氧氧化,在碱性介质中这种氧化作用更强,因此滴定宜在酸性介质中进行,以减少副反应的发生。
考虑到-I 在强酸性溶液中也易被氧化,故一般选在pH=3~4的弱酸性溶液中进行滴定。
使用淀粉作为指示剂,用直接碘量法可测定水果中维生素C 的含量。
I 2标准溶液采用间接配制法获得,用Na 2S 2O 3标准溶液标定,反应如下: 2S 2O 32-+I 2 = S 4O 62-+2I-器材和药品1.器材 天平(0.1mg ),碱式滴定管(50 mL)、酸式滴定管(50mL ),碘量瓶(250mL ),移液管(20mL )锥形瓶(250ml )、量筒、棕色瓶(250mL )。
从此以下未整理2.药品 果汁、K 2Cr 2O 7(基准试剂),Na 2S 2O 3(0.02mol·L-1),I 2(0.01 mol·L-1),KI (20%)、HCl,(6mol·L-1),HAc (2mol·L-1),淀粉指示剂(0.5%)。
Na2CO3固体 以上试剂未说明均为分析纯,水为蒸馏水所需试剂的用量及配制方法:1、 0.1 mol·L-1Na 2S 2O 3标准溶液的配制称取25g Na 2S 2O 3·5H 2O ,溶于1000mL 新煮沸并冷却的蒸馏水中,加入0.2gNa2CO3使溶液呈碱性,以防止Na 2S 2O 3的分解,保存于棕色瓶中,放置10天后过滤,再标定.放置长时间后,再用前应重新标定。
2、K 2Cr 2O 7标准溶液的配制准确称取基准试剂K 2Cr2O 7 0.26—0.28g 于小烧杯中,加入少量蒸馏水溶解后,移入200ml 容量瓶中,用蒸馏水稀释至刻度,摇匀.3、0.1 mol·L-1Na2S2O3标准溶液的标定用移液管吸取上述标准溶液20. 00ml 于250ml 碘瓶中,加8ml 6 mol·L HCl,5-8ml 20%KI 溶液,盖上表面皿,在暗处放5分钟后,加100ml 水,立即以用待标定的Na2S2O3溶液滴定至淡黄色,再加入2ml 0.5%淀粉溶液, 继续滴至溶液呈亮绿色为终点.平行滴定3次。
实验16 维生素C片剂中VC含量的测定(直接碘量法)一、实验目的1、掌握碘标准溶液的配制和标定方法。
2、了解直接碘量法测定抗坏血酸的原理和方法。
二、实验原理维生素C(Vc)又称抗坏血酸,属于水溶性维生素。
分子式为C6H8O6。
它广泛存在于水果和蔬菜中,辣椒、山楂和番茄中含量尤为丰富。
Vc具有许多对人体健康有益的功能,临床上用于坏血病的预防和治疗。
维生素属外源性维生素,人体不能自身合成,必须从食物中摄取。
Vc具有还原性,可被I2定量氧化,因而可用I2标准溶液直接滴定。
其滴定反应式为:由于反应速率较快,因此可用I2 标准溶液直接滴定药片、注射液、饮料、蔬菜、水果等中的Vc含量。
由于Vc的还原性很强,较易被溶液和空气中的氧氧化,在碱性介质中这种氧化作用更强,因此滴定宜在酸性介质中进行,以减少副反应的发生。
考虑到I- 在强酸性溶液中也易被氧化,故一般选在pH=3~4的弱酸性溶液中进行滴定。
三、仪器试剂1.仪器:50 mL酸式滴定管一支;400 mL烧杯一个;250 mL锥形瓶三个;10 mL、25 mL 移液管各一支;滴管一支;吸耳球一个;10 mL,50 mL量筒各一个;分析天平一个;托盘天平一个。
2.试剂:I2标准溶液(0.05mol·L-1);Na2S2O3标准溶液(0.01mol·L-1);淀粉溶液(5.0g·L-1);醋酸(2mol·L-1);维生素C片剂。
四、实验步骤1. I2溶液的标定用移液管移取25.00 mL Na2S2O3标准溶液于250 mL锥形瓶中,加50 mL蒸馏水,5mL0.2%淀粉溶液,然后用I2溶液滴定至溶液呈浅蓝色,30 s内不褪色即为终点。
平行标定三份,计算I2溶液的浓度。
2. 维生素C片剂中VC含量的测定准确称取约0.2 g研碎了的维生素C药片,置于250 mL锥形瓶中,加入100 mL新煮沸过并冷却的蒸馏水,10 mL2 mol·L-1 HAc溶液和5 mL0.2%淀粉溶液,立即用I2标准溶液滴定至出现稳定的浅蓝色,且在30 s内不褪色即为终点,记下消耗的I2溶液体积。
直接碘量法测定绿茶中维生素C含量黄素梅(广西师范大学化学化工学院,桂林541004)摘要本文采用直接碘量法测定绿茶中维生素C的含量。
绿茶经草酸提取后,用I标准溶液直接滴定。
实2验结果表明:绿茶中维生素C的含量为25.20mg/10g。
采用直接碘量法测定绿茶中的维生素C含量,操作简便,快速。
关键词直接碘量法;绿茶;维生素C绿茶中含有丰富的维生素,其中以维生素C的含量最高,维生素C可作为衡量绿茶品质的一个重要生化指标。
一般绿茶中维生素C含量可达(100mg~250mg)/100g,高级龙井【】1茶(绿茶中的绝品)中的维生素C含量可达360mg/100g。
关于茶叶维生素的研究文献很少,仅20余篇,涉及茶叶维生素分析方法的文献只有10【】1余篇,其中涉及高效液相色谱法,分光光度法,荧光法,但据我了解,未涉及直接碘量法。
本文采用直接碘量法测定绿茶中维生素C的含量,操作简便,快速。
1 原理维生素C(Vc)属于水溶性维生素,它的分子式为CHO,由于分子中的烯二醇基具686有还原性,能被I定量地氧化成二酮基: 21mol维生素C与1mol I定量反应,维生素C的摩尔质量为176.12g/mol。
当溶液中有2淀粉存在,过量的碘遇淀粉变蓝色,指示滴定终点。
由于维生素C的还原性很强,在空气中极易被氧化,尤其是在碱性介质中,测定时采用草酸溶液提取绿茶中的维生素C,使样液呈弱酸性,减少维生素C的副反应。
2 仪器与试剂2.1 仪器碱式滴定管;25mL移液管2.2 试剂 0.05mol/L草酸溶液;0.01mol/LI标准溶液;1%淀粉溶液;绿茶:市售立顿绿2茶3 实验部分3.1 维生素C 提取液的制备准确称取10g绿茶,加入适量0.05mol/L草酸溶液,充分振荡4-5分钟。
过滤,洗涤,滤液转入250mL容量瓶中,用0.05mol/L草酸溶液定容至250mL。
3.2 用直接碘量法滴定绿茶中的维生素C用25mL移液管移取上述提取液于250mL锥形瓶中,加入1 mL淀粉溶液后,立即用0.01mol/LI标准溶液滴定至溶液变色,且30s内不退色,即为滴定终点。