(清晰版)2020备战中考专题复习(专题六:原子结构及元素)
- 格式:doc
- 大小:169.00 KB
- 文档页数:6

2020-2021全国各地备战高考化学分类:原子结构与元素周期表综合题汇编及详细答案一、原子结构与元素周期表练习题(含详细答案解析)1.下表为元素周期表的一部分,请参照元素①~⑨在表中的位置,回答下列问题。
(1)第三周期元素中非金属性最强的元素的原子结构示意图是___。
(2)②③⑦最高价氧化物对应水化物的酸性由强到弱的顺序是___(填化学式)。
(3)下列可以判断⑤和⑥金属性强弱的是___(填序号)。
a.单质的熔点:⑤<⑥b.化合价:⑤<⑥c.单质与水反应的剧烈程度:⑤>⑥d.最高价氧化物对应水化物的碱性:⑤>⑥(4)为验证第ⅦA族部分元素非金属性的递变规律,设计如图装置进行实验,请回答:①仪器A的名称是___,A中发生反应的离子方程式是___。
②棉花中浸有NaOH溶液的作用是___(用离子方程式表示)。
③验证溴与碘的非金属性强弱:通入少量⑨的单质,充分反应后,将A中液体滴入试管内,取下试管,充分振荡、静置,可观察到___。
该实验必须控制⑨单质的加入量,否则得不出溴的非金属性比碘强的结论。
理由是___。
④第ⅦA族元素非金属性随元素核电荷数的增加而逐渐减弱的原因:同主族元素从上到下原子半径逐渐_____(填“增大”或“减小”),得电子能力逐渐减弱。
【答案】 HNO3>H2CO3>H2SiO3 cd 分液漏斗 2Br-+Cl2=Br2+2Cl- Cl2+2OH-=H2O+Cl-+ClO-溶液分层,下层液体为紫红色氯气能够氧化溴离子和碘离子,氯气必须少量,否则干扰检验结果增大【解析】【分析】由元素在周期表的位置可知,元素①~⑨分别为H、C、N、O、Na、Al、Si、S、Cl,结合元素周期律和物质的性质分析解答。
【详解】(1)第三周期元素中非金属性最强的元素是Cl,其原子结构示意图是;(2)元素非金属性越强,其最高价氧化物对应水化物的酸性越强,则②③⑦最高价氧化物对应水化物的酸性由强到弱的顺序是HNO3>H2CO3>H2SiO3;(3)a.根据单质的熔点不能判断金属性强弱,故a错误;b.化合价高低不能作为比较金属性的依据,故b错误;c.Na与水反应比Al剧烈,说明金属性:Na>Al,可以比较,故c正确;d.元素的金属性越强,最高价氧化物对应水化物的碱性越强,可以比较,故d正确;答案选cd;(4)①A为分液漏斗,A中发生氯气与NaBr的氧化还原反应,离子方程式为2Br-+Cl2=Br2+2Cl-;②NaOH溶液用于吸收氯气,离子方程为Cl2+2OH-=H2O+Cl-+ClO-;③溴与KI反应生成碘单质,碘单质易溶于四氯化碳。

中考化学重点考点原子结构示意图
(1)2个氮原子2N.
(2)铵根离子NH+4.
(3)地壳中含量最多的金属元素Al.
(4)1个硫酸分子H2SO4.
(5)从结构示意图判断原子、离子(选填大于、小于或等于)的大小关系:
原子:质子数(核电荷数)等于核外电子数
阳离子:质子数(核电荷数)大于核外电子数
阴离子:质子数(核电荷数)小于核外电子数.
考点:化学符号及其周围数字的意义;原子结构示意图与离子结构示意图.
专题:化学用语和质量守恒定律.
分析:(1)根据原子的表示方法进行分析;
(2)根据离子的表示方法进行分析;
(3)地壳中含量最多的金属元素是铝;
(4)根据分子的表示方法分析;
(5)根据粒子中质子数和核外电子数的关系进行分析.
解答:解:(1)由原子的表示方法,用元素符号来表示一个原子,表示多个该原子,就在其元素符号前加上相应的数字,故两个氮原子表示为:2N.
(2)由离子的表示方法,在表示该离子的元素符号右上角,
标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略.若表示多个该离子,就在其离子符号前加上相应的数字,故铵根离子表示为:
NH+4.
(3)地壳中含量最多的金属元素是铝,其元素符号为:Al;
(4)由分子的表示方法,正确书写物质的化学式,表示多个该分子,就在其化学式前加上相应的数字,则一个硫酸分子可表示为:H2SO4.
(5)根据不同粒子中质子数与核外电子数的关系,原子显中性,故质子数等于核外电子数;阳离子是失到核外电子所致,故质子数大于核外电子数;阴离子是获得核外电子,故质子数小于核外电子数.
相关推荐
中考化学重点知识考点:单质碳化学性质
中考化学重点知识考点:化学式的三种意义。

初中化学《原子结构及元素》中考典型试题专题复习梳理汇编1.【北京市中考试题】下列属于非金属元素的是A.Mg B.Zn C.Cl D.Ag2.【江苏省南京市中考试题】“加碘盐”中的“碘”是指A.分子B.原子C.单质D.元素3.【吉林省中考试题】是“国际化学元素周期表年”,编制元素周期表的俄国科学家是A.侯德榜B.屠呦呦C.门捷列夫D.拉瓦锡4.【海南省中考试题】如图为元素周期表第四周期的局部。
下列有关说法正确的是A.砷和硒均属于金属元素B.锗元素的相对原子质量x小于69.72C.镓原子的核电荷数为31D.Se2+的核外电子数为345.【云南省昆明市中考试题】氟元素与硅元素最本质的区别是A.相对原子质量不同B.中子数不同C.中子数与核外电子数之和不同D.质子数不同6.【河南省中考试题】稀土元素镝(Dy)常用于制造硬盘驱动器。
下列有关说法中不正确的是A.镝属于非金属元素B.镝原子的质子数为66C.镝的相对原子质量为162.5D.稀土资源需合理利用和保护7.【广东省深圳市中考试题】钪(Kc)是一种“工业的维生素”。
图为钪在元素周期表中的相关信息及其原子的结构示意图。
下列说法正确的是A.钪属于非金属元素B.钪的相对原子质量是21C.原子结构示意图中x=10D.钪原子核外有四个电子层8.【安徽省中考试题】我国科学家最新研制出一种新型石墨烯﹣铝电池,手机使用这种电池,充电时间短,待机时间长。
碳、铝元素的相关信息如图,有关说法正确的是A.它们的化学性质相同B.碳在地壳中含量最高C.铝的原子序数为13D.铝的相对原子质量为26.98 g9.【江西省中考试题】考古学家通过测定碳14的含量等方法将人类生活在黄土高原的历史推前至距今212万年。
碳14原子的核电荷数为6,相对原子质量为14,则该原子核外电子数为A.6B.8C.14D.2010.【山西省中考试题】我国“高分5号”卫星天线是用钛镍形状记忆合金制成的。
如图为镍的原子结构示意图,关于该原子的叙述错误的一项是A.它的核电荷数为28B.它有4个电子层C.它的质子数大于核外电子数D.它易失电子【答案】C11.【天津市中考试题】下列说法正确的是A.地壳中含量最多的元素是氧B.海洋中含量最多的元素是氯C.空气中含量最多的元素是碳D.人体中含量最多的元素是钙12.【云南省中考试题】下列粒子结构示意图,表示阴离子的是A.B.C.D.13.【江苏省南京市中考试题】下列原子结构示意图中,表示相对稳定结构的是A.B.C.D.14.【江苏省苏州市中考试题】下列说法正确的是A.原子的质量主要集中在原子核上B.相同的原子无法构成不同的分子C.温度计内汞柱液面上升说明汞原子体积变大D.原子呈电中性是因为原子中质子数与中子数相等15.【云南省昆明市中考试题】是门捷列夫发表元素周期表150周年。
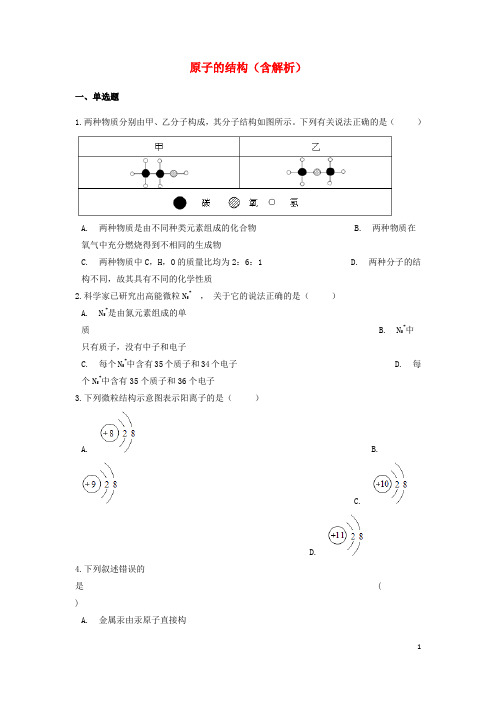
原子的结构(含解析)一、单选题1.两种物质分别由甲、乙分子构成,其分子结构如图所示。
下列有关说法正确的是()A. 两种物质是由不同种类元素组成的化合物B. 两种物质在氧气中充分燃烧得到不相同的生成物C. 两种物质中C,H,O的质量比均为2:6:1D. 两种分子的结构不同,故其具有不同的化学性质2.科学家已研究出高能微粒N5+,关于它的说法正确的是()A. N5+是由氮元素组成的单质 B. N5+中只有质子,没有中子和电子C. 每个N5+中含有35个质子和34个电子D. 每个N5+中含有35个质子和36个电子3.下列微粒结构示意图表示阳离子的是()A. B.C.D.4.下列叙述错误的是 ()A. 金属汞由汞原子直接构成 B.原子核由电子和质子构成C. 水分子保持水的化学性质 D.化学变化中原子不能再分5.已知某粒子的结构示意图是,则该粒子是:()A. 阳离子 B. 阴离子 C. 原子 D. 原子核6.如图是“尾气催化转换器”将汽车尾气中有毒气体转变为无毒气体的微观示意图,其中不同的圆球代表不同原子.下列说法错误的是()A. 此反应有单质生成B. 参加反应的两种分子的个数比为1:1C. 原子在化学变化中没有分裂 D. 图中生成物全部是化合物7.下列关于原子的说法,正确的是()A.B.C.D.8.黑白小圈分别表示不同的原子,下图所表示的物质是( )A. 两种元素组成的化合物B. 两种元素组成的纯净物C. 由7种物质分子构成的混合物 D. 由5种物质分子构成的混合物9.下列属于化合物的是( )A. B.C. D.10.下列粒子结构示意图中,表示阳离子的是()A. B.C.D.11.下图为某反应的微观示意图,不同的球代表不同元素的原子。
下列说法中错误的是()A. 该反应的反应物可能属于氧化物B. 不考虑反应条件时,该图示可以表示双氧水制取氧气的反应C. 该反应类型为分解反应D. 该反应的生成物都属于化合物12.牙膏中的含氟化合物对牙齿有保护作用。

专题06 原子核外电子排布及离子1.【吉林省长春市净月高新区2019届九年级毕业班模拟】下表为元素周期表中某一周期元素的原子结构示意图,请回答下列问题:(1)表中磷原子的核电荷数x=_________;(2)表中具有相对稳定结构的元素是__________;(3)镁元素与氯元素形成的化合物化学式为___________.(4)在这一周期元素里,所有原子都有______个电子层,并且自左至右原子的最外层电子数依次_____. 【答案】15 Ar MgCl2 3 增大【解析】(1)元素周期表中每一周期的元素的原子的核电荷数依次增大,因此磷原子的核电荷数为15;(2)根据微粒最外层达到8个电子(最外层是第一层时为2)的是稳定结构可知,表中具有相对稳定结构的元素是氩(Ar);(3)镁元素在化学反应中失去两个电子,一般化合价为+2价,氯元素在化学反应中得到1个电子,一般化合价为-1价,因此镁元素与氯元素形成的化合物化学式为MgCl2;(4)原子结构示意图中原子核外的弧线表示电子层,因此在这一周期元素里,所有原子都有3个电子层,并且自左至右原子的最外层电子数依次增大。
2.【江苏省苏州市区2019届九年级中考化学一模】下表为部分元素的粒子结构示意图。
请回答下列问题:(1)若氯原子最外层得到一个电子,其微粒符号为_______;(2)表中具有相对稳定结构的原子是_______ (填元素符号);(3)根据表中信息,确定一个硫化氢分子中所含电子总数为_______;(4)将氮元素与铝元素形成的化合物放入水中,立即生成白色沉淀氢氧化铝,并放出一种有刺激性气味的气体。
此反应的化学方程式为_______。
【答案】Cl-He 18 AlN+3H2O=Al(OH)3↓+NH3↑【解析】(1)氯原子得到一个电子而形成带有1个单位负电荷的氯离子Cl-;(2)最外层电子数为8(氦为2个),则属于相对稳定结构,图中B的最外层电子数为2,且质子数=电子数,属于相对稳定结构的原子,符号为:He;(3)一个硫化氢分子是由2个氢原子和1个硫原子构成的,每个氢原子中有1个电子,每个硫原子中有16个电子,所以每个硫化氢分子中含有:1×2+16=18个电子;(4)氮原子的最外层有5个电子,在化学反应中易得到3个电子而显-3价;铝原子最外层有3个电子,在化学反应中易失去3个电子而显+3价,所以氮元素与铝元素组成化合物的化学式为AlN,与水反应生成氢氧化铝沉淀和氨气;反应的化学方程式为:AlN+3H2O=Al(OH)3↓+NH3↑。

备战2020中考化学考题专项训练——微观示意图1.(2019平凉)宏观、微观、符号相结合是化学学科特有的思维方式。
工业上常将煤洗选加工后用于制备水煤气,其主要反应的微观示意图如下:的是下列说法不正确...A.物质C是由碳、氧两种元素组成的;B.该反应前后原子的种类没有发生变化C.该反应前后各元素化合价都没有变化D.该反应的化学方程式为C+H2O高温CO+H22.(2019东营)“宏观﹣微观﹣符号”三重表征是化学独特的表示物质及其变化的方法。
某化学反应的微观示意图如图所示,下列说法不正确的是()A.从反应价值看:该反应能获取清洁能源,延缓温室效应B.从物质分类看:该反应涉及到2种氧化物C.从微观构成看:四种物质均由分子构成D.从表示方法看:该反应的化学方程式为2CO2+4H2O2CH4+4O23.(2019永州)甲烷燃烧的微观示意图如下,其中方框中需要补充的是4.(2019毕节)右图是汽车“尾气催化转换器”将尾气中有毒气体转变为无毒气体的微观示意图,其中不同的圆球代表不同原子。
下列说法错误的是A.此反应中有单质生成B.原子在化学变化中是不可分的C. 极易与人体血液中的血红蛋白结合D.参加反应的与个数比为2:35.(2019本溪)下列各斟中“”和“○”分别表示不同元素的原子,其中表示混合物的是6.(2019益阳)某化学反应的微观示意图如图所示,其中相同的球代表同种原子。
(1)该化学反应中,发生变化的是(选填“分子”或“原子”),参加反应的两种分子的个数比为。
(2)该反应的生成物是(选择序号填空)。
A.化合物B.单质C.混合物(3)该反应的微观示意图说明,化学反应遵守质量守恒定律的原因是。
7.(2019眉山)天然气可以在一定条件下合成甲醇,其微观过程如图所示:回答下列问题:(1)把如图反应物的微观示意图补画齐全。
(2)该反应的化学方程式为,基本反应类型为。
8.(2019兰州)类价二维图反映的是元素的化合价与物质类别之间的关系,构建类价二维图是化学学习的重要方法。
初中化学原子结构知识点详解图文初中化学原子结构知识点详解化学是一门研究物质的性质、组成和变化的科学。
在化学中,原子结构是一个重要的概念,它是理解物质性质和化学反应的基础。
本文将从原子的基本构成,电子排布及其能级结构,以及元素周期表的组成等方面详细介绍化学原子结构的知识点。
一、原子的基本构成原子是物质的基本单位,由带正电荷的质子、无电荷的中子以及带负电荷的电子组成。
质子和中子集中在原子核内,而电子则绕着原子核运动。
质子是带有正电荷的基本粒子,其电荷数目与电子相等,质子的质量大约为1个质子质量单位(am),常用符号为p+。
中子是无电荷的基本粒子,其质量与质子相似,中子的质量也约为1个质子质量单位,常用符号为n。
电子是带有负电荷的基本粒子,其电荷数目与质子相等,但质量约为质子和中子的1/1836,常用符号为e-。
二、电子排布及其能级结构电子的排布遵循一定的规则,主要体现在电子的层、壳和轨道的概念上。
1. 层和壳层是指离原子核越远的区域,以K、L、M、N等字母表示。
其中K层离原子核最近,L层次之,以此类推。
壳是指由电子占据的层,每个层可以容纳一定数量的电子。
具体来说,K层最多容纳2个电子,L层最多容纳8个电子,M层最多容纳18个电子,N层最多容纳32个电子。
2. 轨道轨道是指电子在原子中运动的区域,每个层包含多个轨道。
根据轨道的形状和能级不同,可分为s轨道、p轨道、d轨道和f轨道。
s轨道为最简单的轨道,只能容纳2个电子。
p轨道则能容纳6个电子,分为px、py和pz三个方向。
d轨道能容纳10个电子,有5个不同的空间方向。
f轨道能容纳14个电子,有7个不同的空间方向。
3. 能级结构在原子中,每个层都有不同的能级。
能级越高,所含电子的能量越大。
每个能级分为多个轨道,电子按照一定的规则填充进入轨道。
兼顾电子的能量最低和电子排布的稳定性原则,电子填充原则有次序为:1s、2s、2p、3s、3p、4s、3d、4p等。
备战2020中考化学经典题练——专题三十六:物质构成的奥秘考点一:原子的结构1.下列说法不正确的是A.利用元素周期表,可查阅元素符号B.分子可以构成物质,但物质不一定由分子构成C.汤姆森发现了电子,证实原子是可分的D.利用相对原子质量表,可直接查出某种元素一个原子的实际质量2.根据化学基本概念和原理的知识,你认为下列叙述正确的是()A.原子是不能再分的最小粒子B.同种元素的原子,不一定具有相同的质子数C.混合物中不可能只含有一种元素D.元素的化学性质跟原子的最外层电子数关系非常密切3.不同元素的原子,在①中子数;②质子数;③电子总数;④电子层数;⑤最外层电子数;⑥核电荷数中肯定不相同的是A.①②③④B.②③⑥4.在某粒子失去电子后的分析判断中,正确的是A.一定带正电B,可能带正电C. 一定带负电D,不可能带负电5.对以下四种粒子的结构示意图,分析错误的是C.②④⑥D.②⑥① ② ③A.①②属于同一种元素C.①得到电子可形成③B.①④的化学性质相似D.②③表示不同种离子6.已知R元素的相对原子质量彳与其原子核内的质子数和中子数之和在数值上相等。
若R2 +核外有x个电子,则其原子核内的中子数为()A. A—x+2B. _4+x+27.在下列微粒中C. A—x—2D. A-\-x—2①分子;②原子;③质子;④中子;⑤电子;⑥离子⑴能构成物质的微粒有;(2)显示电中性的微粒有(3)质量最小的微粒是_____________ ;(4)一定带正电荷的微粒有(5)—定带负电荷的微粒有; (6)可能带正电荷也可能带负电荷的是___________考点二:物质的构成1.下列物质由分子构成的是()A.铁B.干冰2.如图实验不能说明的是( )C.氯化钠D.金刚石A.分子很小B.分子不停地运动C.构成物质的微粒不同,性质不同D.化学反应的实质是分子破裂为原子,原子重新结合成新分子3.下列现象中,能充分说明“分子在不停的运动"的是()A.春天,冰雪开始融化B.气体热胀冷缩C.真金不怕火烧D.墙内开花墙外香4.座式酒精喷灯的火焰温度可达1000°C以上,使用时,向预热盘中注入酒精(C2H5OH)并点燃,待灯壶内酒精受热汽化从喷口喷出时,预热盘内燃着的火焰就会将喷出的酒精蒸气点燃。
备战2020中考化学仿真模拟必刷卷03化学(考试时间:75分钟试卷满分:100分)相对原子质量:H:1 C:12 O:16 Na:23 Cl:35.5 Ca:40一、选择题:本大题共20小题,每小题2分,共40分。
每题只有一个选项符合题目要求。
1.空气中氧气的体积分数约是()A.28%B.21%C.0.94%D.0.03%【答案】B【解析】空气的成分按体积计算,大约是:氮气占78%、氧气占21%、稀有气体占0.94%、二氧化碳占0.03%、其它气体和杂质占0.03%.由此可知,B正确;选B。
2.“展国威、扬军威”的国庆70周年阅兵活动中,下列现象一定发生化学变化的是()A.挥舞国旗B.鸣放礼炮C.放飞气球D.张贴标语【答案】B【解析】A、挥舞国旗是利用气体的加速流动使国旗飘扬,为物理变化,A选项错误;B、鸣放礼炮伴随着燃烧与爆炸,燃烧与爆炸属于化学变化,B选项正确;C、放飞气球是利用氦气的密度小于空气得以升空,是物理性质,C选项错误;D、张贴标语是利用粘合剂具有粘性达到目的,是物理变化,D选项错误;故选B3.下列属于纯净物的是()A.自来水B.液氧C.碳酸饮料D.加热高锰酸钾后残留固体【答案】B【解析】A、自来水中含有水和消毒剂等物质,属于混合物,故A错;B、液氧是由氧分子一种分子构成,属于纯净物,故B正确;C、碳酸饮料中含有水、碳酸、其它添加剂,属于混合物,故C错;D、加热高锰酸钾后残留固体中含有锰酸钾、二氧化锰,属于混合物,故D错。
选B。
4.交警用装有重铬酸钾(K2Cr2O7)的仪器检测司机是否酒后驾车,酒中的乙醇分子可以使橙红色重铬酸钾变为绿色硫酸铬,重铬酸钾(K2Cr2O7)中铬元素的化合价是()A.+3B.+5C.+6D.+7【解析】钾元素显+1价,氧元素显﹣2价,设铬元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(+1)×2+2x+(﹣2)×7=0,则x=+6价。
高中化学-原子结构与元素周期表基础复习work Information Technology Company.2020YEAR原子结构与元素周期表基础复习姓名班级1、质量数= + 。
原子中:核电荷数质子数核外电子数阳离子中:核电荷数质子数核外电子数阴离子中:核电荷数质子数核外电子数2、具有相同质子数(核电荷数)的同一类原子总称为。
同种元素的原子的质子数相同,中子数。
人们把具有一定数目质子数和中子数的一种原子称为,它们的关系是。
3、最外层电子数为1的原子是;最外层电子数为2的原子是;最外层电子数为与次外层电子数相等的原子是;最外层电子数为是次外层电子数2倍的原子是;最外层电子数为是次外层电子数3倍的原子是;最外层电子数为是次外层电子数4倍的原子是;4、元素周期律同周期(左---右)同主族(上---下)变化核电荷数;;电子层数;;原子半径;;最高正价;;最低负价;;元素的金属性;;元素的非金属性;;最高价氧化物对应的水化物的碱性;;高价氧化物对应的水化物的酸性;;氢化物的热稳定性;;氢化物的还原性;;例1 下列有关元素周期律的叙述中,正确的是()A.氧化性强弱:F2<Cl2 B.金属性强弱:K<NaC.酸性强弱:H3PO4<H2SO4 D.碱性强弱:NaOH<Mg(OH)223例2 已知同周期X 、Y 、Z 三种元素的最高价氧化物对应水化物酸性由强到弱的顺序为HXO 4>H 2YO 4>H 3ZO 4,则下列判断中正确的是( )A .元素非金属性按X 、Y 、Z 的顺序减弱B .阴离子的还原性按X 、Y 、Z 的顺序减弱C .气态氢化物的稳定性按X 、Y 、Z 的顺序增强D .单质的氧化性按X 、Y 、Z 的顺序增强例3 下列各组元素性质递变情况错误..的是( ) A .Li 、Be 、B 原子最外层电子数逐渐增多 B .N 、O 、F 原子半径依次增大C .P 、S 、Cl 最高正价依次升高D .Li 、Na 、K 、Rb 的金属性依次增强5、简单离子半径的比较(1)电子层结构相同(电子层数和各层上的电子数都相同)的离子,核电荷数越大离子半径越小(2)同主族元素的离子(带相同电荷的离子),电子层数越多,离子半径越大(3)同种元素的原子,离子,电子数越少的半径越小例4 根据元素在周期表中的位置判断,下列元素中原子半径最小的是( )A .氧B .氟C .碳D . 氮【练习】1.X 元素最高氧化物对应的水化物为H 3XO 4,则它对应的气态氢化物为( )A .HXB .H 2XC .XH 4D . XH 32.下列关于32He 的说法正确的是( )A .32He 原子核内含有2个中子 B .3 2He 原子核内含有3个质子C .32He 原子核外有3个电子 D .3 2He 和4 2He 是两种不同的核素3.X 、Y 、Z 为短周期元素,这些元素原子的最外层电子数分别为1、4、6,则由这三种元素组成的化合物的化学式可能是( )A .XYZB .X 3YZC .XYZ 2D .X 2YZ 34.下列关于元素周期表的说法正确的是( )A.能生成碱的金属元素都在ⅠA族B.原子序数为14的元素位于元素周期表的第3周期ⅣA族C.稀有气体元素原子的最外层电子数均为8D.第二周期ⅣA族元素的原子核电荷数和中子数一定为64。
2020备战中考化学专题复习
专题六:原子结构及元素
一、选择题
1.【2018年四川省成都市】钕玻璃是激光聚变装置的核心元件。
根据元素周期表中钕的信息判断错误的是()
A.属于金属元素
B.质子数为60
C.中子数为60
D.相对原子质量是144.2
2.【2018年湖北省咸宁市】1869年发现了元素周期律并编制出元素周期表的科学家是()
A.道尔顿
B.阿伏加德罗
C.门捷列夫
D.侯德榜
3.【2018年湖南省岳阳市】地壳中含量最多的元素是()
A.Si
B.Al
C.O
D.Fe
4.【2018年江苏省南京市】北京大学生命科学学院蒋争凡教授研究组发现,锰离子是细胞内天然免疫激活剂和警报素。
在元素周期表中锰元素的某些信息如图所示,下列有关锰的说法不正确的是()
A.原子序数为25
B.属于金属元素
C.原子核内质子数为25
D.相对原子质量为54.94g
5.【2018年山东省泰安市】如图是五种粒子的结构示意图,下列说法正确的是()
A.①②属于同种元素
B.③⑤化学性质相似
C.②③④均表示离子
D.②④形成的化合物是MgCl
6.【2018年山东省泰安市】全球近140个国家将根据签署的《国际防治汞污染公约》,在2020 年前禁止生产和出口含汞产品,如电池、荧光灯、化妆品、温度计、血压计等。
汞元素部分
信息如图所示,下列说法不正确的是()
A.汞为非金属元素
B.汞原子的核外电子数是80
C.汞原子的质子数为80
D.汞的相对原子质量为200.6
7.【2018年山东省青岛市】根据图中提供的
信息判断,下列说法正确的是()
A.③④属于同种元素
B.②表示的元素在形成化合物时化合价为+1价
C.①③的化学性质相似
D.硒元素的相对原子质量为78.96g
8.【2018年山东省青岛市】动物的肝脏和坚果类食物中含有丰富的铁和锌,这里的“铁”和“锌”是指()
A.分子
B.元素
C.原子
D.单质
9.【2018年山东省聊城市】如图所示,甲是溴(Br)的原子结构示意图,乙摘自元素周期表。
下列说法正确的是()
A.甲元素属于金属元素
B.甲、乙两种元素形成化合物的化学式是NaBr
C.乙原子的核内中子数为11
D.甲原子核外共有5个电子层
10.【2018年山东省临沂市】市场上有“葡萄糖酸锌”、“高钙牛奶”、“绿色碘盐”等商品,这里的“锌、钙、碘”指的是()
A.元素
B.分子
C.单质
D.原子11.【2018年山东省临沂市】下图为某粒子结构示意图,下列说法错误的是()
A.该元素属于非金属元素
B.该元素位于元素周期表第三横行
C.该粒子核外电子数是17
D.在化学反应中,该元素原子易得电子形成Cl-
12.【2018年山东省德州市】近日,中国在四川某地发现了一个超大规模的锂矿,储量高达52万吨,被称之为“中国锂谷”。
锂矿是重要的国家战略资源,有着21世纪改变世界格局的“白色石油”和“绿色能源金属”之称。
下图是锂原子结构示意图和锂元素在元素周期表中的相关信息。
下列说法正确的是()
A.锂元素属于非金属元素
B.锂原子在化学反应中易得电子
C.锂原子的相对原子质最是6.94lg
D.锂原子核内有3个质子
13.【2018年湖北省随州市】下图是元素周期表中提供的碘元素部分信息及碘原子结构示意图。
下列说法错误的是()
A.碘单质(I2)是由碘原子直接构成的
B.碘的相对原子质量为127,原子核内质子数为53
C.碘原子核外共有53个电子,最外层有7个电子
D.碘元素属于非金属元素,碘原子在化学反应中容易得到电子
14.【2018年湖南省岳阳市】硒是人体必需的一种微量元素,严重缺硒可能诱发皮肤病和癌症。
硒的原子结构示意图及其在元素周期表中的某些信息如图所示,下列分析正确的是()
A.硒属于金属元素
B.硒的相对原子质量为78.96g
C.硒原子的核电荷数为34
D.硒原子的核外有6个电子
15.【2018年湖北省咸宁市】稀土是一种重要的战略资源。
铈是一种常见的稀土元素,下列有关铈的说法正确的是()
A.铈属于非金属元素
B.铈原子的中子数是58
C.铈原子的核外电子数是58
D.铈原子的相对原子质量是140.1g
16.【2018年安徽省】硼是作物生长必需的微量营养元素,硼元素的相关信息如图所示。
下列有关硼的说法正确的是()
A.相对原子质量为10.81g
B.属于金属元素
C.原子的核电荷数为5
D.原子核外有6个电子
17.【2018年广州市】下图为某粒子的结构示意图,下列说法正确的是()
A.该粒子有12个质子
B.该粒子有2个电子层
C.该粒子属于非金属元素
D.该粒子已达到相对稳定结构
18.【2018年安徽省】归纳法是学习化学的重要方法之一,下列图示正确的是()
二、非选择题
19.【2018年四川省乐山市】元素周期表是学习和研究化学的重要工具。
下面是元素周期表的部分信息:
认真分析信息,回答:
(1)地壳中含量最多的元素的原子序数是_______;
(2)分析上表规律,可推知,表中X=________;
(3)表示的是(写粒子符号)__________;
(4)写出一个由1、7、8、16号四种元素组成的化合物的化学式_____________。
20.【2018年四川省达州市】图甲是铝元素在元素周期表中的相关信息,图乙是几种微粒的
结构示意图,仔细分析答题:
(1)图甲中,铝元素的信息有处错误,请加以改正_______;
(2)铝原子的相对原子质量_______;
(3)图乙中,属于稳定结构的原子是 (填序号,下同);
(4)图乙中,与铝不属于同一周期元素的是_________。
21.【2018年四川省巴中市】根据下列粒子结构示意图,回答问题:
(1)A、B、C、D所示粒子共表示________种元素。
(2)D所示粒子在化学反应中容易__________(选填“得到”或“失去”)电子。
22.【2018年山东省济宁市】镓是一种奇妙的金属,放在手心马上熔化,犹如荷叶上的水珠流来流去。
请阅读信息后回答:
(1)金属镓 (填物理性质);
(2)镓原子结构示意图中X的数值_______;
(3)镓的氧化物的化学式________;
(4)氮化镓(GaN)是第三代半导体材料,一般采用GaCl3与NH3在一定条件下反应制得,同时得到另一种化合物。
该反应的化学方程式为。
23.【2018年广东省】“下图”是部分元素的离子结构示意图和元素周期表的一部分。
请回答:
(1)图①、②中属于阴离子的是 (填序号),该元素的质子数为_____;13号元素原子的最外层电子数为_____。
(2)由表中原子序数为1、8、13的元素组成物质的化学式为。