(苏教版)2020高考总复习 化学:专题5 第1讲 原子结构 化学键
- 格式:ppt
- 大小:4.20 MB
- 文档页数:55

物质结构元素周期律第1讲原子结构化学键复习目标知识建构1.了解元素、核素和同位素的含义。
2.了解原子的构成,了解原子序数、核电荷数、质子数、中子数、核外电子数以及它们之间的相互关系。
3.了解原子核外电子排布规律,掌握原子结构示意图、电子式、结构式的表示方法。
4.了解化学键的定义,了解离子键、共价键的形成。
5.了解相对原子质量、相对分子质量的定义,并能进行有关计算。
一、原子结构、核素和同位素1.原子的构成微粒及作用2.原子构成微粒间的关系(1)质量关系:质量数(A)=质子数(Z)+中子数(N);(2)电性关系:①原子中:质子数(Z)=核电荷数=核外电子数;②阳离子的核外电子数=质子数-阳离子所带的电荷数;③阴离子的核外电子数=质子数+阴离子所带的电荷数。
(3)微粒符号周围数字的含义3.元素、核素、同位素(1)元素、核素、同位素的概念及相互关系(2)氢元素的三种核素1H:名称为氕,不含中子;12H:用字母D表示,名称为氘或重氢;13H:用字母T表示,名称为氚或超重氢。
1(3)几种重要核素的用途核素235 92U 14 6C 21H 31H 18 8O用途核燃料用于考制氢弹示踪古断代原子4.相对原子质量(1)原子(即核素)的相对原子质量:一个原子(即核素)的质量与一个12C质量的1 12的比值。
一种元素有几种同位素,就有几种不同核素的相对原子质量。
(2)元素的相对原子质量:是按该元素各种天然同位素原子所占的原子百分比算出的平均值。
如:A r(Cl)=A r(35Cl)×a%+A r(37Cl)×b%。
(3)核素的近似相对原子质量=该核素的质量数。
【判一判】判断下列说法是否正确,正确的打“√”,错误的打“×”。
(1)任何原子的原子核均有质子和中子,任何离子均有电子()(2)一种元素可以有多种核素,也可能只有一种核素,有多少种核素就有多少种原子()(3)中子数不同而质子数相同的微粒一定互为同位素()(4)3517Cl与3717Cl得电子能力几乎相同()(5)H2、D2、HD均为氢元素的不同单质,三者属于同素异形体()(6)2H+的核外电子数为2()答案(1)×(2)√(3)×(4)√(5)×(6)×二、原子核外电子排布1.核外电子排布规律2.原子结构示意图3.元素的性质与原子的核外电子排布的关系元素结构与性质稀有气体元素金属元素非金属元素最外层电子数8(He为2) 一般小于4 一般大于或等于4 稳定性稳定不稳定不稳定得失电子能力既不易得电子,也不易失电子易失电子易得电子化合价0 只显正价既显正价,又显负价(F、O无正价) 【判一判】判断下列说法是否正确,正确的打“√”,错误的打“×”。

2020版高考化学一轮复习专题一第五讲原子结构化学键讲义(含解析)原子结构化学键[江苏考纲要求] 1.理解元素、核素和同位素的含义。
2.了解原子的构成。
知道原子序数、核电荷数、质子数、中子数、核外电子数以及它们之间的数量关系。
3.掌握1~18号元素的原子核外电子排布,能用原子结构示意图表示原子和简单离子的结构。
4.知道化学键的定义。
能用电子式、结构式和结构简式等表示一些常见物质的结构。
原子结构同位素5.能识别典型的离子化合物和共价化合物,能从化学键变化的角度认识化学反应的实质。
[教材基础自热身] 1.原子的构成2.原子结构中的微粒关系1原子2离子的核外电子数核外电子数3.同位素核素1概念辨析2同位素的特征①同一元素的各核素,化学性质几乎完全相同,物理性质不同。
②天然存在的同一元素各核素所占的原子个数百分数一般不变。
3同位素的“六同三不同” 4常见的重要核素及其应用核素U C H H O 用途核燃料用于考古断代制氢弹示踪原子4.同位素、同素异形体、同分异构体、同系物同位素同素异形体同分异构体同系物概念质子数相同,中子数不同的同一种元素的不同原子之间互为同位素同种元素组成的结构不同的单质之间互为同素异形体分子式相同,结构不同的化合物互为同分异构体结构相似,在分子组成上相差一个或若干个CH2原子团的物质互称同系物对象原子之间单质之间一般为有机化合物之间有机化合物之间化学性质几乎完全相同相似,一定条件下可以相互转变可能相似也可能不同相似实例H、H、H 金刚石与石墨、C60;红磷与白磷CH3COOH 与HCOOCH3 甲烷、乙烷、丙烷;乙烯、丙烯;甲酸、乙酸[知能深化扫盲点] 提能点一原子结构中各粒子数目的关系辨析1任何粒子中,质量数=质子数+中子数,但质子数与电子数不一定相等,如阴、阳离子。
2有质子的粒子不一定有中子,如H;有质子的粒子不一定有电子,如H+。
3质子数相同的粒子不一定属于同一种元素,如F-与OH-。



苏教版高考化学知识点总结化学作为一门自然科学学科,涉及的知识点繁多且复杂。
在高考中,化学作为一门重要的科目之一,对于考生来说需付出不少的学习和掌握的努力。
本文将对苏教版高考化学知识点进行总结,帮助考生理清知识体系,为高考做充分准备。
一、基础概念篇化学是研究物质的性质、组成、结构以及变化的科学。
在学习化学的过程中,首先需要掌握一些基础概念。
1. 物质的分类:化学中的物质可分为元素和化合物两大类,元素是由相同类型的原子组成的纯物质,化合物是由不同元素组成的物质。
2. 原子结构:原子是构成物质的基本单位,由质子、中子和电子组成。
质子和中子位于原子核中,电子则环绕在原子核外。
3. 元素周期表:元素周期表是化学中最为重要的工具之一,通过元素的周期和族别划分,可以方便地了解元素的性质和周期趋势。
二、化学反应篇化学反应是化学学科的核心内容之一,学习化学反应的原理和方法有助于我们理解物质的变化过程。
1. 化学方程式:化学反应可以通过化学方程式来描述,反应物在反应过程中转化为生成物。
化学方程式中需要注意化学符号的书写、质量守恒以及反应前后元素的数目变化。
2. 化学反应速率:化学反应速率是指单位时间内反应物消耗或生成物产生的量,可以根据反应物浓度的变化情况来确定。
3. 平衡反应:在某些条件下,反应物与生成物之间会达到一种动态的平衡状态,这种反应称为平衡反应。
平衡反应中的反应物和生成物浓度之间符合一定的比例关系,可以通过平衡常数表达。
三、化学键篇化学键是物质形成的基础,了解不同类型的化学键有助于我们理解物质的性质和反应。
1. 离子键:离子键是由正离子和负离子之间的静电力所形成的化学键,常见于无机物质的化合物中,如盐类。
离子键的形成伴随着电子的转移和离子的生成。
2. 共价键:共价键是由原子间电子的共享形成的化学键。
共价键可以分为极性共价键和非极性共价键,极性共价键中电子被一个原子吸引得更多,而非极性共价键中电子平均分布。

第1讲原子结构[考纲要求] 1.掌握元素、核素、同位素、相对原子质量、相对分子质量、原子构成、原子核外电子排布的含义。
2.掌握原子序数、核电荷数、质子数、中子数、核外电子数以及它们之间的相互关系。
3.掌握1~18号元素的原子结构示意图的表示方法。
考点一人类对原子结构的认识1.道尔顿原子结构模型物质是由______构成的,原子是微小的不可分割的______球体,原子不能被创造也不能被毁灭,在化学变化中原子________再分割,它们的化学性质在化学反应中__________。
2.汤姆生原子结构模型提出“____________”的原子结构模型。
原子是带正电的______,在圆球里镶嵌着带______的电子。
3.卢瑟福原子结构模型原子结构的“__________”,卢瑟福根据____________现象,指出原子是由________和__________构成的,原子核带____电荷,位于__________,它几乎集中了原子的__________,电子带负电荷,在原子核周围空间做__________。
4.玻尔原子结构模型引入________观点,提出电子在一定轨道上运动的原子结构模型,指出电子在原子核外空间内一定的轨道上绕核做高速运动,这些轨道的能量是________。
玻尔理论很好地解释了______________。
5.电子云模型现代原子结构理论认为原子是由居于原子中心的__________________构成的;原子核是由____________构成的;核外电子的运动也有其特殊规律,人们形象地用________描述核外电子的运动状态。
考点二原子构成1.构成原子的微粒及作用2.将下列核素符号(X)周围5个位置数字的含义填写在方框内3.微粒之间的关系(1)质子数(Z)=核电荷数=____________;(2)质量数(A)=________(Z)+________(N);(3)阳离子的核外电子数=质子数-____________;(4)阴离子的核外电子数=质子数+______________。
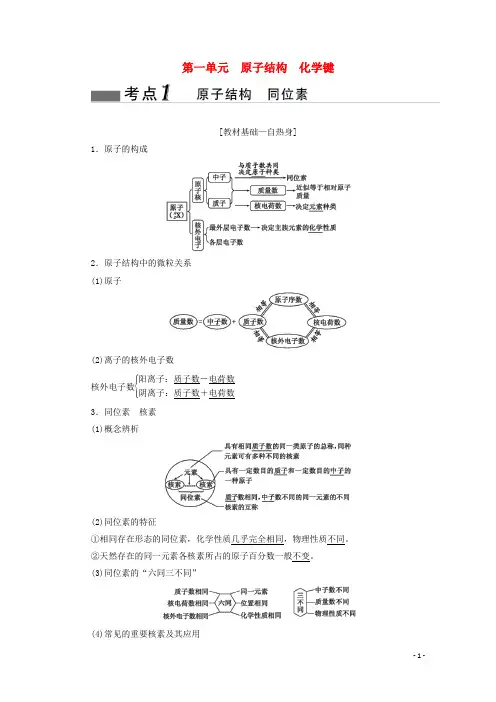
第一单元 原子结构 化学键[教材基础—自热身]1.原子的构成2.原子结构中的微粒关系 (1)原子(2)离子的核外电子数核外电子数⎩⎪⎨⎪⎧阳离子:质子数-电荷数阴离子:质子数+电荷数3.同位素 核素 (1)概念辨析(2)同位素的特征①相同存在形态的同位素,化学性质几乎完全相同,物理性质不同。
②天然存在的同一元素各核素所占的原子百分数一般不变。
(3)同位素的“六同三不同”(4)常见的重要核素及其应用4.同位素、同素异形体、同分异构体、同系物[知能深化—扫盲点]提能点(一)原子结构中各粒子数目的关系辨析(1)任何粒子中,质量数=质子数+中子数,但质子数与电子数不一定相等,如阴、阳离子。
(2)有质子的粒子不一定有中子,如11H;有质子的粒子不一定有电子,如H+。
(3)质子数相同的粒子不一定属于同一种元素,如F-与OH-。
(4)核外电子数相同的粒子,其质子数不一定相同,如Al3+和Na+、F-等,NH+4与OH-等。
[对点练]1.有以下六种原子:63Li、73Li、2311Na、2412Mg、146C、147N,下列相关说法不正确的是( )A.63Li和73Li在元素周期表中所处的位置相同B.146C和147N质量数相等,二者互为同位素C.2311Na和2412Mg的中子数相同但不属于同种元素D.73Li的质量数和147N的中子数相等解析:选B 63Li和73Li互为同位素,A正确;146C和147N的质子数不相等,二者不互为同位素,B错误;2311Na和2412Mg质子数不相同,属于不同种元素,C正确;73Li的质量数为7,147N 的中子数也为7,D正确。
提能点(二) 元素、核素、同位素、同素异形体的易错点(1)一种元素可以有多种核素,也可能只有一种核素,有多少种核素就有多少种原子。
(2)同位素的化学性质几乎完全相同,原因是核外电子排布相同。
(3)同位素之间的转化,既不是物理变化也不是化学变化,是核反应。


高三江苏结构化学知识点高三学生正处于重要的复习备考阶段,而化学是高考科目之一。
江苏高考化学试卷中,大部分题目侧重于结构化学,这是一个考查学生对分子结构、键合、功能团等方面的理解和应用能力的重要部分。
下面我将带大家回顾一些高三江苏结构化学的重要知识点。
一、键与氨基酸的键合在有机化学中,键是分子中最基本的组成部分之一。
江苏高考试题中常常考察键的性质和特点。
例如,我们熟知的共价键,是由于原子之间电子的共享形成的,并且通常都会有一个共享电子对。
江苏高考试题中的化学键相关题目常常涉及到键的极性、键长和键能等方面。
氨基酸是构成人体蛋白质的基本组成单位,了解氨基酸的键合特点对于理解蛋白质的结构和功能至关重要。
在江苏高考试题中,我们经常会遇到有关氨基酸官能团的性质和反应。
二、官能团和功能团江苏高考结构化学试题中,经常会出现各种官能团的结构特点和性质的考查。
例如,醛和酮是两种常见的官能团,在物质的命名和反应性质方面都有很多规律可循。
了解官能团的命名方法和反应规律,对于解答试题和理解有机化合物的性质都非常重要。
功能团则是由一个或多个官能团组成,具有特定的化学性质和功能。
江苏高考结构化学试题中,常常会出现对功能团命名和反应规律的考查。
熟悉各种常见的功能团,了解其命名规则和化学性质对于正确解答试题和理解有机化合物的反应机理都非常重要。
三、分子结构与反应机理江苏高考结构化学知识点的最核心部分就是分子结构和反应机理。
分子结构可以通过分子式和平面结构来表示,了解分子结构对于理解化学反应机理和预测反应产物都非常重要。
江苏高考试题中经常会出现给出分子结构和反应条件,要求预测反应类型和产物的问题。
掌握反应类型和预测反应产物的技巧将有助于解决该类试题。
此外,还有一些常见的有机反应机理需要掌握。
例如,亲核取代反应常见的有SN1和SN2机理,重排反应常见的有1,2-重排和1,4-重排等。
熟悉这些反应机理对于理解有机反应和解答试题起到至关重要的作用。

本套资源目录2020版高考化学一轮复习第1部分专题5第1单元原子结构核外电子排布教案苏教版2020版高考化学一轮复习第1部分专题5第2单元元素周期表和元素周期律教案苏教版2020版高考化学一轮复习第1部分专题5第3单元微粒之间的相互作用与物质的多样性教案苏教版原子结构核外电子排布考纲定位核心素养1.了解元素、核素和同位素的含义。
2.了解原子构成。
了解原子序数、核电荷数、质子数、中子数、核外电子数及它们之间的相互关系。
3.了解原子的核外电子排布规律。
掌握原子结构示意图、原子符号、离子符号、元素符号的表示方法。
1.微观探析——从核电荷数、质子数、中子数、核外电子数及其排布掌握原子的微观结构。
2.模型认知——根据核外电子排布规律领会原子结构模型。
3.科学探究——能发现和提出有探究价值的原子结构及核外电子排布规律。
考点一| 原子结构和核素、同位素1.原子结构(1)原子的构成(2)核素(原子)符号表示AZ X表示质子数为Z、质量数为A、中子数为A-Z的核素,如氘21H。
(3)微粒中的“各数”间的关系①质量关系:质量数(A)=质子数(Z)+中子数(N)。
②电性关系⎩⎪⎨⎪⎧原子AZ X:核外电子数=质子数Z=核电荷数=原子序数阴离子A Z X n-:核外电子数=Z+n阳离子A Z X n+:核外电子数=Z-n提醒:原子结构中的“不一定”(1)原子中不一定都含有中子,如11H中没有中子;(2)电子排布完全相同的原子不一定是同一种原子,如互为同位素的各原子;(3)易失去1个电子形成+1价阳离子的不一定是金属原子,如氢原子失去1个电子形成H+;(4)形成稳定结构的离子最外层不一定是8个电子,如Li+为2电子稳定结构;(5)阳离子不一定均有电子,如H+。
2.元素、核素、同位素(1)“三素”关系及含义(2)几种重要的核素及其应用核素235 92U 14 6C 21H 31H 18 8O用途核燃料用于考古断代制氢弹示踪原子11H:用字母H表示,名称为氕,不含中子。

苏教版高中化学知识点总结一、基本概念与原理1. 物质的组成与分类- 物质由元素组成,分为纯净物和混合物。
- 纯净物包括单质和化合物,单质是由同种元素组成的纯净物,化合物是由不同种元素以固定比例结合而成的纯净物。
2. 原子结构- 原子由原子核和核外电子组成,原子核包含质子和中子,核外电子围绕原子核运动。
- 原子序数等于核内质子数,决定了元素的性质。
3. 化学键- 化学键是原子之间的相互作用,包括离子键、共价键和金属键。
- 离子键由正负离子间的静电作用形成,共价键由原子间共享电子对形成,金属键则存在于金属原子之间。
4. 化学反应- 化学反应是指原子重新排列形成新物质的过程,通常伴随着能量的变化。
- 化学反应遵循质量守恒定律,即反应前后物质的总质量不变。
5. 化学方程式- 化学方程式用化学符号表示化学反应的过程,包括反应物、生成物、反应条件和物质的量关系。
二、重要元素及其化合物1. 碱金属和卤素- 碱金属元素具有+1价电子,易与非金属元素形成离子化合物。
- 卤素元素具有-1价电子,易与金属元素形成离子化合物。
2. 氧族元素- 氧族元素包括氧、硫、硒等,具有较高的电负性,易形成酸性氧化物和硫化物。
3. 氮族元素- 氮族元素包括氮、磷、砷等,具有多种价态,能形成多种化合物。
4. 过渡金属- 过渡金属具有不完全填充的d轨道,能形成多种颜色的化合物,并具有催化作用。
5. 稀土元素- 稀土元素包括镧系和锕系元素,具有相似的化学性质,广泛应用于电子、光学等领域。
三、溶液与化学平衡1. 溶液的组成与性质- 溶液由溶质和溶剂组成,具有均一性和稳定性。
- 溶液的浓度可以用质量分数、体积分数、摩尔浓度等表示。
2. 化学平衡- 可逆反应达到动态平衡时,正反应和逆反应的速率相等。
- 化学平衡受温度、压力、浓度等因素的影响。
3. 勒夏特列原理- 改变影响平衡的一个条件时,系统会自发调整使新的平衡位置抵消这种改变。
四、酸碱与盐1. 酸碱理论- 阿伦尼乌斯理论:酸是产生H+的物质,碱是产生OH-的物质。