九年级化学用语大全至单元
- 格式:docx
- 大小:25.15 KB
- 文档页数:2

初中化学用语总结一、单质1、由原子直接构成的单质:2、由分子构成的物质(1)金属单质,如:Na 钠Cu 铜Mg 镁Zn 锌Al 铝Ag 银K 钾Ba 钡Ca 钙Pt 铂Mn 锰Hg 汞Fe 铁Au 金……(2)非金属固体:C 碳S 硫P 磷(3)稀有气体:He 氦气Ne 氖气Ar 氩气H2氢气N2氮气O2 氧气O3臭氧Cl2氯气(一)、化合反应:“多变一”1、氯化氢和氨气反应:氯化铵氨气氯化氢−→−+ Cl NH NH HCl 43===+2、红磷燃烧: 五氧化二磷氧气磷点燃−−→−+ 522O P 2O 5P 4点燃+ 3、硫的燃烧: 二氧化硫氧气硫点燃−−→−+ 22SO O S 点燃+ 4、铁在氧气中燃烧:四氧化三铁点燃氧气铁−−→−+ 432O e F O 2e F 3点燃+5、镁的燃烧: 氧化镁氧气镁点燃−−→−+ O Mg 2O 2Mg 2点燃+ 6、铝的燃烧: 氧化铝氧气铝点燃−−→−+ 322O Al 2O 34Al 点燃+7、铜在空气中加热:氧化铜氧气铜加热−−→−+ O Cu 2O Cu 22△+8、氢气的燃烧: 水氧气氢气点燃−−→−+ O H 2O 2H 222点燃+ 9、木炭燃烧: 二氧化碳氧气碳点燃−−→−+ 22CO O C 点燃+ 10、碳在不足量氧气中燃烧:一氧化碳氧气碳点燃−−→−+ CO 2O C 22点燃+ 11、一氧化碳的燃烧:二氧化碳氧气一氧化碳点燃−−→−+ 22CO 2O CO 2点燃+12、二氧化碳溶于水:碳酸水二氧化碳→+13、生石灰遇水反应:氢氧化钙水氧化钙→+(二)、分解反应:“一变多”1、氧化汞加热分解: 氧气汞氧化汞加热+−−→− ↑+2O Hg 2Og H 2△2、过氧化氢催化分解:氧气水过氧化氢二氧化锰+−−−−→− ↑+22O Mn 22O O H 2O 2H 23、高锰酸钾加热分解:氧气二氧化锰锰酸钾高锰酸钾加热++−−→−4、氯酸钾与二氧化锰混合加热:5、电解水: 氢气氧气水通电+−−→− ↑+↑222O H 2O2H 通电6、碳酸分解: 二氧化碳水碳酸+→7、碱式碳酸铜(孔雀石)热分解:水二氧化碳氧化铜碱式碳酸铜加热++−−→−8、电解熔融氧化铝制铝:氧气铝氧化铝通电+−−→− ↑+232O 3Al 4O l A 2通电9、碳酸钙高温分解: 二氧化碳氧化钙碳酸钙高温+−−→− ↑+23CO O a C aCO C 高温(三)、置换反应:“单质+化合物 — 化合物+单质 A+BC — AC+B ”1、 氢气还原氧化铜:铜水氧化铜氢气加热+−−→−+2、 碳还原氧化铜:铜二氧化碳氧化铜碳高温+−−→−+ 金属活动顺序:3、 镁与稀盐酸反应:氢气氯化镁盐酸镁+→+4、 铝与稀盐酸反应:氢气氯化铝盐酸铝+→+5、 锌与稀盐酸反应:氢气氯化锌盐酸锌+→+6、 铁与稀盐酸反应:氢气氯化亚铁盐酸铁+→+7、 镁与稀硫酸反应:氢气硫酸镁稀硫酸镁+→+8、 锌与稀硫酸反应:氢气硫酸锌稀硫酸锌+→+ 9、 铝与稀硫酸反应:氢气硫酸铝稀硫酸铝+→+10、铁与稀硫酸反应:氢气硫酸亚铁稀硫酸铁+→+11、铝与硫酸铜反应:铜硫酸铝硫酸铜铝+→+12、铁与硫酸铜反应:铜硫酸亚铁硫酸铜铁+→+13、铁与氯化铜反应:铜氯化亚铁氯化铜铁+→+(四)、复分解反应:1、氯化钾与硝酸银反应:氯化银硝酸钾硝酸银氯化钾+→+2、盐酸与硝酸银反应:氯化银硝酸硝酸银盐酸+→+3、氧化铜与硫酸反应:水硫酸铜硫酸氧化铜+→+4、氧化镁与硫酸反应:水硫酸镁硫酸氧化镁+→+5、氧化铁与盐酸反应:水氯化铁盐酸氧化铁+→+6、盐酸与氢氧化钠反应:水氯化钠氢氧化钠盐酸+→+7、硫酸与氢氧化钠反应:水硫酸钠氢氧化钠硫酸+→+ 8、硝酸与氢氧化铜反应:水硝酸铜氢氧化铜硝酸+→+9、氯化钡与硫酸反应:水硫酸钡硫酸氯化钡+→+ 9、氯化钡与碳酸钠反应:氯化钠碳酸钡碳酸钠氯化钡+→+10、氢氧化钠硫酸铜反应:硫酸铜氢氧化铜硫酸铜氢氧化钠+→+11、氢氧化钙与氯化铁反应:氯化钙氢氧化铁氯化铁氢氧化钙+→+(五)、其他反应: 1、汽车尾气催化转换:氮气二氧化碳一氧化氮一氧化碳+−−→−+铂、钯22dP t P N CO 2NO2CO 2++,2、二氧化碳与氢氧化钙反应(澄清石灰水变浑浊):水碳酸钙氢氧化钙二氧化碳+→+3、大理石与盐酸反应:二氧化碳水氯化钙盐酸碳酸钙++→+4、甲烷(天然气的主要成分)燃烧:水二氧化碳氧气甲烷点燃+−→−+O H 2CO O 2CH 2224++点燃5、一氧化碳还原氧化铁:二氧化碳铁一氧化碳氧化铁高温+−−→−+ 232CO 32Fe COO e F ++高温6、一氧化碳还原氧化铜:二氧化碳铜一氧化碳氧化铜加热+−−→−+ 2CO u C COCuO ++加热10、碳酸氢铵与氢氧化钙混合:氨气水碳酸钙氢氧化钙碳酸氢铵++→+11、硫酸铵与氢氧化钠溶液混合加热:氨气水硫酸钠氢氧化钠硫酸铵△++−→−+(NH 4)2SO 4+2NaOH Na 2SO 4+ H 2O + NH 3·H 2O7、葡萄糖在酶作用下的反应:水二氧化碳氧气葡萄糖酶+−→−+。

人教版九年级化学全册知识点汇总,中考复习必备一、化学用语1、常见元素及原子团的名称和符号非金属:O氧 H氢 N氮 Cl氯 C碳 P磷 S硫金属:K钾 Ca钙 Na钠 Mg镁 Al铝 Zn锌 Fe铁 Cu铜 Hg汞 Ag银 Mn锰 Ba钡原子团(根):氢氧根硝酸根碳酸根OH- NO3- CO3 2-硫酸根磷酸根铵根SO4 2- PO43- NH4+2、化合价口诀(1)常见元素化合价口诀:一价氢氯钾钠银;二价氧钙钡镁锌;三五氮磷三价铝;铜汞一二铁二三;二、四、六硫四价碳;三、许多元素有变价,四、条件不同价不同。
(2) 常见原子团(根)化学价口诀:一价硝酸氢氧根;二价硫酸碳酸根;三价常见磷酸根;通常负价除铵根。
(3)熟练默写常见元素的常用的化合价+1价 K+ 、Na+ 、H+ 、Ag+ 、NH4++2价 Ca2+ 、Ba2+ 、Mg2+ 、Zn2+ 、Cu2+ 、 Hg2+、亚Fe2++3价 Fe3+ ,Al3+-1价 Cl-、OH-、NO3-3.必须熟记的制取物质的化学方程式(1)实验室制取氧气一:2KMnO4===K2MnO4+MnO2+O2↑(2)实验室制取氧气二:2H2O2 ===2H2O+O2↑(3)实验室制取氧气三:2KClO3===2KCl+3O2↑(4)实验室制法CO2:CaCO3+2HCl==CaCl2+H2O+CO2↑(5)实验室制取氢气:Zn+H2SO4==ZnSO4+H2↑(6)电解水制取氢气:2H2O===2H2↑+O2↑(7)湿法炼铜术(铁置换出铜):Fe+CuSO4==FeSO4+Cu(8)炼铁原理:3CO+Fe2O3===2Fe+3CO2(9)生灰水[Ca(OH)2 ]的制取方法:CaO+H2O==Ca(OH)2(10)生石灰(氧化钙)制取方法:Ca CO3 ===CaO+CO2↑二、金属活动性顺序:金属活动性由至弱:K Ca Na Mg Al , Zn Fe Sn Pb (H) ,Cu Hg Ag Pt Au 。

九年级化学用语(包括元素符号、结构示意图、化合价、离子符号、化学式、化学方程式)黔西县思源实验学校:白晋阳一、记住30 种元素的名称和符号。
H 氢Ar 氩He氦K钾Li锂Ca钙Be铍Zn锌B硼Fe铁C碳Sn锡N氮Cu铜O氧Hg汞F氟Ag银Ne氖Au金Na钠I碘Mg镁Ba钡Al铝Mn锰Si硅P磷S硫Cl氯二、原子结构示意图1~20 号元素原子结构示意图氢氦Li 锂铍硼H He Be B碳C氮O氧氟氖N F Ne钠Na镁铝硅磷Mg Al Si P钾K钙Ca硫氯氩S Cl Ar K Ca三、常见元素和根在化合物中的化合价一 价 氯 银 钠 钾 氢 , -1 +1 +1 +1 +1Cl Ag K Na H-2 +2 +2 +2 +2Mg Zn二 价 氧 钙 钡 镁 锌 , O +3 Al -2 Ca Ba +4Si-2铝 三 硅 四 要 记 住 , 碳 酸 硫 酸 二 价 根 , C O 3 -1 OH -3PO 4 SO 4+1N O 3 -1 氢 氧 硝 酸 铵 根 一 , NH 4还 有 三 价 磷 酸 根 。
说明:在初中化学中,具有可变化合价的元素是如下 8 种:C N P S Cl Cu Fe Mn但是它们的化合价不用去记! 在初中化学中,除了以上根的化合价需要记住以外,其它的根的化合价也不用去记。
四、常见离子符号(共 25 个):―(氯离子)、Ag + (银离子 )、 K + (钾离子 ) 、 Na + (钠离子 )、 H + (氢离子 ) ClO 2-(氧离子)、 Al 3+(铝离子 )Ca 2+ (钙离子 )、 Ba 2+ (钡离子 )、 Mg 2+ (镁离子 )、 Zn 2+ (锌离子 ) CO 32-(碳酸根离子 )、 OH -(氢氧根离子 )、 PO 43-( 磷酸根离子 )2- SO 4 (硫酸根离子 ) - + NO 3 (硝酸根离子 )、 NH 4 (铵根离子 )Fe 2+ (亚铁离子 )、 F e 3+ (铁离子 )、、Cu 2+ (铜离子 )、HCO 3-(碳酸氢根离子 )以及 4-(高锰酸根离子 )、 MnO 4 (锰酸根离子 )、 ClO 3 (氯酸根离子 2- - 2- )、SO 3 (亚硫酸根离 MnO 子 )、五、记住下列物质的化学式,且能将它正确分类㈠、单质氢气H 2氮气氯气氧气臭氧氦气N2 Cl 2 O2 O3 He氖气氩气Ne Ar碳硅硫磷碘C Si S P I2钾钙钠镁铝锌K Ca Na Mg Al Zn 铁铜汞银Fe Cu Hg Ag㈡、化合物1、氧化物水HSO3 CO2O 三氧化硫一氧化碳二氧化碳CO 2五氧化二磷过氧化氢P2O 5 H 2O 2二氧化氮NO 2二氧化硫氧化钙SO2CaO氧化亚铁氧化铁FeO Fe2 O3 四氧化三铁Fe3 O4 氧化镁氧化锌二氧化锰MgO ZnO MnO 2氧化汞氧化铝HgO Al 2O 3氧化铜CuO 2、酸碱盐硝酸HNO 硫酸盐酸H 2SO4HCl3碳酸H 2CO 3 硫化氢H 2S氢氧化钠氢氧化钾氢氧化钙NaOH KOH Ca(OH) 2氢氧化镁Mg(OH) 氢氧化铝氢氧化锌Al(OH) Zn(OH)232氢氧化铁Fe(OH) 氢氧化亚铁氢氧化铜Fe(OH) Cu(OH)322氢氧化钡Ba(OH) 氨水NH 3·H 2O2氯化钠氯化铜NaCl CuCl 氯化铝AlCl 32氯化钾氯化亚铁KCl FeCl 2氯化铁FeCl 3氯化银氯化钙AgCl CaCl 氯化镁MgCl22氯化钡BaCl 2氯化锌硫酸铜ZnCl 2 CuSO 4 高锰酸钾KMnO 锰酸钾氯酸钾K 2MnO KClO443碳酸钙CaCO 硝酸钾硝酸钠KNO NaNO333硝酸铁 Fe(NO 3)3 硝酸亚铁 硝酸铝 Fe(NO 3)2 Al(NO 3)3碳酸钠 Na 2CO 3 碳酸钙 碳酸铵 CaCO (NH 4)2CO 33 碳酸氢钠 NaHCO 硫酸铁 硫酸亚铁 Fe 2(SO 4)3 FeSO 43 硝酸银 AgNO 硝酸钡 硝酸铵 Ba(NO 3) 2 NH 4NO 33 硫酸钡 BaSO 43、有机化合物甲烷 CH 乙醇 葡萄糖 C 2H 5OH C 6 H 12O 64 六、记住下列反应的化学方程式㈠、化合反应1、红磷在空气(或氧气)中燃烧: 4P + 5O 2 2P 2O 5点燃 2H 2O点燃2、氢气在空气中燃烧生成水: 2H 2 + O 2 点燃3、硫磺在空气(或氧气)中燃烧:4、镁条在空气(或氧气)中燃烧: S + O 2 SO 2点燃2Mg + O 2 2MgO点燃5、铁丝在氧气中燃烧: 3Fe + 2O 2 Fe 3O 4点燃 6、木炭在空气(或氧气)中完全燃烧: C + O 2 CO 2点燃7、木炭不充分燃烧: 2C + O 2 8、一氧化碳燃烧: 2CO + O 2 2CO点燃 2CO 29、二氧化碳和水反应生成碳酸: CO 2 + H 2O == H 2CO 3高温10、二氧化碳通过灼热的炭层: CO 2 + C 2CO11、生石灰作为干燥剂: CaO + H 2O == Ca(OH)2㈡、分解反应11、高锰酸钾制氧气: 2KMnO 4K 2MnO 4 + MnO 2 + O 2↑△ MnO 22KCl + 3O 2↑12、氯酸钾制氧气: 2KClO 3 △ MnO 213、双氧水制氧气: 2H 2O 2 2H 2O + O 2↑通电 14、电解水: 2H 2O 2H 2↑+ O 2↑H 2O + CO 2↑15、碳酸分解: H 2 CO 3 高温 16、高温煅烧石灰石(工业制取二氧化碳): CaCO 3 CaO +CO 2↑㈢、置换反应17、铜和硝酸银溶液反应: 18、铁和硫酸铜溶液反应: Cu + 2AgNO 3 == 2Ag + Cu(NO 3)2Fe + CuSO 4 == Cu + FeSO 419、锌和硫酸反应制取氢气: Zn + H 2SO 4 == ZnSO 4 + H 2↑20、铝和稀硫酸反应: 2Al + 3H 2SO 4 == Al 2(SO 4)3 + 3H 2↑高温 21、木炭还原氧化铁: 木炭还原氧化铜: 3C + 2Fe 2O 3 4Fe + 3CO 2↑高温 C + 2CuO 2Cu + CO 2↑高温 木炭还原四氧化三铁: 2C + Fe 3O 4 3Fe +2CO 2↑氢气还原氧化铜: H 2 + CuO Cu + H 2 O高温 ㈣、复分解反应A 、酸 + 碱 → 盐 + 水22、氢氧化钠与盐酸反应: 23、氢氧化钠与硫酸反应: NaOH + HCl == NaCl + H 2O2NaOH + H 2SO 4 == Na 2SO 4 + 2H 2O24、氢氧化铝治疗胃酸过多: Al(OH) + 3HCl == AlCl 3 + 3H 2O3 25、氢氧化镁与硫酸反应: Mg(OH) 2 + H 2SO4 == MgSO 4 + 2H 2OB 、酸 + 盐 → 新酸 + 新盐26、盐酸与硝酸银溶液反应: HCl + AgNO 3 == AgCl ↓+ HNO 327、氯化钡溶液与硫酸溶液反应: BaCl 2 + H 2SO 4 == BaSO 4↓+ 2HCl28、碳酸钠与稀盐酸: Na 2CO 3 + 2HCl == 2NaCl+ H 2O + CO 2碳酸氢钠与稀盐酸: NaHCO 3 + HCl == NaCl+ H 2O + CO 229、石灰石与稀盐酸反应(实验室)制取二氧化碳:CaCO 3+2HCl = CaCl 2+H 2O+CO 2C 、碱 + 盐 → 另一种碱 + 另一种盐30、硫酸铜溶液和氢氧化钠溶液反应: 31、氯化铁溶液和氢氧化钠溶液反应: CuSO 4+2NaOH = Na 2SO 4+Cu(OH)2↓FeCl 3 +3NaOH==Fe(OH)3↓+3NaClD 、盐 + 盐 → 两种新盐32、硝酸银溶液与氯化钠溶液反应: 33、氯化钡溶液与碳酸钠溶液反应: AgNO 3 + NaCl == AgCl ↓+ NaNO 3BaCl 2+ Na 2CO 3 = BaCO 3↓+ 2NaClE 、金属氧化物 + 酸 → 盐 + 水34、稀盐酸清洗铁锈: 6HCl + Fe 2O 3 == 2FeCl 3 + 3H 2O35、氧化铜与稀硫酸反应: CuO + H 2SO 4== CuSO 4+ H 2O㈤、其他反应类型A 、非金属氧化物 + 碱 → 盐 + 水36、二氧化碳通入澄清石灰水中: CO 2 + Ca(OH)2 == CaCO 3↓+ H 2O37、氢氧化钠在空气中变质: CO 2+ 2NaOH = Na 2CO 3 + H 2O38、氢氧化钠溶液吸收二氧化硫: 39、氢氧化钠溶液吸收三氧化硫: SO 2 + 2NaOH ==Na 2 SO 3+ H 2OSO 3 + 2NaOH ==Na 2 SO 4+ H 2OB 、其它情形40、一氧化碳还原氧化铜: CO + CuO Cu + CO 2高温 41、一氧化碳还原氧化铁: 3CO + Fe 2 O 3 2Fe + 3CO 2↑高温 42、一氧化碳还原四氧化三铁: 4CO + Fe 3O 4 3Fe + 4CO 2↑点燃43、酒精燃烧: 44、甲烷燃烧: C 2H 5OH + 3O 2 2CO 2 + 3H 2 O点燃 CH 4 + 2O 2 CO 2 + 2H 2O。

初三化学中考必记的化学用语一、元素名称及符号三、化学式四、化合价1.元素化合价:+1价:K、Na、Ag、H ;+2价:Ca、Mg、Ba、Zn、Hg ;+3价:Al ;+4价:Si ;+1、+2价Cu ;+2、+3价Fe ;+2、+4价C;+2、+4、+6价:S;-1价:F、Cl ;-2价:O、S;-3价:N、P2.原子团化合价:(化合价数目与离子所带电荷数目相等,符号相同,但位置顺序相反)名称:铵根氢氧根硝酸根硫酸根碳酸根磷酸根符号:NH4OH NO3SO4CO3PO4化合价:+1 -1 -1 -2 -2 -3离子符号:NH4+OH—NO3—SO42—CO32—PO43—五、金属活动性顺序(由强到弱):元素符号:K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au元素名称:钾钙钠镁铝锌铁锡铅(氢)铜汞银铂金六、部分酸、碱、盐的溶解性规律:1、酸:全部溶于水;2、碱:大多数不溶于水,NH3·H2O、KOH、NaOH、Ba(OH)2溶于水,Ca(OH)2微溶;3、盐:a、钾盐、钠盐、铵盐、硝酸盐四类盐都易溶于水;b、盐酸盐(即氯化物)绝大多数溶于水,只有AgCl不溶于水;c、硫酸盐绝大多数溶于水,只有BaSO4不溶于水,Ag2SO4、CaSO4微溶于水;d、碳酸盐绝大多数不溶于水,Na2CO3、K2CO3、(NH4)2CO3溶于水,MgCO3微溶于水。
七、物质的俗名、学名及化学式⑴金刚石、石墨:C ⑵水银、汞:Hg (3)硫磺、硫:S(4) 生石灰、氧化钙:CaO (5)干冰(固体二氧化碳):CO2 (6)盐酸、氢氯酸:HCl (7)亚硫酸:H2SO3(8)氢硫酸:H2S (9)熟石灰、消石灰、氢氧化钙:Ca(OH)2 (10)苛性钠、火碱、烧碱:NaOH (11)食盐氯化钠:NaCl(12)纯碱、碳酸钠:Na2CO3碳酸钠晶体、纯碱晶体:Na2CO3·10H2O(13)碳酸氢钠、酸式碳酸钠:NaHCO3(也叫小苏打)碳铵、碳酸氢铵:NH4HCO3(14)胆矾、蓝矾、硫酸铜晶体:CuSO4·5H2O(五水合硫酸铜)(15)铜绿、孔雀石、碱式碳酸铜:Cu2(OH)2CO3(分解生成三种氧化物的物质)(16)甲醇:CH3OH 有毒、失明、死亡(17)酒精、乙醇:C2H5OH (18) )氨气:NH3(碱性气体)(19)醋酸、乙酸(16.6℃冰醋酸)CH3COOH(CH3COO- 醋酸根离子)具有酸的通性(20) 氨水、一水合氨:NH3·H2O(为常见的碱,具有碱的通性,是一种不含金属离子的碱)(21)亚硝酸钠:NaNO2(工业用盐、有毒)八、常见物质的颜色及状态1、白色固体:白磷P、P2O5、MgO、CaO、NaOH、Ca(OH)2、KClO3、KCl、NaCl、Na2CO3、NaHCO3、无水CuSO4;CaCO3、BaCO3、Mg(OH)2、AgCl、BaSO4;银白色固体:铁(铁粉为黑色)、铝、镁等多数金属(汞为银白色液态)2、黑色固体:石墨、炭粉、铁粉、CuO、MnO2、Fe3O4▲KMnO4、I2为紫黑色(碘蒸气为紫红色)3、红色固体:Cu、Fe2O3、HgO、红磷▲硫:淡黄色▲ Cu2(OH)2CO3为绿色4、绿色固体:Cu(OH)2CO3、K2MnO4 蓝色固体:CuSO4·5H2O 淡黄色固体:S5、溶液的颜色:含Cu2+的溶液——蓝色;含Fe2+的溶液——浅绿色;含Fe3+的溶液——黄色,含MnO4—高锰酸根离子的溶液——紫红色;其余溶液一般——无色。

得化学用语者得天下!——中考化学用语约占总分40%九年级必记化学用语(单元版)绪言一、请记忆元素符号(41种):参见《九年级化学导学案》P5A:Ag银108、Al铝27、Ar氩40、Au金197。
B:B硼11、Ba钡137、Be铍9、Br溴80。
C:C碳12、Ca钙40、Cl氯35.5、Co钴60、Cu铜63.5。
F:F氟19、Fe铁56。
H:H氢1、He氦4、Hg汞201。
I:I碘127。
K:K钾39、Kr氪84。
L:Li锂7。
M:Mg镁24、Mn锰55。
N:N氮14、Na钠23、Ne氖20。
O:O氧16。
P:P磷31、Pb铅207、Pt铂195。
R:Rn氡222。
S:S硫32、Sb锑122、Si硅28、Sn锡119。
T:Ti钛48。
U:U铀238。
W:W钨184。
X:Xe氙131。
Z:Zn锌65。
二、请记忆化学符号U1:走进化学世界#第二周期:锂Li 铍Be 硼B 碳C 氮N 氧O 氟F 氖Ne 第三周期:钠Na 镁Mg 铝Al 硅Si 磷P 硫S 氯Cl 氩Ar 第四周期:钾K 钙Ca二、请记忆金属活动性顺序1.石蜡+氧气二氧化碳+水2. 硫酸铜氢氧化铜硫酸铜氢氧化钠+→+2NaOH +CuSO 4=Cu(OH )2↓+Na 2SO 4 (CuSO 4溶液为蓝色,Cu(OH)2为蓝色沉淀)3.二氧化碳水氯化钙盐酸碳酸钙++→+4.水二氧化碳氧化铜碱式碳酸铜加热++−−→− Cu 2(OH )2CO 3Δ2CuO +H 2O +CO 2↑5.二氧化碳氧气碳点燃−−→−+ C+O 2CO 26.水碳酸钙氢氧化钙二氧化碳+→+7.碳酸钠+盐酸→氯化钠+水+二氧化碳 Na 2CO 3+2HCl===2NaCl+H 2O+CO 2↑8.锌+盐酸→氯化锌+氢气9.氢氧化铜→氧化铜+水 Cu(OH)2 CuO+H 2OU2:我们周围的空气一、请记忆化学反应的文字表达式1.汞+氧气→氧化汞;2Hg+O 22HgO2.氧气汞氧化汞加热+−−→− ;↑+2O Hg 2Og H 2△3.五氧化二磷氧气磷点燃−−→−+ ;4P+5O 22P 2O 5 4.二氧化硫氧气硫点燃−−→−+ ;S+ O 2SO 25.四氧化三铁点燃氧气铁−−→−+ ;3Fe+2O 2Fe 3O 46.氢气氧气水通电+−−→− ↑+↑222O H 2O2H 通电7.水氧气氢气点燃−−→−+ ;2H 2+O 22H 2O9.氧气水过氧化氢二氧化锰+−−−−→− ;2H 2O 22H 2O+O 2↑ 10.氧气二氧化锰锰酸钾高锰酸钾加热++−−→− ;2KMnO 4K 2MnO 4+MnO 2+O 2↑11.2KClO 32KCl+3O 2↑二、请记忆化合价(包括元素&原子团):参见《九年级化学导学案》P 7 1.元素的化合价氢+1,氧-2,银锂钠钾+l 价, 锌镁钙钡+2价,铝+3,硅+4;只遇金属或是氢,氮磷-3、硫-2,氟氯溴碘总-1。
九年级化学上册知识点总结归纳一、化学用语1、常见元素及原子团的名称和符号非金属:0氧h氢n氮cl氯c碳p磷s硫金属:k钾ca钙na钠mg镁al铝zn锌fe铁cu铜hg汞ag银mn锰ba贝原子团(根):氢氧根硝酸根碳酸根oh-no3-c-硫酸根磷酸根铵根s-p-nh4+2、化合价口诀(1)常见元素化合价口诀:一价氢氯钾钠银;二价氧钙钡镁锌;三五氮磷三价铝;铜汞一二铁二三;二、四、六硫四价碳;三、许多元素有变价,四、条件相同价相同。
(2)常见原子团(根)化学价口诀:一价硝酸氢氧根;二价硫酸碳酸根;三价常用磷酸根;通常负价除铵根(3)娴熟口诀常用元素的常用的化合价+1价k+、na+、h+、ag+、nh4++2价ca2+、ba2+、mg2+、zn2+、cu2+、+3价fe3+,al3+hg2+、亚fe2+-1价cl-、oh-、no3-3.必须记诵的制备物质的化学方程式(1)实验室制取氧气一:(2)实验室制备氧气二:(3)实验室制取氧气三:(4)实验室制法co2:2kmn04===k2mn04+mn02+02个2h===2h20+02个2kc===2kcl+个caco3+2hcl==cac12+h20+c02个zn+h2s04==zns04+h2个(5)实验室制备氢气:(6)电解水制取氢气:2h20===2h2十+02个(7)湿法炼铜术(铁置换出铜):fe+cus04==fes04+cu(8)炼铁原理:3c0+fe===2fe+3c02(9)生灰水[ca(oh)2]的制备方法:cao+h20==ca(oh)2(10)生石灰(氧化钙)制取方法:caco3===cao+c02个二、金属活动性顺序:金属活动性由至弱:kcanamgal,znfesnpb(h),cuhgagptau。
(按5个一句顺序诵读)钾钙钠镁铝,锌铁锡铅(氢),铜汞银铂金。
三、常用物质的颜色、状态1、白色固体:mgo、p、cao、naoh、ca(oh)2、kcl03、kcl、na2c03、nacl、浓硫酸cus04;铁、镁为银白色(汞为银白色液态),除了存有颜色的液态,其他液态通常为白色。
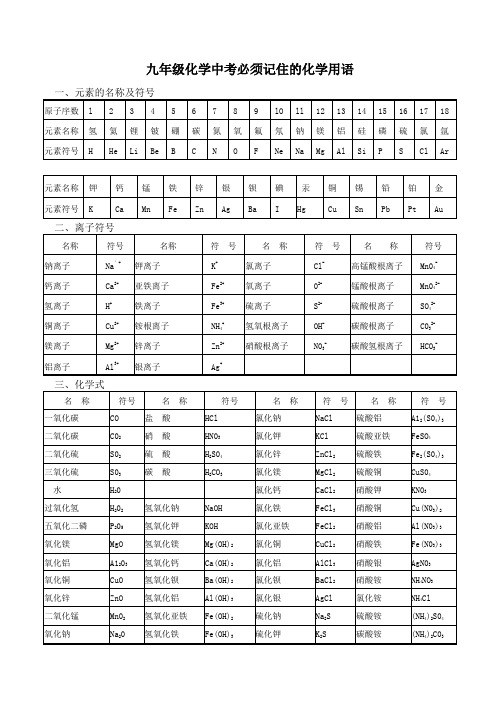
九年级中考常用化学用语(必记)一、1、记住30种元素的名称和符号。
2、记住元素的化合价口诀一价氢锂钾钠银,二价钙镁钡和锌,一二铜汞二三铁,正三价铝四价硅,通常氧为负二价,氟氯溴碘负一价,三价五价氮和磷,二四六硫二四碳,单质元素介为零.负一硝酸氢氧根;负二硫酸碳酸根;负三记住磷酸根,正一价的是铵根二、记住并正确书写18个离子符号。
磷酸根:PO43-三、记住下列物质的化学式,且能将它正确分类。
四、记住下列反应的化学方程式。
1、4P+5O 2点燃====2P 2O 5 现象::产生大量的白烟、放出热量2、C+O 2点燃====CO 2 现象:空气是红光、纯氧中是白光,生成能够让澄清石灰水浑浊的气体 3、S+O 2 点燃====SO 2 现象:空气中是淡蓝色的火焰;纯氧中是蓝紫色的火焰;同时生成有刺激性气味的气体。
4、3Fe+2O 2点燃====Fe 3O 4 现象:剧烈燃烧、火星四射、生成黑色的固体、放出大量的热。
5、4Al+3O 22Al 2O 3 现象:发出耀眼的白光,放热,生成白色固体6、2Mg+O 22MgO 现象:镁在空气中燃烧,发出耀眼的白光、放热、生成白色粉末7、2Cu+O 22CuO 现象:红色的固体逐渐变成黑色8、2CO+O 22CO 现象:产生蓝色火焰,放热,生成能使澄清石灰水变浑浊的气体9、2HgO △====2Hg+O 2↑ 现象:生成银白色的液体金属 10、2H 2O 2MnO 2====2H 2O+O 2↑ 现象:溶液里冒出大量的气泡11、2KClO 3MnO 2====2KCl+3O 2↑ 现象:生成能让带火星的木条复燃的气体 12、2KMnO 4△====K 2MnO 4+MnO 2+O 2↑ 现象:同上,第三单元 自然界的水1、2H 2O2H 2↑+O 2↑ 现象:电极上有气泡产生、正负极的试管内产生的气体体积比约为1:2,2、2H 2+O 2点燃====2H 2O 现象:淡蓝色的火焰、放热3、(制取氢气)Zn+H 2SO 4==ZnSO 4+H 2↑ 现象:有可燃烧的气体生成4、(氢气还原氧化铜)H 2+CuO △====Cu+H 2O 现象:由黑色的固体变成红色的,同时有水珠生成第五单元 化学方程式1、Fe+CuSO 4==FeSO 4+Cu 现象:铁钉表面有红色物质生成、溶液由淡蓝色逐渐变成浅绿色2、Na 2CO 3+2HCl==2NaCl+H 2O+CO 2↑ 现象:白色粉末逐渐溶解、大量气泡生成3、2Mg+O 22MgO 现象:镁在空气中燃烧,发出耀眼的白光、放热、生成白色粉末第六单元 碳和碳的氧化物1、(可燃性)C+O 2CO 2(充分燃烧)2C+O 22CO (不充分燃烧)2、(还原性)C+2CuO 2Cu+CO 2↑ 现象:有红色物质生成,生成的气体能使澄清石灰水变浑浊3、2Fe 2O 3+3C 4Fe+3CO 2↑4、CO 2+C2CO4、(实验室制取二氧化碳)CaCO 3+2HCl=CaCl 2+H 2O+CO 2↑5、(工业制取二氧化碳)CaCO 3CaO+CO 2↑6、CO 2+H 2O=H 2CO 37、H 2CO 3=H 2O+CO 2↑8、(澄清石灰水变浑浊即检验CO 2)CO 2+Ca(OH)2=CaCO 3↓+H 2O9、(吸收)2NaOH+CO 2==Na 2CO 3+H 2O 10、(CO 可燃性)2CO+O 22CO 2 现象:发出蓝色火焰、放热、生成能使澄清石灰水变浑浊的气体。
初中必背的化学用语
一、元素符号必记
1、1至20
2
+1 +1 -1 +1 +1
k Na Cl H Ag -2 +2 +2 +2 +2
O Ca Ba Mg Zn +2 +3 +2 +4 Fe F e C C
+3 +4 +5
Al Si P +2 +4 +6 S S S +2 +2 Cu Hg 0 0 H 2 O 2
负一氢氧硝酸根,负二硫酸碳酸根,负三记住磷酸根,唯有正一是铵根。
1 -1 -
2 OH - NO 3- SO 42- (三)离子和原子团
(1)常见的离子
氢离子一H + 钠离子一Na + 钾离子一K + 镁离子一Mg 2+钙离子一Ca 2+ 钡离子一Ba 2+ 锌离子一Zn 2+
铝离子一AI 3+银离子-Ag + 氧离子一O 2-
氯离子一Cl -
亚铁离子一562+(浅绿色) 铜离子一Cu 2+(蓝色) 铁离子一563+(黄色)
二、元素的化合价
(一)常见元素的化合价口诀
一价钾钠氯氢银 二价氧钙钡镁锌 二三铁 二四碳 三铝四硅五价磷 二四六硫都齐全 铜汞二价最常见 莫忘单质都为零
(二)常见原子团的化合价 -2
-3
+1 CO 32- P043-
NH 4+
⑵常见的原子团
氢氧根——OH- 碳酸根——CO32- 硫酸根SO42-
硝酸根——NO3-磷酸根PO43-铵根——NH4+三、常见的化学式
(一)、常见的单质
(二)、化合物
5、常见有机化合物
6、其他化合物
四、化学反应方程式。
化学用语
一、元素符号
氢H氦He碳C氮N氧O氟F氖Ne
钠Na镁Mg铝Al硅Si磷P硫S 氯Cl
氩Ar钾K钙Ca锰Mn铁Fe铜Cu锌Zn
银Ag钡Ba铂Pt金Au汞Hg碘I锂Li
铍Be硼B铅Pb锡Sn钛Ti溴Br钨W 二、化学式
氧气O2氢气H2氮气N2氟气F2氯气Cl2氦气He
氖气Ne氩气Ar溴Br2碘I2臭氧O3碳C
硫S磷P硅Si碳60 C60铁Fe铝Al
镁Mg锌Zn铜Cu银Ag水银Hg钠Na
水H2O过氧化氢H2O2二氧化碳CO2一氧化碳CO二氧化氮NO2一氧化二氮N2O一氧化氮NO二氧化硅SiO2五氧化二磷P2O5二氧化硫SO2三氧化硫SO3二氧化氯ClO2氧化钠Na2O
氧化镁MgO氧化铝Al2O3氧化钾K2O氧化钙CaO
二氧化锰MnO2四氧化三铁Fe3O4氧化铁Fe2O3氧化亚铁FeO
氧化铜CuO氧化锌ZnO氧化钡BaO氧化汞HgO
盐酸HCl硫酸H2SO4硝酸HNO3碳酸H2CO3磷酸H3PO4
氨气NH3氨水NH3·H2O氢氧化钾KOH氢氧化钠NaOH氢氧化钙Ca(OH)2氢氧化钡Ba(OH)2氢氧化镁Mg(OH)2氢氧化铝Al(OH)3氢氧化锌Zn(OH)2氢氧化铁Fe(OH)3氢氧化亚铁Fe(OH)2氢氧化铜Cu(OH)2乙酸CH3COOH 甲烷CH4乙醇C2H5OH葡萄糖C6H12O6淀粉(C6H10O5)n蔗糖C12H22O11氯化钾KCl氯化钠NaCl氯化钡BaCl2氯化钙CaCl2
氯化镁MgCl2氯化铝AlCl3氯化锌ZnCl2氯化铁FeCl3
氯化亚铁FeCl2氯化铜CuCl2 氯化银AgCl硫酸钾K2SO4
硫酸钠Na2SO4硫酸钡BaSO4硫酸钙CaSO4硫酸镁MgSO4硫酸铝Al2(SO4)3硫酸锌ZnSO4硫酸铁Fe2(SO4)3硫酸亚铁FeSO4
硫酸铜CuSO4硫酸银Ag2SO4硝酸钾KNO3硝酸钠NaNO3
硝酸钙Ca(NO3)2硝酸钡Ba(NO3)2硝酸镁Mg(NO3)2硝酸铝Al(NO3)3硝酸锌Zn(NO3)2硝酸铁Fe(NO3)3硝酸亚铁Fe(NO3)2硝酸铜Cu(NO3)2硝酸银AgNO3高锰酸钾KMnO4锰酸钾K2MnO4氯酸钾KClO3
碳酸钾K2CO3碳酸钠Na2CO3碳酸钙CaCO3碳酸钡BaCO3
碳酸镁MgCO3碳酸锌ZnCO3碳酸亚铁FeCO3碳酸银Ag2CO3氯化铵NH4Cl硝酸铵NH4NO3硫酸铵(NH4)2SO4碳酸氢铵NH4HCO3碳酸铵 (NH4)2CO3磷酸钙Ca3(PO4)2
三、常见的离子符号
氧离子O2-氟离子F-硫离子S2-氯离子Cl-钠离子Na+
镁离子Mg2+铝离子Al3+钾离子K+钙离子Ca2+氢离子H+
锂离子Li+铍离子Be2+铁离子Fe3+亚铁离子Fe2+铜离子Cu2+
-
四、化学方程式
1.红磷在氧气中燃烧
2.硫在氧气中燃烧
3.铁丝在氧气中燃烧
4.加热高锰酸钾
5.过氧化氢溶液与二氧化锰混合
6.加热氯酸钾与二氧化锰的混合物
7.在氧气中加热汞
8.氧化汞受热分解
9.氢气在氯气中燃烧
10.氢气在氧气中燃烧11.电解水
12.镁条在氧气中燃烧13.铝箔在氧气中燃烧14.铜在空气中加热
15.氢气还原氧化铜
16.木炭在氧气中完全燃烧17.木炭在氧气中不完全燃烧18.碳还原氧化铜
19.碳还原氧化铁
20.碳还原二氧化碳
21.碳还原水蒸气
22.实验室制取二氧化碳23.碳酸分解
24.工业上制备二氧化碳25.二氧化碳与水反应26.检验二氧化碳的反应27.一氧化碳燃烧
28.一氧化碳还原氧化铜29.一氧化碳还原四氧化三铁30.灭火器的反应原理31.氧化钙与水反应32.甲烷燃烧
33.乙醇(酒精)燃烧34.实验室制取氢气35.铝常温下氧化
36.镁与盐酸反应
37.铝与盐酸反应
38.锌与盐酸反应
39.铁与盐酸反应
40.镁与稀硫酸反应41.铝与稀硫酸反应42.铁与稀硫酸反应43.铁与硫酸铜溶液反应44.锌与硫酸铜溶液反应45.铝与硫酸铜溶液反应46.铜与硝酸银溶液反应47.铝与硝酸银溶液反应48.铁与硝酸银溶液反应49.锌与硝酸银溶液反应50.工业上炼铁的反应原理。