最完整的九年级化学用语
- 格式:doc
- 大小:239.00 KB
- 文档页数:6

九年级化学用语大全(1至8单元)一、元素符号氢 H 氦 He 碳 C 氮 N 氧 O 氟 F 氖 Ne 钠Na 镁 Mg 铝 Al 硅 Si 磷 P 硫 S 氯 Cl 氩 Ar 钾 K 钙 Ca 锰Mn 铁 Fe 铜 Cu 锌 Zn 银 Ag 钡 Ba 铂 Pt 金 Au 汞 Hg 碘 I 锂 Li 铍 Be 硼 B 铅 Pb 锡 Sn 钛 Ti 溴 Br 钨 W二、化学式氧气 O2 氢气 H2 氮气 N2 氟气 F2 氯气 Cl2 氦气 He 氖气 Ne 氩气 Ar 溴 Br2 碘 I2 臭氧 O3 碳 C 硫 S 磷 P 硅 Si 碳60 C60 铁 Fe 铝 Al 镁 Mg 锌 Zn 铜 Cu 银 Ag 水银Hg 钠 Na 水 H2O 过氧化氢 H2O2 二氧化碳 CO2 一氧化碳 CO 二氧化氮 NO2 一氧化二氮 N2O 一氧化氮 NO 二氧化硅 SiO2 五氧化二磷 P2O5 二氧化硫 SO2 三氧化硫 SO3 二氧化氯 ClO2 氧化钠 Na2O 氧化镁 MgO 氧化铝 Al2O3 氧化钾 K2O 氧化钙 CaO 二氧化锰 MnO2 四氧化三铁 Fe3O4 氧化铁 Fe2O3 氧化亚铁 FeO 氧化铜 CuO 氧化锌 ZnO 氧化钡 BaO 氧化汞 HgO 盐酸 HCl 硫酸H2SO4 硝酸 HNO3 碳酸 H2CO3 磷酸 H3PO4 氨气 NH3 氨水NH3H2O 氢氧化钾 KOH 氢氧化钠 NaOH 氢氧化钙 Ca(OH)2 氢氧化钡 Ba(OH)2 氢氧化镁 Mg(OH)2 氢氧化铝 Al(OH)3 氢氧化锌Zn(OH)2 氢氧化铁 Fe(OH)3 氢氧化亚铁 Fe(OH)2 氢氧化铜Cu(OH)2 乙酸 CH3COOH 甲烷 CH4 乙醇 C2H5OH 葡萄糖 C6H12O6 淀粉 (C6H10O5)n 蔗糖 C12H22O11 氯化钾 KCl 氯化钠 NaCl 氯化钡 BaCl2 氯化钙 CaCl2 氯化镁 MgCl2 氯化铝 AlCl3 氯化锌ZnCl2 氯化铁 FeCl3 氯化亚铁 FeCl2 氯化铜 CuCl2 氯化银AgCl 硫酸钾 K2SO4 硫酸钠 Na2SO4 硫酸钡 BaSO4 硫酸钙 CaSO4 硫酸镁 MgSO4 硫酸铝 Al2(SO4)3 硫酸锌 ZnSO4 硫酸铁Fe2(SO4)3 硫酸亚铁 FeSO4 硫酸铜 CuSO4 硫酸银 Ag2SO4 硝酸钾 KNO3 硝酸钠 NaNO3 硝酸钙 Ca(NO3)2 硝酸钡 Ba(NO3)2 硝酸镁 Mg(NO3)2 硝酸铝 Al(NO3)3 硝酸锌 Zn(NO3)2 硝酸铁Fe(NO3)3 硝酸亚铁 Fe(NO3)2 硝酸铜 Cu(NO3)2 硝酸银 AgNO3 高锰酸钾 KMnO4 锰酸钾 K2MnO4 氯酸钾 KClO3 碳酸钾 K2CO3 碳酸钠 Na2CO3 碳酸钙 CaCO3 碳酸钡 BaCO3 碳酸镁 MgCO3 碳酸锌ZnCO3 碳酸亚铁 FeCO3 碳酸银 Ag2CO3 氯化铵 NH4Cl 硝酸铵NH4NO3 硫酸铵 (NH4)2SO4 碳酸氢铵 NH4HCO3 碳酸铵 (NH4)2CO3 磷酸钙 Ca3(PO4)2三、常见的离子符号氧离子 O2- 氟离子 F- 硫离子 S2- 氯离子 Cl- 钠离子 Na+ 镁离子 Mg2+ 铝离子 Al3+ 钾离子 K+ 钙离子 Ca2+ 氢离子 H+ 锂离子 Li+ 铍离子 Be2+ 铁离子 Fe3+ 亚铁离子 Fe2+ 铜离子 Cu2+ MnO4-ClO3-NO3-锌离子 Zn2+ 银离子Ag+ 钡离子 Ba2+ 碘离子 I- 溴离子 Br- HCO3-MnO42-SO42-CO32-氢氧根离子 OH- 硝酸根离子氯酸根离子高锰酸根离子NH4+PO43-SO32-碳酸氢根离子硫酸根离子碳酸根离子锰酸根离子亚硫酸根离子磷酸根离子铵根离子4P+5O22P2O5 点燃四、化学方程式S+ O2 SO2点燃1、红磷在氧气中燃烧3Fe+2O2 Fe3O4点燃2、硫在氧气中燃烧2KMnO4 K2MnO4+MnO2 + O2↑ △3、铁丝在氧气中燃烧4、加热高锰酸钾2H2O22H2O+ O2↑ MnO22KClO32KCl+3O2↑ MnO2△5、过氧化氢溶液与二氧化锰混合2Hg + O22HgO2HgO2Hg +O2↑△△6、加热氯酸钾与二氧化锰的混合物7、在氧气中加热汞H2 + Cl22HCl点燃8、氧化汞受热分解9、氢气在氯气中燃烧2H2+ O22H2O点燃2H2O2H2↑+ O2↑ 通电10、氢气在氧气中燃烧2Mg+ O22MgO点燃11、电解水4Al+3O22Al2O3点燃12、镁条在氧气中燃烧2Cu + O22CuO△13、铝箔在氧气中燃烧H2 + CuO Cu+H2O△14、铜在空气中加热C+ O2 CO2点燃15、氢气还原氧化铜2C+ O22CO点燃16、木炭在氧气中完全燃烧C +2CuO2Cu+ CO2↑ 高温17、木炭在氧气中不完全燃烧3C +2Fe2O34Fe+3CO2↑ 高温18、碳还原氧化铜C + CO22CO 高温19、碳还原氧化铁C + H2O CO + H2 高温20、碳还原二氧化碳21、碳还原水蒸气CaCO3+2HCl CaCl2+CO2↑+H2O H2CO3CO2↑+ H2O22、实验室制取二氧化碳CaCO3 CaO + CO2↑ 高温23、碳酸分解CO2 + H2O H2CO324、工业上制备二氧化碳25、二氧化碳与水反应2CO+ O22CO2点燃CO2 + Ca(OH)2 CaCO3↓+ H2O26、检验二氧化碳的反应27、一氧化碳燃烧4CO + Fe3O43Fe +4CO2 高温CO + CuO Cu + CO2 △28、一氧化碳还原氧化铜29、一氧化碳还原四氧化三铁 CaO + H2O Ca(OH)2Na2CO3+2HCl2NaCl+ CO2↑+H2O30、灭火器的反应原理 CH4+2O2 CO2 +2H2O点燃31、氧化钙与水反应 C2H5OH +3O22CO2 +3H2O点燃32、甲烷燃烧33、乙醇(酒精)燃烧Zn + H2SO4 ZnSO4 + H2↑34、实验室制取氢气4Al +3O22Al2O335、铝常温下氧化Mg +2HCl MgCl2 + H2↑36、镁与盐酸反应2Al +6HCl2AlCl3 +3H2↑Zn +2HCl ZnCl2 + H2↑37、铝与盐酸反应Fe +2HCl FeCl2 + H2↑38、锌与盐酸反应Mg + H2SO4 MgSO4 + H2↑39、铁与盐酸反应40、镁与稀硫酸反应2Al +3H2SO4 Al2(SO4)3 +3H2↑41、铝与稀硫酸反应Fe + H2SO4 FeSO4 + H2↑42、铁与稀硫酸反应 Fe + CuSO4 Cu + FeSO443、铁与硫酸铜溶液反应 Zn + CuSO4 Cu + ZnSO444、锌与硫酸铜溶液反应2Al +3CuSO43Cu + Al2(SO4)345、铝与硫酸铜溶液反应 Cu +2AgNO32Ag + Cu(NO3)246、铜与硝酸银溶液反应 Al +3AgNO33Ag + Al(NO3)347、铝与硝酸银溶液反应 Fe +2AgNO32Ag + Fe(NO3)248、铁与硝酸银溶液反应3CO + Fe2O32Fe +3CO2 高温Zn +2AgNO32Ag + Zn(NO3)249、锌与硝酸银溶液反应50、工业上炼铁的反应原理。

最新苏教版化学九年级上册知识点(经典版)编制人:__________________审核人:__________________审批人:__________________编制单位:__________________编制时间:____年____月____日序言下载提示:该文档是本店铺精心编制而成的,希望大家下载后,能够帮助大家解决实际问题。
文档下载后可定制修改,请根据实际需要进行调整和使用,谢谢!并且,本店铺为大家提供各种类型的经典范文,如演讲稿、总结报告、合同协议、方案大全、工作计划、学习计划、条据书信、致辞讲话、教学资料、作文大全、其他范文等等,想了解不同范文格式和写法,敬请关注!Download tips: This document is carefully compiled by this editor. I hope that after you download it, it can help you solve practical problems. The document can be customized and modified after downloading, please adjust and use it according to actual needs, thank you!In addition, this shop provides you with various types of classic sample essays, such as speech drafts, summary reports, contract agreements, project plans, work plans, study plans, letter letters, speeches, teaching materials, essays, other sample essays, etc. Want to know the format and writing of different sample essays, so stay tuned!最新苏教版化学九年级上册知识点化学是一门很实用的自然学科,它与数学、物理等学科共同成为自然科学迅猛发展的基础。

化学用语测试姓名化学符号一、元素符号:氢氦碳氮氧氟氖钠镁铝硅磷硫氯氩钾钙锰铁铜锌银钡铂金汞碘二、元素和根的化合价:钾钠银钙镁钡锌铜铝铁(亚)铁氢氯氧氢氧根硝酸根硫酸根碳酸根铵根三、离子符号:钾离子钠离子银离子钙离子镁离子钡离子锌离子铜离子铁离子亚铁离子铝离子氢离子氯离子硫离子氢氧根离子硝酸根离子硫酸根离子碳酸根离子铵根离子四、化学式:单质:氧气氮气氢气氯气氦气氖气碳硫磷钾钠银铁铜氧化物:水二氧化碳一氧化碳二氧化硫五氧化二磷二氧化硅过氧化氢氧化钙氧化镁氧化铜氧化锌氧化铁氧化亚铁四氧化三铁氧化铝二氧化锰酸:盐酸硫酸硝酸碳酸碱:氢氧化钠氢氧化钙氢氧化钡氢氧化镁氢氧化铝氢氧化亚铁氢氧化铁氢氧化铜氨水盐:盐酸盐:氯化钠氯化钙氯化钾氯化亚铁氯化铁氯化铜氯化钡氯化镁氯化锌氯化铝氯化银氯化铵碳酸盐:碳酸钙碳酸钠碳酸钡碳酸钾碳酸镁碳酸氢铵碳酸氢钠碳酸氢钙硫酸盐:硫酸铜硫酸钙硫酸锌硫酸钡硫酸镁硫酸钠硫酸钾硫酸铝硫酸亚铁硫酸铁硫酸铵硫酸氢钠硝酸盐:硝酸钾硝酸银硝酸钠硝酸钡硝酸铜硝酸亚铁硝酸铁硝酸镁硝酸钙硝酸锌硝酸铝硝酸铵有机物:甲烷乙醇葡萄糖蔗糖其它:生石灰熟石灰(消石灰)烧碱(火碱、苛性钠)纯碱(苏打)小苏打石灰石(大理石)食盐尿素酒精胆矾(蓝矾)高锰酸钾锰酸钾氯酸钾干冰1.红磷(P)在空气中燃烧,发出色火焰,产生大量。
化学方程式为:。
2.硫(S)在氧气中燃烧,发出色火焰,产生的气体。
化学方程式为:。
3.木炭(C)在氧气中燃烧,发出色的光,产生能使澄清石灰水变浑浊的气体。
化学方程式为:。
4.铁丝在氧气中剧烈燃烧,火星四射,生成色固体四氧化三铁(Fe3O4)。
化学方程式为:。
5.过氧化氢(H2O2)溶液中加入少量二氧化锰(MnO2)时能加速分解放出。
化学方程式为:。
6.加热混有二氧化锰(MnO2)的氯酸钾(KClO3)固体时,放出,同时生成氯化钾(KCl)。
二氧化锰在这一反应中是剂。
化学方程式为:。
7.高锰酸钾(KMnO4)是一种色的固体,受热时放出,同时还生成锰酸钾(K2MnO4)和二氧化锰(MnO2)。



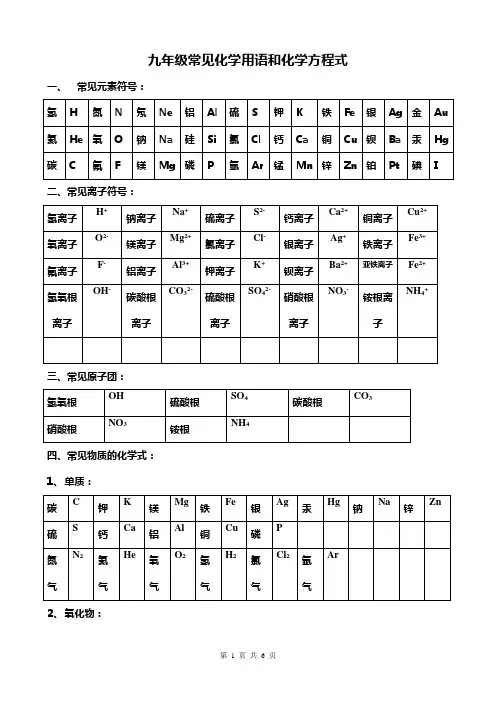
九年级常见化学用语和化学方程式五、课本中的化学方程式:第二单元:1、红磷在氧气中燃烧4 P + 5 O2 2 P2O52、碳在氧气中燃烧 C + O2CO23、硫在氧气中燃烧S + O2 SO24、铁在氧气中燃烧 3 Fe + 2 O2Fe3O45、铝在氧气中燃烧 4 Al + 3 O2 2 Al2O36、用过氧化氢制氧气 2 H2O2 2 H2O + O2↑7、用高锰酸钾制氧气2KMnO4K2MnO4+ MnO2+ O2↑8、用氯酸钾和二氧化锰的混合物制氧气 2 KClO3 2 KCl + 3 O2↑第三单元:9、水通电分解(电解水) 2 H2O 2 H2↑+ O2↑10、汞受热2Hg+O22HgO11、氧化汞受热分解2HgO2Hg+O2↑12、氢气在空气中燃烧 2 H2 + O2 2 H2O13、氢气还原氧化铜H2 + CuO Cu + H2O第四单元:第五单元:14、铁和硫酸铜溶液反应Fe + CuSO 4FeSO4 + Cu15、碳酸钠和盐酸反应Na 2CO3+2HCl2NaCl+H2O+CO2↑16、镁条在空气中燃烧 2 Mg + O2 2 MgO17、高温煅烧石灰石(二氧化碳的工业制法)CaCO3CaO + CO2↑第六单元:2 CO18、碳在氧气中不充分燃烧 2 C + O2 (不足)19、碳跟氧化铜反应 C + 2 CuO 2 Cu + CO2↑20、碳跟氧化铁反应 3 C + 2 Fe2O3 4 Fe + 3 CO2 ↑21、碳跟二氧化碳反应C+CO22CO+ 2HCl CaCl2 + CO2↑+ H2O22、实验室制取二氧化碳CaCO23、二氧化碳与水反应CO 2 + H2O H2CO324、碳酸分解H 2CO3CO2 ↑+ H2O25、二氧化碳与氢氧化钙溶液反应(二氧化碳的检验方法)CO 2 + Ca(OH)2CaCO3↓+ H2O26、一氧化碳燃烧 2 CO + O2 2 CO227、一氧化碳还原氧化铜CO +CuO Cu + CO228、一氧化碳还原氧化铁 3 CO +Fe2O3 2 Fe + 3 CO2第七单元:29、甲烷燃烧CH4 + 2 O2CO2 + 2 H2O30、酒精燃烧C2H5OH + 3 O2 2 CO2 + 3 H2O第八单元:31、镁和稀盐酸反应镁和稀硫酸反应Mg + 2 HCl MgCl+ H2↑Mg + H2SO4MgSO4 + H2↑32、锌和稀盐酸反应锌和稀硫酸反应(实验室制取氢气)Zn + 2 HCl ZnCl+ H2↑Zn + H2SO4ZnSO4 + H2↑33、铁和稀盐酸反应铁和稀硫酸反应+ H2↑Fe + H2SO4FeSO4 + H2↑Fe + 2 HCl FeCl34、铝和稀盐酸反应铝和稀硫酸反应+3H2↑2Al+ 3H2SO4Al2(SO4)3 +3 H2↑2Al+6HCl2AlCl35、铝和硫酸铜溶液反应 2 A l + 3 CuSO 4Al2(SO4)3 + 3CuCu(NO3)2 + 2 Ag36、铜和硝酸银溶液反应Cu + 2 AgNO第十单元:37、铁锈与稀盐酸反应铁锈与稀硫酸反应FeO3+6HCl2FeCl3+3H2O Fe2O3+3H2SO4Fe2(SO4)3+3H2O38、氧化铜与稀硫酸反应H2SO4+ CuO Cu SO4+ H2O39、氧化钙与水的反应CaO+HO Ca(OH)240、氢氧化钠溶液与二氧化碳反应2NaOH+CO 2Na2CO3+H2O41、二氧化硫与氢氧化钠溶液反应2NaOH+SO 2Na2SO3+H2O42、三氧化硫与氢氧化钠溶液反应2NaOH+SO 3Na2SO4+H2O43、氢氧化钠与盐酸反应氢氧化钠与硫酸反应NaOH+HCl NaCl+H 2O 2NaOH+H2SO4Na2SO4+H2O44、氢氧化钙与盐酸反应氢氧化钙与硫酸反应+2HCl CaCl2+2H2O Ca(OH)2+H2SO4CaSO4+2H2OCa(OH)第十一单元:45、碳酸氢钠与盐酸反应NaHCO 3+HCl NaCl+H2O+CO2↑CO3+Ca(OH)2CaCO3↓+2NaOH46、碳酸钠溶液与氢氧化钙溶液反应Na初中化学常见物质的颜色(后面是物质化学式或物质名称,前面是颜色)1. 常见物质的颜色:多数气体为无色,多数固体化合物为白色,多数溶液为无色。

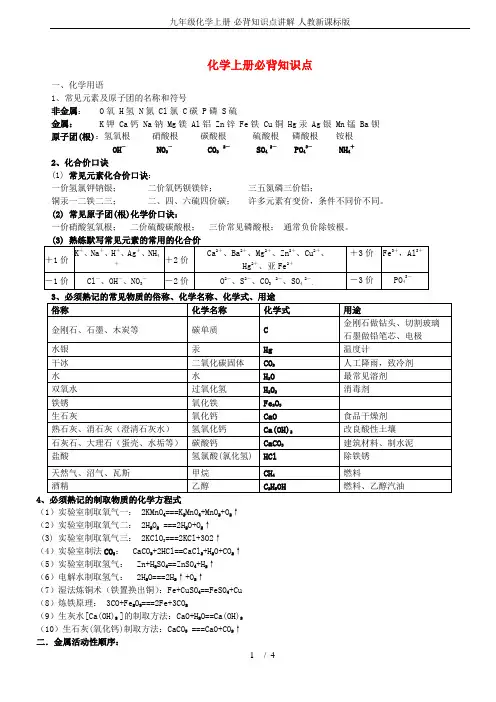
九年级化学上册必背知识点(鲁教版)九年级化学上册复习资料必背一化学用语 1.初中化学必背元素及其元素符号 (1)前20号元素(5个一组方便记忆) 原子序数 1 2 3 4 5 6 7 8 9 10 元素名称氢氦锂铍硼碳氮氧氟氖元素符号H He Li Be B C N O F Ne 原子序数 11 12 1314 15 16 17 18 19 20 元素名称钠镁铝硅磷硫氯氩钾钙元素符号 Na Mg Al Si P S Cl Ar K Ca (2)其他20个常见的元素及其元素符号元素名称钛锰铁铜锌溴碘氪氙氡元素符号 Ti Mn Fe Cu Zn Br I Kr _e Rn 元素名称镍银锡钡钨铂金汞铅镭元素符号 Ni Ag Sn Ba W Pt Au Hg Pb Ra 注意:书写元素符号时由一个字母表示的要大写;由两个字母表示的元素符号第一个字母必须大写第二个字母必须小写。
(3)元素周期表中一格的信息 2.原子和离子 (1)微粒结构示意图(以镁原子结构示意图为例) (2)原子结构示意图中最外层电子数的应用①相对稳定结构的判断:主要看最外层电子数是否为8(只有一个电子层时为2)等于8的结构稳定不等于8的结构不稳定。
②判断是否具有相似的化学性质:最外层电子数相同的原子的化学性质相似(氦除外)。
③得失电子能力的判断:最外层电子数最外层电子数>4易得到电子。
(3)根据微粒结构示意图判断某粒子是原子或离子的方法①核内质子数=核外电子数为原子。
②核内质子数>核外电子数为阳离子。
③核内质子数三铝四硅五价磷二三铁二四碳二四六硫都齐全;铜汞二价最常见莫忘单质都为零。
等 (2)常见原子团的化合价一价:铵根——NH 硝酸根——NO 氢氧根——OH-二价:碳酸根——CO 硫酸根——SO (3)化合物中化合价的计算①计算原则:化合物中各元素正负化合价代数和为零。
②计算步骤:以重铬酸钾(K2Cr2O7)为例求其中Cr元素的化合价。
化学上册必背知识点一、化学用语1、常见元素及原子团的名称和符号非金属: O氧 H氢 N氮 Cl氯 C碳 P磷 S硫金属: K钾 Ca钙 Na钠 Mg镁 Al铝 Zn锌 Fe铁 Cu铜 Hg汞 Ag银 Mn锰 Ba钡原子团(根):氢氧根硝酸根碳酸根硫酸根磷酸根铵根OH- NO3- CO32- SO4 2- PO43- NH4+2、化合价口诀(1) 常见元素化合价口诀:一价氢氯钾钠银;二价氧钙钡镁锌;三五氮磷三价铝;铜汞一二铁二三;二、四、六硫四价碳;许多元素有变价,条件不同价不同。
(2) 常见原子团(根)化学价口诀:一价硝酸氢氧根;二价硫酸碳酸根;三价常见磷酸根;通常负价除铵根。
4、必须熟记的制取物质的化学方程式(1)实验室制取氧气一: 2KMnO4===K2MnO4+MnO2+O2↑(2)实验室制取氧气二: 2H2O2 ===2H2O+O2↑(3) 实验室制取氧气三: 2KClO3===2KCl+3O2↑(4)实验室制法CO2: CaCO3+2HCl==CaCl2+H2O+CO2↑(5)实验室制取氢气: Zn+H2SO4==ZnSO4+H2↑(6)电解水制取氢气: 2H2O===2H2↑+O2↑(7)湿法炼铜术(铁置换出铜):Fe+CuSO4==FeSO4+Cu(8)炼铁原理: 3CO+Fe2O3===2Fe+3CO2(9)生灰水[Ca(OH)2 ]的制取方法:CaO+H2O==Ca(OH)2(10)生石灰(氧化钙)制取方法:CaCO3 ===CaO+CO2↑二.金属活动性顺序:金属活动性由强至弱:K Ca Na Mg Al , Zn Fe Sn Pb (H) ,Cu Hg Ag Pt Au。
(按5个一句顺序背诵)钾钙钠镁铝,锌铁锡铅(氢),铜汞银铂金。
三、常见物质的颜色、状态1、白色固体:MgO、P2O5、CaO、 NaOH、Ca(OH)2、KClO3、KCl、Na2CO3、NaCl、无水CuSO4;铁、镁为银白色(汞为银白色液态),除了有颜色的固体,其他固体一般为白色。

⼀、基本概念1. 物质的变化及性质(1)物理变化:没有新物质⽣成的变化。
①宏观上没有新物质⽣成,微观上没有新分⼦⽣成。
②常指物质状态的变化、形状的改变、位置的移动等。
例如:⽔的三态变化、汽油挥发、⼲冰的升华、⽊材做成桌椅、玻璃碎了等等。
(2)化学变化:有新物质⽣成的变化,也叫化学反应。
①宏观上有新物质⽣成,微观上有新分⼦⽣成。
②化学变化常常伴随⼀些反应现象,例如:发光、发热、产⽣⽓体、改变颜⾊、⽣成沉淀等。
有时可通过反应现象来判断是否发⽣了化学变化或者产物是什么物质。
(3)物理性质:物质不需要发⽣化学变化就能表现出来的性质。
①物理性质也并不是只有物质发⽣物理变化时才表现出来的性质;例如:⽊材具有密度的性质,并不要求其改变形状时才表现出来。
②由感官感知的物理性质主要有:颜⾊、状态、⽓味等。
③需要借助仪器测定的物理性质有:熔点、沸点、密度、硬度、溶解性、导电性等。
(4)化学性质:物质只有在化学变化中才能表现出来的性质。
例如:物质的⾦属性、⾮⾦属性、氧化性、还原性、酸碱性、热稳定性等。
2. 物质的组成原⼦团:在许多化学反应⾥,作为⼀个整体参加反应,好像⼀个原⼦⼀样的原⼦集团。
离⼦:带电荷的原⼦或原⼦团。
元素:具有相同核电荷数(即质⼦数)的⼀类原⼦的总称。
3. 物质的分类(1)混合物和纯净物混合物:组成中有两种或多种物质。
常见的混合物有:空⽓、海⽔、⾃来⽔、⼟壤、煤、⽯油、天然⽓、爆鸣⽓及各种溶液。
纯净物:组成中只有⼀种物质。
①宏观上看有⼀种成分,微观上看只有⼀种分⼦;②纯净物具有固定的组成和特有的化学性质,能⽤化学式表⽰;③纯净物可以是⼀种元素组成的(单质),也可以是多种元素组成的(化合物)。
(2)单质和化合物单质:只由⼀种元素组成的纯净物。
可分为⾦属单质、⾮⾦属单质及稀有⽓体。
化合物:由两种或两种以上的元素组成的纯净物。
(3)氧化物、酸、碱和盐氧化物:由两种元素组成的,其中有⼀种元素为氧元素的化合物。
苏教版化学九年级上册知识点大全苏教版化学九年级上册知识点1、构成物质的三种微粒是分子、原子、离子。
2、还原氧化铜常用的三种还原剂:氢气、一氧化碳、碳。
3、氢气作为燃料有三大优点:资源丰富、发热量高、燃烧后的产物是水不污染环境。
4、构成原子一般有三种微粒:质子、中子、电子。
5、构成物质的元素可分为三类即(1)金属元素、(2)非金属元素、(3)稀有气体元素。
6、铁的氧化物有三种,其化学式为(1)FeO、(2)Fe2O3、(3)Fe3O4。
7、化学方程式有三个意义:(1)表示什么物质参加反应,结果生成什么物质;(2)表示反应物、生成物各物质问的分子或原子的微粒数比;(3)表示各反应物、生成物之间的质量比8、收集气体一般有三种方法:排水法、向上排空法、向下排空法。
9、通常使用的灭火器有三种:泡沫灭火器;干粉灭火器;液态二氧化碳灭火器。
10、CO2可以灭火的原因有三个:不能燃烧、不能支持燃烧、密度比空气大。
11、单质可分为三类:金属单质;非金属单质;稀有气体单质。
12、当今世界上最重要的三大矿物燃料是:煤、石油、天然气。
煤干馏(化学变化)的三种产物:焦炭、煤焦油、焦炉气13、应记住的三种黑色氧化物是:氧化铜、二氧化锰、四氧化三铁。
14、氢气和碳单质有三个相似的化学性质:常温下的稳定性、可燃性、还原性。
15、教材中出现的三次淡蓝色:(1)液态氧气是淡蓝色(2)硫在空气中燃烧有微弱的淡蓝色火焰、(3)氢气在空气中燃烧有淡蓝色火焰。
16、三大气体污染物:SO2、CO、NO217、酒精灯的火焰分为三部分:外焰、内焰、焰心,其中外焰温度。
18、取用药品有“三不”原则:(1)不用手接触药品;(2)不把鼻子凑到容器口闻气体的气味;(3)不尝药品的味道。
19、可以直接加热的三种仪器:试管、坩埚、蒸发皿(另外还有燃烧匙)20、质量守恒解释的原子三不变:种类不改变、数目不增减、质量不变化21、与空气混合点燃可能爆炸的三种气体:H2、CO、CH4(实际为任何可燃性气体和粉22、原子中的三等式:核电荷数=质子数=核外电子数=原子序数苏教版化学九年级知识点化学用语1、常见元素及原子团的名称和符号非金属:O氧H氢N氮Cl氯C碳P磷S硫金属:K钾Ca钙Na钠Mg镁Al铝Zn锌Fe铁Cu铜Hg汞Ag 银Mn锰Ba钡原子团(根):氢氧根硝酸根碳酸根OH-NO3-CO32-硫酸根磷酸根铵根SO42-PO43-NH4+2、化合价口诀(1)常见元素化合价口诀:一价氢氯钾钠银;二价氧钙钡镁锌;三五氮磷三价铝;铜汞一二铁二三;六硫四价碳;许多元素有变价;条件不同价不同。
九年级上册化学知识点(完整版)九年级上册化学知识点1.物理变化和化学变化(1)物理变化:没有新物质生成的变化。
①宏观上没有新物质生成,微观上没有新分子生成。
②常指物质状态的变化、形状的改变、位置的移动等。
例如:水的三态变化、汽油挥发、干冰的升华、木材做成桌椅、玻璃碎了等等。
(2)化学变化:有新物质生成的变化,也叫化学反应。
①宏观上有新物质生成,微观上有新分子生成。
②化学变化常常伴随一些反应现象,例如:发光、发热、产生气体、改变颜色、生成沉淀等。
有时可通过反应现象来判断是否发生了化学变化或者产物是什么物质。
2.物理性质和化学性质(1)物理性质:物质不需要发生化学变化就能表现出来的性质。
①物理性质也并不是只有物质发生物理变化时才表现出来的性质;例如:木材具有密度的性质,并不要求其改变形状时才表现出来。
②由感官感知的物理性质主要有:颜色、状态、气味等。
③需要借助仪器测定的物理性质有:熔点、沸点、密度、硬度、第1页共7页溶解性、导电性等。
(2)化学性质:物质只有在化学变化中才能表现出来的性质。
例如:物质的金属性、非金属性、氧化性、还原性、酸碱性、热稳定性等。
实验仪器和操作一、药品的取用原则1.使用药品要做到“三不”:不能用手直接接触药品,不能把鼻孔凑到容器口去闻药品的气味,不得尝任何药品的味道。
2.取用药品注意节约:取用药品应严格按实验室规定的用量,如果没有说明用量,一般取最少量,即液体取1-2mL,固体只要盖满试管底部。
3.用剩的药品要做到“三不”:即不能放回原瓶,不要随意丢弃,不能拿出实验室,要放到指定的容器里。
4.实验时若眼睛里溅进了药液,要立即用水冲洗。
二、固体药品的取用1.块状或密度较大的固体颗粒一般用镊子夹取。
2.粉末状或小颗粒状的药品用钥匙(或纸槽)。
3.使用过的镊子或钥匙应立即用干净的纸擦干净。
三、液体药品(存放在细口瓶)的取用1.少量液体药品的取用---用胶头滴管吸有药液的滴管应悬空垂直在仪器的正上方,将药液滴入接受药液的仪器中,不要让吸有药液的滴管接触仪器壁;不要将滴管平放在实验台或其他地方,以免沾污滴管;不能用未清洗的滴管再吸别的试剂(滴瓶上的滴管不能交叉使用,也不需冲洗)2.从细口瓶里取用试液时,应把瓶塞拿下,倒放在桌上;倾倒液体时,应使标签向着手心,瓶口紧靠试管口或仪器口,防止残留在瓶口的药液流下来腐蚀标签。
精品基础教育教学资料,仅供参考,需要可下载使用!化学九年级上册知识点【导语】学习时集中精力,养成良好学习习惯,是节省学习时间和提高学习效率的最为基本的方法。
无忧考网搜集的《化学九年级上册知识点》,希望对同学们有帮助。
【篇一】化学九年级上册知识点1、构成物质的三种微粒是分子、原子、离子。
2、还原氧化铜常用的三种还原剂:氢气、一氧化碳、碳。
3、氢气作为燃料有三大优点:资源丰富、发热量高、燃烧后的产物是水不污染环境。
4、构成原子一般有三种微粒:质子、中子、电子。
5、构成物质的元素可分为三类即(1)金属元素、(2)非金属元素、(3)稀有气体元素。
6、铁的氧化物有三种,其化学式为(1)FeO、(2)Fe2O3、(3)Fe3O4。
7、化学方程式有三个意义:(1)表示什么物质参加反应,结果生成什么物质;(2)表示反应物、生成物各物质问的分子或原子的微粒数比;(3)表示各反应物、生成物之间的质量比8、收集气体一般有三种方法:排水法、向上排空法、向下排空法。
9、通常使用的灭火器有三种:泡沫灭火器;干粉灭火器;液态二氧化碳灭火器。
10、CO2可以灭火的原因有三个:不能燃烧、不能支持燃烧、密度比空气大。
11、单质可分为三类:金属单质;非金属单质;稀有气体单质。
12、当今世界上最重要的三大矿物燃料是:煤、石油、天然气。
煤干馏(化学变化)的三种产物:焦炭、煤焦油、焦炉气13、应记住的三种黑色氧化物是:氧化铜、二氧化锰、四氧化三铁。
14、氢气和碳单质有三个相似的化学性质:常温下的稳定性、可燃性、还原性。
15、教材中出现的三次淡蓝色:(1)液态氧气是淡蓝色(2)硫在空气中燃烧有微弱的淡蓝色火焰、(3)氢气在空气中燃烧有淡蓝色火焰。
16、三大气体污染物:SO2、CO、NO217、酒精灯的火焰分为三部分:外焰、内焰、焰心,其中外焰温度。
18、取用药品有“三不”原则:(1)不用手接触药品;(2)不把鼻子凑到容器口闻气体的气味;(3)不尝药品的味道。
苏教版化学九年级上册知识点苏教版化学九年级知识点化学用语1、常见元素及原子团的名称和符号非金属:O氧H氢N氮Cl氯C碳P磷S硫金属:K钾Ca钙Na钠Mg镁Al铝Zn锌Fe铁Cu铜Hg汞Ag银Mn锰Ba钡原子团(根):氢氧根硝酸根碳酸根OH-NO3-CO32-硫酸根磷酸根铵根SO42-PO43-NH4+2、化合价口诀(1)常见元素化合价口诀:一价氢氯钾钠银;二价氧钙钡镁锌;三五氮磷三价铝;铜汞一二铁二三;六硫四价碳;许多元素有变价;条件不同价不同。
(2)常见原子团(根)化学价口诀:一价硝酸氢氧根;二价硫酸碳酸根;三价常见磷酸根;通常负价除铵根。
(3)熟练默写常见元素的常用的化合价+1价K+、Na+、H+、Ag+、NH4++2价Ca2+、Ba2+、Mg2+、Zn2+、Cu2+、Hg2+、亚Fe2+ +3价Fe3+,Al3+-1价Cl-、OH-、NO3-3、必须熟记的制取物质的化学方程式(1)实验室制取氧气一:2KMnO4===K2MnO4+MnO2+O2↑(2)实验室制取氧气二:2H2O2===2H2O+O2↑(3)实验室制取氧气三:2KClO3===2KCl+3O2↑(4)实验室制法CO2:CaCO3+2HCl==CaCl2+H2O+CO2↑(5)实验室制取氢气:Zn+H2SO4==ZnSO4+H2↑(6)电解水制取氢气:2H2O===2H2↑+O2↑(7)湿法炼铜术(铁置换出铜):Fe+CuSO4==FeSO4+Cu(8)炼铁原理:3CO+Fe2O3===2Fe+3CO2(9)生灰水[Ca(OH)2]的制取方法:CaO+H2O==Ca(OH)2(10)生石灰(氧化钙)制取方法:CaCO3===CaO+CO2↑苏教版化学九年级上册知识点总结实验1、实验室制取氧气的步骤:“茶(查)、庄(装)、定、点、收、利(离)、息(熄)”“查”检查装置的气密性“装”盛装药品,连好装置“定”试管固定在铁架台“点”点燃酒精灯进行加热“收”收集气体“离”导管移离水面“熄”熄灭酒精灯,停止加热。
九年级化学用语
(包括元素符号、结构示意图、化合价、离子符号、化学式、化学方程式)
黔西县思源实验学校:白晋阳
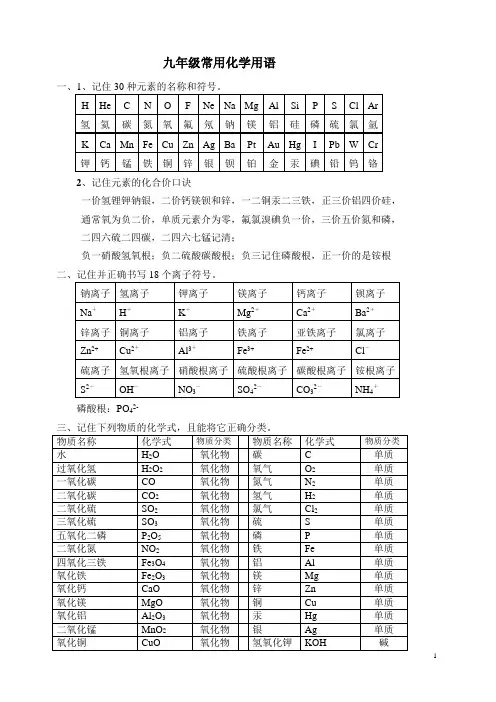
一、记住30种元素的名称和符号。
二、原子结构示意图
1~20号元素原子结构示意图
氢氦锂铍硼
H He Li Be B
碳氮氧氟氖
C N O F Ne
钠镁铝硅磷
Na Mg Al Si P
硫氯氩钾钙
S Cl Ar K Ca
三、常见元素和根在化合物中的化合价
一价氯银钠钾氢,-1 +1 +1 +1 +1
Cl Ag K Na H
-2 +2 +2 +2 +2
二价氧钙钡镁锌, O Ca Ba Mg Zn
+3 +4
铝三硅四要记住,Al Si
-2 -2
碳酸硫酸二价根,CO3SO4
-1 -1 +1
氢氧硝酸铵根一,OH NO3NH4
-3
还有三价磷酸根。
PO4
说明:
在初中化学中,具有可变化合价的元素是如下8种:
C N P S Cl Cu Fe Mn但是它们的化合价不用去记!
在初中化学中,除了以上根的化合价需要记住以外,
其它的根的化合价也不用去记。
四、常见离子符号(共25个):
Cl―(氯离子)、Ag+ (银离子)、K+ (钾离子) 、Na+ (钠离子)、H+ (氢离子)
O2-(氧离子)、Ca2+ (钙离子)、Ba2+ (钡离子)、Mg2+ (镁离子)、Zn2+ (锌离子)
Al3+ (铝离子)
CO32-(碳酸根离子)、SO42-(硫酸根离子)
OH-(氢氧根离子)、NO3-(硝酸根离子)、NH4+(铵根离子)
PO43-(磷酸根离子)
以及Fe2+ (亚铁离子)、Fe3+ (铁离子)、、Cu2+ (铜离子)、HCO3-(碳酸氢根离子)
MnO4-(高锰酸根离子)、MnO42-(锰酸根离子)、ClO3-(氯酸根离子)、SO32-(亚硫酸根离子)、
五、记住下列物质的化学式,且能将它正确分类
㈡、化合物
六、记住下列反应的化学方程式
㈠、化合反应
1、红磷在空气(或氧气)中燃烧:4P + 5O 2 2P 2O 5
2、氢气在空气中燃烧生成水:2H 2 + O 2 2H 2O
3、硫磺在空气(或氧气)中燃烧:S + O 2 SO 2
4、镁条在空气(或氧气)中燃烧:2Mg + O 2 2MgO
5、铁丝在氧气中燃烧:3Fe + 2O 2 Fe 3O 4
6、木炭在空气(或氧气)中完全燃烧:C + O 2 CO 2
7、木炭不充分燃烧:2C + O 2 2CO
8、一氧化碳燃烧:2CO + O 2 2CO 2
9、二氧化碳和水反应生成碳酸:CO 2 + H 2O == H 2CO 3 10、二氧化碳通过灼热的炭层:CO 2 + C 2CO 11、生石灰作为干燥剂:CaO + H 2O == Ca(OH)2
㈡、分解反应
11、高锰酸钾制氧气:2KMnO 4 K 2MnO 4 + MnO 2 + O 2↑ 12、氯酸钾制氧气:2KClO 3 2KCl + 3O 2↑ 13、双氧水制氧气:2H 2O 2 2H 2O + O 2↑ 14、电解水:2H 2O 2H 2↑+ O 2↑ 15、碳酸分解:H 2CO 3 H 2O + CO 2↑
16、高温煅烧石灰石(工业制取二氧化碳):CaCO 3 CaO +CO 2↑
点燃
点燃
点燃 点燃 点燃 点燃
高温 △ MnO 2 △
MnO 2 通电
高温 点燃 点燃
㈢、置换反应
17、铜和硝酸银溶液反应:Cu + 2AgNO 3 == 2Ag + Cu(NO 3)2 18、铁和硫酸铜溶液反应:Fe + CuSO 4 == Cu + FeSO 4 19、锌和硫酸反应制取氢气:Zn + H 2SO 4 == ZnSO 4 + H 2↑ 20、铝和稀硫酸反应:2Al + 3H 2SO 4 == Al 2(SO 4)3 + 3H 2↑ 21、木炭还原氧化铁:3C + 2Fe 2O 3 4Fe + 3CO 2↑
木炭还原氧化铜:C + 2CuO 2Cu + CO 2↑ 木炭还原四氧化三铁:2C + Fe 3O 4 3Fe +2CO 2↑ 氢气还原氧化铜:H 2 + CuO Cu + H 2O
㈣、复分解反应
A 、酸 + 碱 → 盐 + 水
22、氢氧化钠与盐酸反应:NaOH + HCl == NaCl + H 2O 23、氢氧化钠与硫酸反应:2NaOH + H 2SO 4 == Na 2SO 4 + 2H 2O 24、氢氧化铝治疗胃酸过多:Al(OH)3 + 3HCl == AlCl 3 + 3H 2O 25、氢氧化镁与硫酸反应:Mg(OH)2 + H 2SO 4 == MgSO 4 + 2H 2O
B 、酸 + 盐 → 新酸 + 新盐
26、盐酸与硝酸银溶液反应:HCl + AgNO 3 == AgCl ↓+ HNO 3
27、氯化钡溶液与硫酸溶液反应:BaCl 2 + H 2SO 4 == BaSO 4↓+ 2HCl 28、碳酸钠与稀盐酸:Na 2CO 3 + 2HCl == 2NaCl+ H 2O + CO 2↑ 碳酸氢钠与稀盐酸:NaHCO 3 + HCl == NaCl+ H 2O + CO 2↑ 29、石灰石与稀盐酸反应(实验室)制取二氧化碳:
CaCO 3+2HCl = CaCl 2+H 2O+CO 2↑
C 、碱 + 盐 → 另一种碱 + 另一种盐
30、硫酸铜溶液和氢氧化钠溶液反应:CuSO 4+2NaOH = Na 2SO 4+Cu(OH)2↓ 31、氯化铁溶液和氢氧化钠溶液反应:FeCl 3+3NaOH==Fe(OH)3↓+3NaCl
D 、盐 + 盐 → 两种新盐
高温 高温 高温 高温
32、硝酸银溶液与氯化钠溶液反应:AgNO 3 + NaCl == AgCl ↓+ NaNO 3 33、氯化钡溶液与碳酸钠溶液反应:BaCl 2+ Na 2CO 3 = BaCO 3↓+ 2NaCl
E 、金属氧化物 + 酸 → 盐 + 水
34、稀盐酸清洗铁锈:6HCl + Fe 2O 3 == 2FeCl 3 + 3H 2O 35、氧化铜与稀硫酸反应:CuO + H 2SO 4== CuSO 4+ H 2O
㈤、其他反应类型
A 、非金属氧化物 + 碱 → 盐 + 水
36、二氧化碳通入澄清石灰水中:CO 2 + Ca(OH)2 == CaCO 3↓+ H 2O 37、氢氧化钠在空气中变质:CO 2+ 2NaOH = Na 2CO 3 + H 2O 38、氢氧化钠溶液吸收二氧化硫:SO 2 + 2NaOH ==Na 2SO 3+ H 2O 39、氢氧化钠溶液吸收三氧化硫:SO 3 + 2NaOH ==Na 2SO 4+ H 2O
B 、其它情形
40、一氧化碳还原氧化铜:CO + CuO Cu + CO 2
41、一氧化碳还原氧化铁:3CO + Fe 2O 3 2Fe + 3CO 2↑ 42、一氧化碳还原四氧化三铁:4CO + Fe 3O 4 3Fe + 4CO 2↑ 43、酒精燃烧:C 2H 5OH + 3O 2 2CO 2 + 3H 2O 44、甲烷燃烧:CH 4 + 2O 2 CO 2 + 2H 2O
点燃
点燃 高温 高温。