初中化学第八单元复习课
- 格式:ppt
- 大小:921.50 KB
- 文档页数:31

初中化学第8章教案一、教学目标:1. 了解化学能的定义和性质。
2. 掌握化学反应中的能量变化规律。
3. 掌握化学反应的热效应计算方法。
二、教学重点:1. 化学能的概念和性质。
2. 化学反应中的能量变化规律。
3. 热效应的计算方法。
三、教学难点:1. 能量的种类和转化。
2. 化学反应中的热效应计算。
四、教学内容:1. 化学能的概念和性质(1)能量的种类及其转化(2)化学能的定义和单位2. 化学反应中的能量变化规律(1)放热反应和吸热反应(2)燃烧和腐蚀的能量变化3. 热效应的计算方法(1)反应热(2)标准生成焓的计算方法五、教学方法:1. 讲授相结合,引导学生观察、实验、发现。
2. 利用例题和练习加深学生对知识点的理解。
3. 小组讨论,促进学生合作学习和思维碰撞。
六、教学过程:1. 导入:通过引入一个日常生活中的实例,引起学生对能量转化的思考,引出本章主题。
2. 学习化学能概念和性质,探讨能量的种类和转化规律。
3. 学习化学反应中的能量变化规律,通过实例让学生掌握放热反应和吸热反应的特点。
4. 学习热效应的计算方法,通过例题分析演练,让学生掌握反应热和标准生成焓的计算方法。
5. 结束:对本节课的内容进行总结,强调化学反应中能量变化的重要性。
七、教学评价:1. 教师通过学生的课堂表现、练习和小组讨论,以及课后作业来评价学生的学习情况。
2. 学生之间相互评价,促进学生之间学习氛围的建立。
八、拓展延伸:1. 学生可通过实验观察更多不同物质间化学反应的能量变化情况,增强对化学反应的理解。
2. 学生可通过查阅资料,了解更多关于热化学和化学动力学等方面的知识,扩展对化学反应机理的认识。


九下化学第八单元知识点总结九年级化学第八单元主要涉及以下几个知识点的总结:1. 元素周期表,元素周期表是一张按照元素的原子序数排列的表格,包含了元素的符号、原子序数、相对原子质量等信息。
周期表按照元素的电子排布和化学性质进行分组,可以帮助我们理解元素之间的关系和规律。
2. 元素的周期性,元素周期表中的元素具有周期性特征。
周期表中的元素按照原子序数逐渐增加,原子结构和化学性质也会发生周期性变化。
例如,周期表中的元素周期性地变化着原子半径、电子亲和能、电离能等性质。
3. 元素的主族和副族,元素周期表中的元素可以分为主族元素和副族元素。
主族元素是周期表中1A、2A等组的元素,它们具有相似的化学性质,主要是因为它们的最外层电子数相同。
副族元素则是周期表中B族、3A族等组的元素。
4. 元素的离子化倾向,元素的离子化倾向是指元素失去或获得电子形成离子的趋势。
元素的离子化倾向与其原子结构和周期表位置有关。
一般来说,主族元素倾向于失去最外层电子形成阳离子,而副族元素倾向于获得电子形成阴离子。
5. 元素的化合价,元素的化合价是指元素在化合物中的价态或电荷数。
化合价可以通过元素的周期表位置和最外层电子数来推测。
主族元素的化合价通常等于其最外层电子数,而副族元素的化合价则需要考虑其电子亲和能和电离能等因素。
6. 元素的化合物,元素可以通过化学反应与其他元素结合形成化合物。
化合物是由两个或更多元素以确定比例结合而成的物质。
化合物的性质取决于所组成的元素以及它们之间的化学键类型。
以上是九年级化学第八单元的知识点总结,涵盖了元素周期表、元素的周期性、主族和副族元素、离子化倾向、化合价以及化合物等内容。
希望这个回答能够满足您的需求。

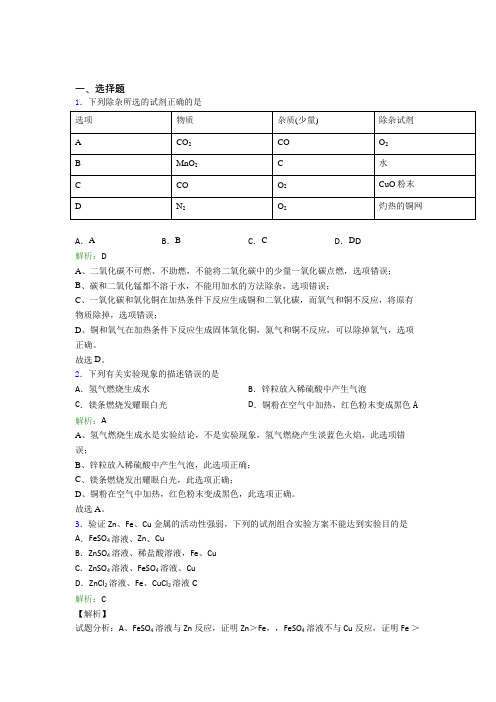
一、选择题1.下列除杂所选的试剂正确的是A.A B.B C.C D.D D解析:DA、二氧化碳不可燃、不助燃,不能将二氧化碳中的少量一氧化碳点燃,选项错误;B、碳和二氧化锰都不溶于水,不能用加水的方法除杂,选项错误;C、一氧化碳和氧化铜在加热条件下反应生成铜和二氧化碳,而氧气和铜不反应,将原有物质除掉,选项错误;D、铜和氧气在加热条件下反应生成固体氧化铜,氮气和铜不反应,可以除掉氧气,选项正确。
故选D。
2.下列有关实验现象的描述错误的是A.氢气燃烧生成水B.锌粒放入稀硫酸中产生气泡C.镁条燃烧发耀眼白光D.铜粉在空气中加热,红色粉末变成黑色A 解析:AA、氢气燃烧生成水是实验结论,不是实验现象,氢气燃烧产生淡蓝色火焰,此选项错误;B、锌粒放入稀硫酸中产生气泡,此选项正确;C、镁条燃烧发出耀眼白光,此选项正确;D、铜粉在空气中加热,红色粉末变成黑色,此选项正确。
故选A。
3.验证Zn、Fe、Cu金属的活动性强弱,下列的试剂组合实验方案不能达到实验目的是A.FeSO4溶液、Zn、CuB.ZnSO4溶液、稀盐酸溶液,Fe、CuC.ZnSO4溶液、FeSO4溶液、CuD.ZnCl2 溶液、Fe、CuCl2溶液C解析:C【解析】试题分析:A、FeSO4溶液与Zn反应,证明Zn>Fe,,FeSO4溶液不与Cu反应,证明Fe >Cu ,据此两个反应可以验证Zn 、Fe 、Cu 三种金属的活动性顺序为Zn >Fe >Cu ,正确;B 、Fe 能与稀盐酸溶液反应,证明Fe >H ,Cu 不与稀盐酸溶液反应,证明H >Cu ,据此两个反应证明Fe >Cu ,Fe 不与ZnSO 4溶液反应,证明Zn >Fe ,故据此三个反应可以证明三种金属的活动性顺序为Zn >Fe >Cu ,正确;C 、ZnSO 4溶液不与Cu 反应,证明Zn >Cu 、FeSO 4溶液不与Cu 反应,证明Fe >Cu ,但是无法证明铁与锌的金属活动性,错误;D 、ZnCl 2 溶液不与Fe 反应,证明Zn >Fe ,Fe 与CuCl 2溶液反应,证明Fe >Cu ,故据此两个反应即可证明Zn >Fe >Cu ,正确。

初中化学八单元复习教案一、知识目标1. 了解化学元素和化合物的基本概念;2. 熟悉各种化学元素和化合物的性质和用途;3. 能够区分化学元素和化合物之间的不同;4. 掌握化学方程式的写法和平衡方程式的基本原则。
二、能力目标1. 能够独立进行化学实验,正确操作实验仪器;2. 能够用化学知识解决日常生活中的问题;3. 能够运用化学知识,进行跨学科的学习和研究。
三、情感目标1. 培养学生对化学学科的兴趣和热爱;2. 培养学生团结协作的能力,积极参与实验和探究过程;3. 培养学生的探究精神和实践能力,培养他们解决问题的能力。
四、教学内容1. 化学元素和化合物的概念;2. 常见的化学元素和化合物;3. 化学反应的基本概念;4. 化学方程式的写法和平衡方程式的原则;5. 化合物的命名和分子式的表示。
五、教学方法1. 教师讲解与学生讨论相结合;2. 实验探究与理论知识相结合;3. 视频资料展示与课堂实践相结合;4. 小组合作学习和个人探究学习相结合。
六、教学过程1. 学生通过观看视频资料,了解化学元素和化合物的概念;2. 学生分组进行化学元素和化合物的性质实验,探究化合物的物理性质和化学性质;3. 学生学习化学方程式的写法和平衡方程式的原则,完成相关练习;4. 学生进行化学实验,观察化学反应的过程,学习化合物的命名和分子式的表示;5. 学生展示实验结果,讨论化学元素和化合物的应用;6. 教师总结课堂内容,巩固学生所学知识。
七、教学评价1. 学生通过课堂讨论和实验表现,了解化学元素和化合物的基本概念;2. 学生综合运用化学知识,解决相关问题;3. 教师对学生的实验数据和课堂表现进行评价,给予反馈和指导。
八、拓展延伸1. 学生可以通过参观化工厂或实验室,了解化学元素和化合物在生产中的应用;2. 学生可以选择一个化学元素或化合物进行研究,撰写一份调查报告。
以上为初中化学八单元复习教案范本,希望能帮助到你。
祝你教学顺利!。
化学初中第八单元讲解教案
教学目标:
1. 了解酸碱中和反应的概念和特点;
2. 掌握酸碱中和反应的化学方程式;
3. 能够运用化学方程式解答相关问题。
教学重点:
1. 酸碱中和反应的定义和特点;
2. 化学方程式的书写和解读。
教学难点:
1. 理解酸碱反应的电离过程;
2. 掌握酸碱中和反应的化学方程式。
教学准备:
1. 教师准备:课件、实验器材、教学实例等;
2. 学生准备:课本、笔记等。
教学流程:
一、导入:
教师简要回顾上节课学过的内容,引出酸碱中和反应的概念,激发学生学习兴趣。
二、讲解:
1. 酸碱中和反应的定义和特点;
2. 酸碱反应的电离过程;
3. 酸碱中和反应的化学方程式。
三、实验:
教师进行简单的酸碱中和反应实验,让学生亲自操作,观察实验现象,加深对酸碱中和反应的理解。
四、练习:
教师布置相关练习题,让学生在课堂上进行解答,帮助学生巩固所学知识。
五、总结:
教师对本节课的重点内容进行总结,强调学生应该掌握的知识点,鼓励学生多加练习,提高对酸碱中和反应的理解和运用能力。
六、作业:
布置相关作业,督促学生巩固所学知识。
教学反思:
本节课主要介绍了酸碱中和反应的概念和特点,通过实验和练习,帮助学生深入理解酸碱中和反应的机理和化学方程式。
教学过程中要注重激发学生的学习兴趣,引导学生主动思考和探索,提高学生的学习效果。