分子空间构型汇总
- 格式:pptx
- 大小:1.69 MB
- 文档页数:36

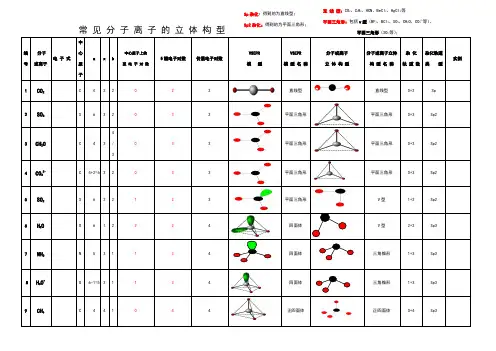
直 线 型:CO 2、C 2H 2、HCN 、BeCl 2、HgCl 2等平面三角形:包括v 型(BF 3、BCl 3、SO 3、CH 2O 、CO 32-等)、平面三角形(SO 2等);常 见 分 子 离 子 的 立 体 构 型编 号分子或离子电 子 式中心原子 axb中心原子上的孤 电 子 对 数 δ键电子对数价层电子对数VSEPR模 型VSEPR 模 型 名 称分子或离子 立 体 构 型分子或离子立体 构 型 名 称杂 化 轨 道 数 杂化轨道类 型实例1CO 2C 4 2 2 0 2 2直线型直线型0+2Sp2SO 3S 6 3 2 0 3 3平面三角形平面三角形 0+3 Sp23CH 2OC 4 3 4/333平面三角形平面三角形0+3Sp24CO 32-C 4+2=6 3 2 0 3 3平面三角形平面三角形 0+3 Sp25SO 2S 6 2 2 1 2 3平面三角形V 型1+2Sp26H 2OO 6 1 2 2 2 4四面体V 型2+2Sp37NH 3N 5 3 1 1 3 4四面体三角锥形1+3Sp38H 3O +O 6-1=5 3 1 1 3 4四面体三角锥形1+3Sp39CH 4C 4 4 1 0 4 4正四面体正四面体0+4Sp3OO Sp 杂化:得到的为直线型;Sp2杂化:得到的为平面三角形;10NH4+N5-1=441044正四面体正四面体0+4Sp3价层电子对=中心原子的孤电子对+δ键电子对数1、中心原子的孤电子对=1/2(a-xb)a:为中心原子的价电子数(原子:价电子数=原子最外层电子书;阳离子:中心原子的价电子数-离子的电荷数;阴离子:中心原子的价电子数+离子的电荷数)。




化学物质的空间构型在化学领域中,物质的空间构型是指分子中原子的排列方式和相互之间的空间关系。
了解和研究化学物质的空间构型对于理解分子性质、反应机理以及药物合成等方面具有重要意义。
本文将介绍几种常见的化学物质的空间构型及其相关概念。
一、线性构型线性构型是指分子中的原子沿着一条直线排列的方式。
典型的例子是氮气(N2)分子。
在氮气分子中,两个氮原子通过三重键连接,并且在同一条直线上排列。
除了氮气,一些其他的双原子分子,如氧气(O2)和碘气(I2)等,也具有线性构型。
二、平面构型平面构型是指分子中的原子排列在同一个平面内。
一个典型的例子是二氧化碳(CO2)分子。
在二氧化碳中,一个碳原子与两个氧原子通过双键连接,三个原子排列在一个平面上。
此外,苯分子(C6H6)也具有平面构型。
三、三角锥构型三角锥构型是指四个原子通过共享键排列成三角锥形状。
一个典型的例子是氨(NH3)分子。
在氨分子中,一个氮原子与三个氢原子通过共价键连接,氢原子排列在氮原子的周围形成三角锥形状。
四、四面体构型四面体构型是指五个原子通过共享键排列成四面体形状。
一个典型的例子是甲烷(CH4)分子。
在甲烷中,一个碳原子与四个氢原子通过共价键连接,氢原子均匀分布在碳原子的周围,形成一个四面体。
五、八面体构型八面体构型是指六个原子通过共享键排列成八面体形状。
一个典型的例子是硫酸(H2SO4)分子。
在硫酸中,一个硫原子与四个氧原子和两个氢原子通过共价键连接,形成一个八面体。
值得注意的是,以上所介绍的仅仅是化学物质的一些常见空间构型。
实际上,由于原子之间的各种相互作用,化学物质的空间构型有时会变得复杂和多样化。
通过实验技术,如X射线衍射和核磁共振,可以精确确定并确定化学物质的空间构型。
总结起来,化学物质的空间构型对于理解分子结构和性质具有重要作用。
通过研究和掌握不同构型的特点和性质,我们可以更好地理解化学反应的本质,并为药物合成和材料设计等领域的研究提供指导。

常见分子构型及杂化方式常见分子构型及杂化方式分子或离子配位原子数孤电子对数杂化方式VSEPR模型名称立体构型H2O 2 2 SP3 正四面体V形NH2- 2 2 SP3 正四面体V形NH3 3 1 SP3 正四面体三角锥形H3O+ 3 1 SP3 正四面体三角锥形CH4 4 0 SP3 正四面体正四面体形NH4+ 4 0 SP3 正四面体正四面体形SiCl4 4 0 SP3 正四面体正四面体形SO32- 3 1 SP3 正四面体三角锥形SO42- 4 0 SP3 正四面体正四面体形PO43- 4 0 SP3 正四面体正四面体形CHCl3 4 0 SP3 正四面体四面体形SO2 2 1 SP2 平面三角形V形BF3 3 0 SP2 平面三角形平面三角形SO3 3 0 SP2 平面三角形平面三角形CO32- 3 0 SP2 平面三角形平面三角形NO3- 3 0 SP2 平面三角形平面三角形NO2- 2 1 SP2 平面三角形V形CO2 2 0 SP 直线形直线形BeCl2 2 0 SP 直线形直线形HCN 2 0 SP 直线形直线形ABn型分子空间构型快速判断方法:1. n=2时,中心原子无孤对电子的是直线形,中心原子有孤对电子为V形,如CO2直线形,H2O为V形。
2. n=3时,中心原子无孤对电子的为平面三角形,有孤对电子的为三角锥形。
BF3为平面三角形,H3O+三角锥形。
3. n=4时,为正四面体。
中心原子价电子对数成键电子对数中心原子孤电子对数微粒空间构型实例2 2 0 CO2,BeCl2,HgCl2 33 0 BF3,SO32 1 SnCl2,SO2,O34 4 0 CH4,NH4+ 3 1 NH3,PCl3 2 2 H2O,OF2,ClO25 5 0 PCl5 4 1 SF4 3 2 BrF32 3 XeF2,I3-6 6 0 SF65 1 IF5,XeOF4 4 2 XeF4。
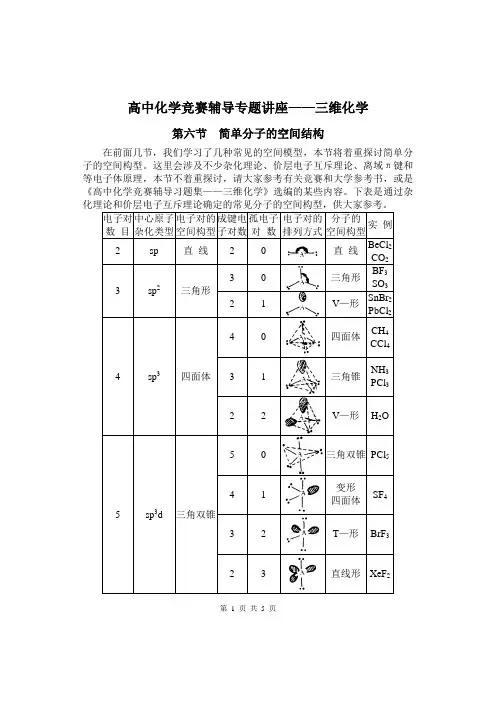
高中化学竞赛辅导专题讲座——三维化学第六节简单分子的空间结构在前面几节,我们学习了几种常见的空间模型,本节将着重探讨简单分子的空间构型。
这里会涉及不少杂化理论、价层电子互斥理论、离域π键和等电子体原理,本节不着重探讨,请大家参考有关竞赛和大学参考书,或是《高中化学竞赛辅导习题集——三维化学》选编的某些内容。
下表是通过杂第 1 页共 5 页【讨论】给出一个分子或离子,我们一般先找出中心原子,确定它的成键电子对数和孤电子对数,判断杂化类型和电子对构型,再判断分子或离子的构型。
由于等电子体具有类似的空间结构,我们也可以据此判断复杂的分子或离子的空间构型。
我们结合以下例题具体讨论。
【例题1】磷的氯化物有PCl3和PCl5,氮的氯化物只有NCl3,为什么没有NCl5?白磷在过量氯气(其分子有三种不同的相对分子质量)中燃烧时,其产物共有几种不同分子。
①【分析】PCl5中心原子P有3d轨道,能与3s、3p轨道一起参与杂化,杂化类型为sp3d,构型为三角双锥。
第二问是通过同位素来考察三角双锥的空间构型:“三角”是一个正三角形的三个顶点,等价的三个点;“双锥”是对称的两个锥顶。
P35Cl5的37Cl的一取代物可在角上和锥顶上2种情况;37Cl 的二取代物可在两个角上、两个锥顶上和一个角一个锥顶上3种情况;利用对称性,三取代物、四取代物与二取代物、一取代物是相同的。
共计有(1+2+3)×2=12种。
【解答】N原子最外层无d轨道,不能发生sp3d杂化,故无NCl5。
12种。
【练习1】PCl5是一种白色固体,加热到160℃不经过液态阶段就变成蒸气,测得180℃下的蒸气密度(折合成标准状况)为9.3g/L,极性为零,P-Cl键长为204pm和211pm两种。
继续加热到250℃时测得压力为计算值的两倍。
PCl5在加压下于148℃液化,形成一种能导电的熔体,测得P-Cl的键长为198pm和206pm两种。
(P、Cl相对原子质量为31.0、35.5)回答如下问题:①180℃下,PCl5蒸气中存在什么分子?为什么?写出分子式,画出立体结构。



一. 四种基本构型及简单变换:甲烷、乙烯、乙炔、苯1.甲烷的正四面体结构:在甲烷分子中,一个碳原子和任意两个氢原子可确定一个平面,其余两个氢原子分别位于平面的两侧,即甲烷分子中有且只有三原子共面(称为三角形规则)。
当甲烷分子中某氢原子被其他原子或原子团取代时,,可将它看作是原来氢原子位置。
CH 3CH 3左侧甲基和②C 构成“甲烷”分子,此分子中④H 、①C 、②C 构成三角形,同理①C 、②C 、③H 也构成了三角形,即乙烷分子中最多有2个碳原子(①C 、②C )和2个氢原子(③H 、④H )4个原子共面。
CH 3CH 2CH 3其结构式可写成如图2所示。
左侧甲基和②C 构成“甲烷分子”。
此分子中⑤H ,①C ,②C 构成三角形。
中间亚甲基和①C ,③C 构成“甲烷”分子。
此分子中①C ,②C ,③C 构成三角形,同理②C ,③C ,④H 构成三角形,即丙烷分子中最多三个碳原子(①C ,②C ,③C )两个氢原子(④H ,⑤H)五原子可能共面。
2.乙稀的平面结构:乙烯分子中的所有原子都在同一平面内,键角为120°。
当乙烯分子中某氢原子被其他原子或原子团取代时,则代替氢原子的原子一定在乙烯的平面内。
其结构式可写成如图4所示。
三个氢原子(①②③)和三个碳原子(④⑤⑥)六原子一定共面。
根据三角形规则[⑤C ,⑥C ,⑦H构成三角形]。
⑦H 也可能在这个平面上。
最多7原子共面。
同理可推出CH 3CH=CHCH 3至少6个原子,至多8个原子共面。
(CH 3)2C=C(CH 3)2至少6个原子(6个碳原子),至多10个原子共面(6个碳原子和4个氢原子),每个甲基可提供一个氢原子在乙烯平面.3.苯的平面结构苯分子所有原子在同一平面内, 键角为120°。
当苯分子中的一个氢原子被其他原子或原子团取代时,代替该氢原子的原子一定在苯分子所在平面内。
甲苯中的7个碳原子(苯环上的6个碳原子和甲基上的一个碳原子),5个氢原子(苯环上的5个氢原子)这12个原子一定共面。
(1)线性分子,中心原子为sp杂化,如乙炔。
(2)平面内的分子形如乙烯的,中心原子为sp2杂化。
(3)空间(正)四面体,中心原子sp3杂化,如四氯化碳。
(4)空间六面体(形如两个空间正四面体底对底拼在一起),中心原子为sp3d杂化。
(5)空间八面体(形如两个金字塔底对底拼在一起),中心原子为sp3d2杂化。
相关介绍:
分子的空间构型是指分子中各种基团或原子在空间分布的几何形状。
分子中的原子不是杂乱无章地堆积在一起,而是按照一定规律结合的整体,使分子在空间呈现出一定的几何形状(即空间构型)。
如果确定了某分子内化学键的键长和键角数据,那么这个分子的几何构型就确立了。
1940年美国的Sidgwick N.V.等人相继提出了价层电子对互斥理论,简称VSEPR法,该法适用于主族元素间形成的ABn型分子或离子。
该理论认为,一个共价分子或离子中,中心原子A周围所配置的原子B(配位原子)的几何构型,主要决定于中心原子的价电子层中各电子对间的相互排斥作用。
这些电子对在中心原子周围按尽可能互相远离的位置排布。
以使彼此间的排斥能最小。
所谓价层电子对,指的是形成σ键的电子对和孤对电子。
孤对电子的存在,增加了电子对间
的排斥力,影响了分子中的键角。
会改变分子构型的基本类型。
高中化学空间构型公式总结
空间构型是指分子中各原子的空间排列方式,对于化学反应的进行和化学性质的表现非常重要。
以下是高中化学中常见的空间构型公式总结:
1. 线性构型:分子中只有两个原子共面排列的构型,可用AX2类型代表。
2. 三角平面构型:分子中有三个原子共面排列的构型,可用AX3类型代表。
3. 均三角锥构型:分子中有四个原子排列成四面体的构型,可用AX4类型代表。
4. 二面角构型:分子中有四个原子排列成二面角的构型,可用AX3E或AX2E2类型代表。
5. 八面体构型:分子中有六个原子排列成八面体的构型,可用AX6类型代表。
6. 正四面体构型:分子中有五个原子排列成正四面体的构型,可用AX4E类型代表。
以上是高中化学中常见的空间构型公式总结,掌握这些构型可以帮助我们更好地理解化学反应和化学性质。
- 1 -。