双线桥和单线桥
- 格式:ppt
- 大小:303.00 KB
- 文档页数:6

氧化还原反应的表示法唐荣德反映氧化还原反应中电子转移情况有两种表示法:单线桥和双线桥。
(1) 单线桥(也叫单箭号)意义:表示电子转移的方向和总数(或:表示不同元素原子或离子间电子得失情况)。
它体现了“谁给谁”。
表示法:箭号一定在等式左边,箭头上只标明电子转移总数。
如:该表示法的特点是:箭头指向的物质为氧化剂。
对于自身氧化还原反应,则箭头指向的元素起氧化作用(2) 双线桥(也叫双箭号)意义:表示同一元素原子或离子间电子得失情况(或:表示电子得与失及氧化、还原过程)。
它体现了“谁变谁”。
表示法:箭号一定横跨等式两边,且不少于两根箭号。
在箭号上要标上“得到”或“失去”,也可以用“+”或“”来表示,然后写出具体的电子数目。
对于分子内的氧化还原反应,特别是歧化反应,使用单线桥不方便,用双线桥好。
双线桥易画,但麻烦;单线桥简单,能看出氧化剂。
双线桥可用在氧化还原反应方程式配平上。
在考试评分中,回答表示氧化还原反应的电子转移方向和数目或总数时,使用任一种表示法都算正确。
其实,单线桥和双线桥并不以线桥的多少来划分,有两根或三根线桥的不一定是单线桥,但双线桥却不可能只有一根线桥。
因此,要判断是哪种线桥,关键是看线桥是在等式的左边,还是横跨了等式的两边。
如:双线桥单线桥双线桥单线桥两种表示法也有多种形式,如硫铁矿燃烧的氧化还原反应方程式:以上分析可以看出,双线桥是分析法,可理解为是微观的;单线桥是综合法,可理解为宏观的。
要注意,以下容易标错的氧化还原反应方程式。
如铝与NaOH溶液反应,把NaOH当成氧化剂,且标示如下是错的:因为该化学方程式是总反应方程式,反应过程是铝先与水反应生成氢氧化铝和氢气,然后氢氧化铝和碱反应生成偏铝酸钠和水,前者是置换反应,水是氧化剂;后者是复分解反应,NaOH作为碱与酸反应,并不是氧化剂。
正确的应是如下表示法:又如浓硫酸与硫化氢反应,如下表示是错的:因为氧化还原反应是逐步氧化和逐步还原的,即2价的S首先变成0价的S,再氧化才升高到+4价的S,直到氧化为+6价的S;同理,+6价的S首先被还原,变成+4价的S,再还原降到0价的S,直至还原到2价的S。


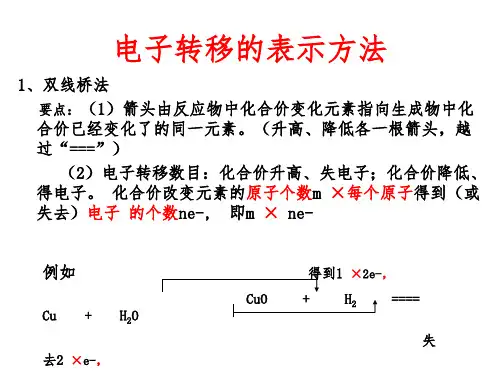
1、氧化还原反应的表示方法(1)双线桥法双线桥法是用两条线桥来表示氧化还原反应中化合价变化或电子转移方向和数目的方法。
方法如下:双线桥的箭头始于________有关元素,箭头指向发生________变化后生成物中对应元素。
在线上要标明“失去”或“得到”电子总数,化合价的升降以及该元素“被氧化”或“被还原”。
例如:(2)单线桥法单线桥法是用一条线桥来表示氧化还原反应中电子转移的方向和数目的方法。
箭号起点为________(失电子)元素,终点为________(得电子)元素,在线上只标转移电子总数,不标得与失。
例如:2、氧化剂和还原剂(1)氧化剂和还原剂的概念①从化合价角度定义:在氧化还原反应中,所含元素的化合价降低的反应物,称为氧化剂;所含元素的化合价升高的反应物称还原剂。
②从电子转移角度定义:在氧化还原反应中,得到电子(或电子偏向)的反应物,称为氧化剂;失去电子(或电子偏离)的反应物,称为还原剂。
(2)常见的氧化剂氧化剂是在化学反应中化合价容易________(或容易________)的物质。
常见的氧化剂有:①典型的非金属单质,如:F2、O2、Cl2、Br2(非金属活动性超强其氧化性就超强)。
②有变价元素的高价态化合物或离子,如:KMnO4、浓H2SO4、HNO3、H+。
③金属阳离子,如:Fe3+、Cu2+。
(3)常见的还原剂还原剂是在化学反应中化合价容易________(或容易_________)的物质。
常见的还原剂有:①典型的金属单质,如:K、Ca、Na、Mg(金属活动性超强其还原性就超强)。
②某些非金属单质及其化合物。
如:H2、C、CO。
③有变价元素的最低价态化合物或离子,如:H2S、HI、HBr、S2-、I-、Br-。
3、氧化产物和还原产物在氧化还原反应中,氧化剂得电子具有氧化性,起氧化作用,本身被还原后的生成物叫还原产物。
还原剂失电子具有还原性,起还原作用,本身被氧化,氧化后的生成物叫氧化产物。


双线桥与单线桥的方法归纳在交通工程中,桥梁是连接两个相对岸边的重要构筑物,为了满足交通需求,人们采用不同的桥梁设计和建设方案。
其中,双线桥和单线桥是常见的两种类型。
本文将对双线桥和单线桥的方法进行归纳总结,以便更好地了解和应用这两种桥梁设计。
一、双线桥的方法归纳双线桥是指在桥梁上设置两条行车线,分别供来往车辆通行。
为了提高桥梁的通行能力和安全性,设计师采用了一系列的方法。
1. 桥梁结构设计:双线桥的结构设计非常重要,需要考虑桥梁跨度、桥墩的布置、梁体材料等因素。
常见的结构形式包括梁式桥、拱桥、斜拉桥等,每种结构都有其适用的场景。
2. 车道划分与交通规划:在双线桥上,合理的车道划分和交通规划是必不可少的。
通过科学的交通规划,可以分流车流量,提高通行效率,并确保交通安全。
例如,可以划分左右两侧车道,设置交通信号灯和标线,保证车辆安全有序地通行。
3. 考虑行人和非机动车通行:在设计双线桥时,也要考虑到行人和非机动车的通行需求。
可以在桥梁两侧设置人行道或非机动车道,提供安全便捷的通行条件。
4. 引入智能交通系统:随着科技的发展,智能交通系统在双线桥的应用越来越广泛。
例如,可使用智能交通信号灯、远程监控和道路导航系统等,提高交通管理的效率和安全性。
二、单线桥的方法归纳单线桥是指在桥梁上只设置一条行车线,车辆通过时需要交替通行。
在设计和使用单线桥时,需要采取一些方法来保证交通的流畅和安全。
1. 设定优先通行规则:为了保证车辆在单线桥上有序通行,可以制定优先通行规则。
例如,可以规定交替通行的车辆交替让行,或者设立交通信号灯和指示标志来指导交通。
2. 信号控制和监测系统:在单线桥上,可以设置交通信号控制系统来调节车辆的通行。
利用传感器和监测设备,及时了解桥上车辆的情况,可以更好地控制交通流量,保证交通的顺畅和安全。
3. 合理的通行流程和时间:在单线桥上,合理的通行流程和时间安排是至关重要的。
可以根据交通量的变化,灵活调整通行的时间,避免交通拥堵和事故的发生。



反映氧化还原反应中电子转移情况有两种表示法:单线桥和双线桥。
(1) 单线桥(也叫单箭号)意义:表示电子转移的方向和总数(或:表示不同元素原子或离子间电子得失情况)。
它体现了“谁给谁”。
表示法:箭号一定在等式左边,箭头上只标明电子转移总数。
如:该表示法的特点是:箭头指向的物质为氧化剂。
(对于自身氧化还原反应,则箭头指向的元素起氧化作用)(2) 双线桥(也叫双箭号)意义:表示同一元素原子或离子间电子得失情况(或:表示电子得与失及氧化、还原过程)。
它体现了“谁变谁”。
表示法:箭号一定横跨等式两边,且不少于两根箭号。
在箭号上要标上“得到”或“失去”,也可以用“+”或“-”来表示,然后写出具体的电子数目。
对于分子内的氧化还原反应,特别是歧化反应,使用单线桥不方便,用双线桥好。
双线桥易画,但麻烦;单线桥简单,能看出氧化剂。
双线桥可用在氧化还原反应方程式配平上。
在考试评分中,回答表示氧化还原反应的电子转移方向和数目(或总数)时,使用任一种表示法都算正确。
其实,单线桥和双线桥并不以线桥的多少来划分,有两根或三根线桥的不一定是单线桥,但双线桥却不可能只有一根线桥。
因此,要判断是哪种线桥,关键是看线桥是在等式的左边,还是横跨了等式的两边。
如:双线桥单线桥双线桥单线桥两种表示法也有多种形式,如硫铁矿燃烧的氧化还原反应方程式:以上分析可以看出,双线桥是分析法,可理解为是微观的;单线桥是综合法,可理解为宏观的。
要注意,以下容易标错的氧化还原反应方程式。
如铝与NaOH溶液反应,把NaOH当成氧化剂,且标示如下是错的:因为该化学方程式是总反应方程式,反应过程是铝先与水反应生成氢氧化铝和氢气,然后氢氧化铝和碱反应生成偏铝酸钠和水,前者是置换反应,水是氧化剂;后者是复分解反应,NaOH作为碱与酸反应,并不是氧化剂。
正确的应是如下表示法:又如浓硫酸与硫化氢反应,如下表示是错的:因为氧化还原反应是逐步氧化和逐步还原的,即-2价的S首先变成0价的S,再氧化才升高到+4价的S,直到氧化为+6价的S;同理,+6价的S首先被还原,变成+4价的S,再还原降到0价的S,直至还原到-2价的S。


氧化还原反应中电子转移的表示方法1 双线桥法表明反应前后同一元素原子或离子间的电子转移情况。
(1)双线桥法的基本步骤(2)一般模型如:2 单线桥法表明反应前后元素原子间的电子转移情况。
(1)单线桥法的基本步骤(2)一般模型如:辨析比较双线桥法与单线桥法的比较1.双线桥法的“线桥”从反应物到产物,单线桥法的“线桥”只连反应物。
2.表示氧化还原反应中电子转移、化合价升降、物质被氧化或被还原等关系时,用双线桥法较方便;表示电子转移的方向和数目时,用单线桥法较方便。
典例详析例3-16(四川成都七中期中)下列氧化还原反应方程式中所标电子转移方向与数目错误的是()A.B.C.D.解析◆A反应中,铁元素的化合价升高(0→+2),失去2e-;氢元素的化合价降低(+1→0),得到2×e-,电子转移方向和数目均符合反应事实,A项正确。
B反应中,氮元素的化合价升高(+2→+5),失去4×3e-;氧元素的化合价降低(0→-2),得到6×2e-,电子转移方向和数目均符合反应事实,B项正确。
C反应中,氯元素的化合价由Cl2中的0价变为反应后Ca(ClO)2中的+1价,化合价升高,失去2×e-;氯元素的化合价由Cl2中的0价变为反应后CaCl2中的-1价,化合价降低,得到2×e-,电子转移方向和数目均符合反应事实,C项正确。
D反应中,氯元素的化合价由HCl中的-1价变为反应后Cl2中的0价,化合价升高,失去5×e-;氯元素的化合价由KClO3中的+5价变为反应后Cl2中的0价,化合价降低,得到5e-,题目中电子转移数目不符合反应事实,D项错误。
答案◆D例3-17(河南中原名校期中联考)工业上常用氨气为原料制备硝酸,其中有一步非常重要的反应为4NH3+5O24NO+6H2O,该反应的氧化剂为________,还原剂为________。
用单线桥法表示该氧化还原反应中电子转移的方向和数目:________________。
第20课时单线桥、双线桥法表示氧化还原反应●目标导航学习内容:氧化还原反应的表示方法学习重点:氧化还原反应的表示方法:双线桥法和单线桥法。
学习难点:电子转移数目的计算。
学习方法:讨论法、分析法、练习法●名师引领一. 氧化还原反应的表示方法(1)双线桥法:此法不仅能表示出电子转移的方向和总数,还能表示出元素化合价升降和氧化、还原的关系。
双线桥的箭头始于反应物有关元素的原子或离子,箭头指向发生化合价变化后生成物中对应元素的原子或离子。
在线上要标明“失去”或“得到”电子总数,化合价的升降以及该元素“被氧化”或“被还原”。
双线桥法的表示方法。
MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O(2)单线桥法:在氧化剂和还原剂之间表示电子转移关系。
在线上标出电子转移总数,箭头指出转移的方向。
电子转移的表示方法MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O注意两类特殊的化学反应。
①歧化反应,同种元素同价态在反应中部分原子化合价升高,部分原子化合价降低。
例:3Cl2+6KOHKClO3+5KCl+3H2O②归中反应。
不同价态的同种元素的原子在反应中趋于中间价态,解此类题最好将该元素的不同价态用数轴标出,变化的区域只靠拢,不重叠。
二.四种基本反应类型与氧化还原反应的关系(1)置换反应都是氧化还原反应。
(2)复分解反应都不是氧化还原反应。
(3)化合反应与分解反应部分是氧化还原反应,其中有单质参加的化合反应与有单质生成的分解反应肯定是氧化还原反应。
对氧化还原反应经历了由得氧失氧到化合价升降,再到电子转移这样一个逐步深化的过程。
通过这部分内容的学习,我们要重点理解氧化还原反应的实质是化学反应中发生了电子的得失或偏移,要学会从有无化合价升降的变化来判断一个反应是否是氧化还原反应,并能用单线桥或双线桥表示电子转移的方向和数目。
师生互动共解难题1.下列类型的反应,一定发生电子转移的是A.化合反应B.分解反应C.置换反应D.复分解反应答案:C[解析]:置换反应中肯定有单质参加,一定属于氧化还原反应,即一定有电子转移,C项正确。