单线桥和双线巧:氧化还原反应(初中化学方程式 )
- 格式:doc
- 大小:70.03 KB
- 文档页数:2


氧化还原反应单线桥画法【原创版】目录1.氧化还原反应概述2.氧化还原反应单线桥画法的概念3.氧化还原反应单线桥画法的步骤4.氧化还原反应单线桥画法的应用5.总结正文一、氧化还原反应概述氧化还原反应是化学中常见的一种反应类型,它涉及到原子、离子或分子的电子转移。
在氧化还原反应中,物质失去电子的过程被称为氧化,而获得电子的过程被称为还原。
氧化还原反应在自然界和工业生产中具有广泛的应用,如金属的腐蚀、电池的工作原理等。
二、氧化还原反应单线桥画法的概念氧化还原反应单线桥画法是一种用于描述氧化还原反应中电子转移过程的图形表示方法。
通过单线桥,我们可以直观地表示出反应物和生成物之间的电子转移过程,从而更好地理解氧化还原反应的实质。
三、氧化还原反应单线桥画法的步骤1.确定反应物和生成物:根据化学方程式,找出参与反应的物质以及它们在反应中的作用。
2.分析电子转移:根据反应物和生成物的氧化态变化,确定电子的转移方向和数目。
3.绘制单线桥:从还原剂(失去电子的物质)开始,沿着电子转移的方向,用一条线表示电子的转移过程。
在线的末端,标出被氧化的物质和所获得的电子数目。
4.检查电荷守恒:检查反应物和生成物的电荷总数是否相等,以确保电子转移过程符合电荷守恒定律。
四、氧化还原反应单线桥画法的应用氧化还原反应单线桥画法在化学教育和研究中具有重要作用,它可以帮助我们更好地理解氧化还原反应的电子转移过程。
此外,单线桥画法还可以应用于电化学、材料科学等领域,为相关研究提供直观的图形表示。
五、总结氧化还原反应单线桥画法是一种直观地表示氧化还原反应电子转移过程的图形方法。
通过分析反应物和生成物的氧化态变化,我们可以绘制出单线桥,从而更好地理解氧化还原反应的实质。


氧化还原反应编辑氧化-还原反应 (oxidation-reduction reaction, 也作redox reaction)是化学反应前后,元素的氧化数有变化的一类反应。
[1]氧化还原反应的实质是电子的得失或共用电子对的偏移。
氧化还原反应是化学反应中的三大基本反应之一(另外两个为(路易斯)酸碱反应与自由基反应)[2]。
自然界中的燃烧,呼吸作用,光合作用,生产生活中的化学电池,金属冶炼,火箭发射等等都与氧化还原反应息息相关。
研究氧化还原反应,对人类的进步具有极其重要的意义。
目录1理论发展2反应历程3氧化-还原平衡4判别5类型分子间分子内6规律7表示方法双线桥法单线桥法氧化-还原半反应式8举例燃烧酒精测试工业炼铁复分解反应9配平方法得失电子守恒法氧化数升降法离子/电子法待定系数法10应用与意义氧化还原性的强弱判定现实意义11与电化学的关系1理论发展18世纪末,化学家在总结许多物质与氧的反应后,发现这类反应具有一些相似特征,提出了氧化还原反应的概念:与氧化合的反应,称为氧化反应;从含氧化合物中夺取氧的反应,称为还原反应。
随着化学的发展,人们发现许多反应与经典定义上的氧化还原反应有类似特征,19世纪发展化合价的概念后,化合价升高的一类反应并入氧化反应,化合价降低的一类反应并入还原反应。
20世纪初,成键的电子理论被建立,于是又将失电子的半反应称为氧化反应,得电子的反应称为还原反应。
[2]1948年,在价键理论和电负性的基础上,氧化数的概念被提出,1970年IUPAC 对氧化数作出严格定义[1],氧化还原反应也得到了正式的定义:化学反应前后,元素的氧化数有变化的一类反应称作氧化还原反应。
注:氧化数又可以叫做氧化态,本词条使用前者。
氧化数即高中所说的化合价,这两者仅是叫法不同,部分表示方法有差别,其他并无区别,本词条中视为可以混用。
2反应历程氧化还原反应的实例——钠与氯气的反应[3]氧化还原反应前后,元素的氧化数发生变化。




氧化还原反应单线桥法例子
嘿,朋友们!今天咱就来好好唠唠氧化还原反应单线桥法例子。
咱先来说说氢气还原氧化铜这个例子啊。
氢气和氧化铜在一定条件下发生反应,氢气把氧化铜里的铜给还原出来啦,自己却变成了水。
这不就是一场精彩的“电子转移大战”嘛!用单线桥法来表示,哇塞,那可真是一目了然。
你看,从氢气这里画个箭头指向氧化铜,清楚地表明了电子是怎么从氢气转移到氧化铜的。
就好像是一场接力赛,氢气把“电子接力棒”传给了氧化铜!(氢气与氧化铜反应:H₂ + CuO → Cu + H₂O)
再想想铁和硫酸铜的反应吧!铁那么厉害,把硫酸铜里的铜离子给抢过来啦,自己变成了亚铁离子,硫酸铜变成了硫酸亚铁。
用单线桥法一表示,哎呀,明明白白的。
就像一场激烈的抢夺战,铁勇猛无比地抢走了属于铜的东西。
(铁与硫酸铜反应:Fe + CuSO₄ → FeSO₄ + Cu)
还有碳还原氧化铜呢!碳多牛啊,把氧化铜里的铜给弄出来了,自己变成了二氧化碳。
这单线桥法往上一用,电子的转移路径清晰得很呢!就像是碳这个勇士,一路披荆斩棘,成功夺得“宝藏”铜。
(碳与氧化铜反应:C + 2CuO → 2Cu + CO₂↑)
这些例子不都生动有趣吗?氧化还原反应单线桥法就是这么神奇,能让我们那么清楚地看到电子的“行动轨迹”。
是不是很有意思呀?我觉得啊,通过这些例子,我们能更好地理解氧化还原反应,更好地掌握单线桥法呢!所以呀,大家可得好好研究研究这些例子,把单线桥法玩转起来!。


第01讲 氧化还原反应【初中知识回顾】 一、化合价: 1.化合价规律(1)单质分子里,元素的化合价为0。
(2)化合价原则:在化合物里,元素正负化合价的代数和为0。
(2)在化合物里,通常不变价的元素是氢元素和氧元素,氢通常显+1价,氧通常显-2价。
(3)金属元素通常显正价,非金属元素通常显负价(非金属氧化物里,氧显负价,非金属元素显正价)。
(5)许多元素具有可变化合价。
例如:Fe 有+2、+3价;Cl 有-1、+1、+3、+5、+7价。
(6)原子团的化合价由构成元素原子的正负化合价的代数和算. 2.(背诵化合价表)一价氢氯钾钠银+1价, 二价氧-2钙钡镁锌+2价; 三铝+3四硅+4五价磷+5 , 二三铁+2、+3 二四碳+2、+4 ; 二四六硫都齐全,-2、0、+4、+6 铜汞二价最常见。
练习1:标出下列元素化合价(写在元素符号正上方)0 +2 +3 +2 +3 +6 ① Fe : Fe FeO Fe 2O 3 FeO·Fe 2O 3 Na 2FeO 4 0 +2 +4 +6 +7 ② Mn : Mn MnCl 2 MnO 2 K 2MnO 4 KMnO 4氢氧根离子:OH -硝酸根离子:NO 3-高锰酸根离子MnO 4-、 碳酸根离子:CO 3-2碳酸氢根离子:HCO 3-硫酸根离子:SO 4-2硫酸氢根离子:HSO 4- 亚硫酸根离子:SO 3-2亚硫酸氢根离子:HSO 3-硅酸根离子:SiO 3-2次氯酸根离子:ClO -高氯酸根离子:ClO 4-硫离子(氢硫酸根离子):S -2氢硫酸氢根离子:HS -铵根离子:NH 4+钾钠银铵氢:+1 钙镁铅钡锌:+2 铝:+3铁:+2、+3 铜:+1、+2 碳:+2、+4氮:–3、+1、+2、+3、+4、+5 磷:–3、+5硫:–2、+4、+6氯:–1、+1、+5、+7 锰:+2、+4、+6、+7 硅:–4、+4 氟溴碘:–1 氧:–1、–20 +2 +4 +4 –4③C:C CO CO2 CaCO3 CH4+4 +4 +4 –2 +6④S:SO2 SO32- Na2SO3 Na2S CuSO40 –1 +4 +1 +5 +7⑤Cl : Cl2KCl Cl2O ClO-ClO3-HClO4练习2:按表中要求填空:练习3.1.下列化合物中金属元素的化合价不为+2价的是()A.硫酸钙B.硝酸镁C.氯化铁D.氢氧化钡【解析】选C,氯化铁中铁为+3价。
第八讲 氧化还原反应一 从化合价的变化认识氧化还原反应1.写出碳还原氧化铜的化学方程式:C +2CuO=====高温2Cu +CO 2↑;请根据初中学习过的知识分析回答下列问题:(1)从得氧、失氧角度分析,发生氧化反应的物质是碳(得到氧生成了二氧化碳);该物质在反应前后,元素的化合价变化是碳元素的化合价升高,由0价升高到+4价。
(2)发生还原反应的物质是氧化铜(失去氧生成了铜);该物质在反应前后,元素的化合价变化 是铜元素的化合价降低,由+2价降低为0价。
(3)化合价的变化与氧化反应、还原反应之间有怎样的关系?答案2.请分析下列各反应中元素的化合价有无变化?若有变化,是如何变化的? (1)2NaOH +H 2SO 4===Na 2SO 4+2H 2O 答案 该反应中元素的化合价无变化。
(2)3CO +Fe 2O 3=====高温3CO 2+2Fe答案 有变化。
碳元素由+2价升高到+4价,(CO 得到氧)发生氧化反应;铁元素由+3价降低到0价,(Fe 2O 3失去氧)发生还原反应。
(3)Fe +CuCl 2===FeCl 2+Cu答案 有变化。
铁元素由0价升高到+2价,发生氧化反应(无氧参加);铜元素由+2价降低到0价,发生还原反应(无氧参加)。
归纳总结 1.有关概念(1)氧化反应是物质所含元素化合价升高的反应,还原反应是物质所含元素化合价降低的反应。
(2)氧化还原反应是凡有元素化合价升降的化学反应,非氧化还原反应是凡没有元素化合价升降的化学反应。
2.表现特征氧化还原反应的特征是元素的化合价发生变化,而得氧失氧只不过是其中的特例。
1.下列关于氧化还原反应的说法中正确的是( ) A.氧化还原反应前后元素化合价有升降 B.氧化还原反应前后一定有氧的得失C.实现Fe 3+―→Fe 2+的变化过程一定是氧化反应 D.元素化合价升高的反应是还原反应2.下列化学反应中,不属于氧化还原反应的是( ) A.Mg +2HCl===MgCl 2+H 2↑ B.2NO +O 2===2NO 2 C.CuO +H 2=====△Cu +H 2OD.CaCl 2+Na 2CO 3===CaCO 3↓+2NaCl二 从电子转移的角度认识氧化还原反应1.从电子得失角度分析写出钠与氯气反应的化学方程式:2Na +Cl 2=====点燃2NaCl ;在反应前后钠元素和氯元素的化合价各发生了怎样的变化?并根据它们的原子结构,分析讨论其化合价发生变化的原因。
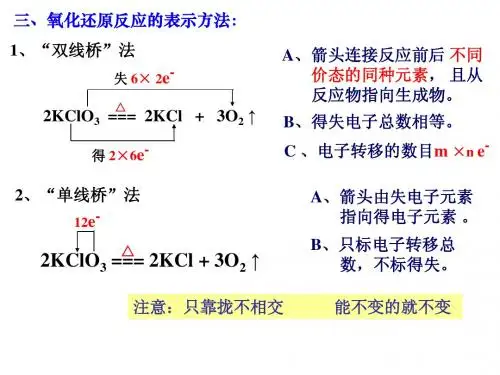
氧化还原反应的表示法唐荣德反映氧化还原反应中电子转移情况有两种表示法:单线桥和双线桥。
(1)单线桥(也叫单箭号)意义:表示电子转移的方向和总数(或:表示不同元素原子或离子间电子得失情况)。
它体现了“谁给谁”。
表示法:箭号一定在等式左边,箭头上只标明电子转移总数。
如:4e2H2S +S02= 3S + 2H a O1站fS -2 < -1 02 K Cl Q =2KC1+3 0a j该表示法的特点是:箭头指向的物质为氧化剂。
对于自身氧化还原反应,则箭头指向的元素起氧化作用(2)双线桥(也叫双箭号)意义:表示同一元素原子或离子间电子得失情况(或:表示电子得与失及氧化、还原过程)。
它体现了“谁变谁”。
表示法:箭号一定横跨等式两边,且不少于两根箭号。
在箭号上要标上“得到”或“失去”,也可以用“ +”或“ -”来表示,然后写出具体的电子数目。
-1茁2KC?133=2KC1 + |+1 2e-4e-2 +4 02H N S+3S + 2H2OI_____ J+牝+lOrI 1+T -1 +2 0 .2KMnO4+ It5HCl(浓)=2KC1 + 2MnCl2+ 5C13? + 8H3OI t-lOr对于分子内的氧化还原反应,特别是歧化反应,使用单线桥不方便,用双线桥好。
双线桥易画,但麻烦;单线桥简单,能看出氧化剂。
双线桥可用在氧化还原反应方程式配平上。
在考试评分中,回答表示氧化还原反应的电子转移方向和数目或总数时,使用任一种表示法都算正确。
其实,单线桥和双线桥并不以线桥的多少来划分,有两根或三根线桥的不一定是单线桥,但双线桥却不可能只有一根线桥。
因此,要判断是哪种线桥,关键是看线桥是在等式的左边,还是横跨了等式的两边。
如:4e*4旷12?I r两种表示法也有多种形式,如硫铁矿燃烧的氧化还原反应方程式: 牝-40r1 、 J+2 ・1 0 +: ?・24FeS 3 + 116 =2 Fea Os+注6tt4e~+44旷40e+ 斗F 1 2 -1eSs1X+3 -2=2Fei 5 +44 -a 8S0a+3 -1 4FeSsI0 + 11 Oi +3 2 —2Fea Os ++4 -1 8S0:一44旷+3 I+3 -2 -+4 -24FeSa +116= 2Fea O 3 + 3S0a丨tf+44c _以上分析可以看出,双线桥是分析法,可理解为是微观的;单线桥是综合法,可理解为 宏观的。
【学习目标】1、学习用双线桥法和单线桥法分析氧化还原反应 【学习重点】氧化还原反应本质和概念 【学习过程】[复习]常言“温故而知新”,请思考以下问题,并对下列反应做出判断: 1、什么是氧化还原反应?判断根据是什么?2CuO +H 2=====C u+H 2O MnO 2+4HCl(浓)======MnCl 2+H 2O +Cl 2↑ 属于氧化还原3NO 2+H 2O======2HNO 3+NO 的反应有哪些? 2H 2O 2======2H 2O +O 2↑CaCO 3+H 2O +CO 2====== Ca(HCO 3)22、下列叙述正确的是 ( )A 、在氧化还原反应中,失去电子的物质,所含元素化合价降低B 、凡是有元素化合价升降的化学反应都是氧化还原反应C 、在氧化还原反应中一定所有的元素化合价都发生变化D 、氧化还原反应的本质是电子的转移(得失或偏移)氧化还原反应的本质是电子的转移,如何在化学方程式上清楚地表示氧化还原反应的过程呢?一、氧化还原反应的表示方法之一-双线桥法 “双线桥”表示氧化还原反应。
(以Fe 2O 3+3CO高温2Fe +3CO 2,为例)①双线桥从左指向右连接不同价态的同种元素;②线上标明电子得失、化合价升降、被氧化、被还原等内容(注意得失电子守恒)。
例Fe 2O 3+3CO高温2Fe +3CO 2,练习1:用“双线桥”表示下列氧化还原反应,并指出发生氧化反应和还原反应的物质是什么?。
① Zn + H 2SO 4 = ZnSO 4 + H 2↑②2Al+3H 2SO 4======A l 2(SO 4)3+3H 2↑③ 2KClO 3 2KCl+3O 2↑思考:化学反应中,得到电子总数和失去电子总数有何关系?二、氧化还原反应的表示方法之一-单线桥法(1) 单线桥(也叫单箭号)意义:表示电子转移的方向和总数(或:表示不同元素原子或离子间电子得失情况)。
它体现了“谁给谁”。