常规石蜡切片中浸蜡包埋方法的改进
- 格式:pdf
- 大小:242.37 KB
- 文档页数:3

介绍一种改进的组织蜡块封存方法目的为提高日常工作中组织蜡块封存质量,缩短组织蜡块封存所需的时间。
方法对本科室当天切片后的100个组织蜡块利用石蜡包埋机的包埋盒预热槽和板台进行组织蜡块封存。
结果封存后的100个组织蜡块封存面光滑平整,耗时180 s 。
结论利用石蜡包埋机的包埋盒预热槽和板台进行组织蜡块封存效果显著,值得推广。
标签:改进;组织蜡块;封存方法众所周知,组织蜡块是宝贵的医学资料,是病理档案的重要组成部分,在病理科研和教学中发挥着举足轻重的作用,同时也是具有重要法律意义的物证,必须由专人按规定负责保管。
卫生部曾在2009年3月颁布的《病理科建设与管理指南(试行)》第十八条明确指出组织蜡块的保存期限为15年,甚至更久[1]。
在此期间,组织蜡块如果保存不当导致无法利用,就会造成严重后果。
因此,如何长期有效地保存组织蜡块是病理工作者尤其是病理技术人员的一项重要任务,保存蜡块最重要的是如何封存蜡块。
我们经过一段时间的摸索,不断总结经验,发现利用石蜡包埋机右侧的(习惯用左手者可以左侧)包埋盒预热槽和板台进行组织蜡块封存,操作快速、简便、封存效果理想,现报道如下。
1 材料与方法1.1 材料LEICA EG 1150H型石蜡包埋机1台;当天切片后的蜡块100个;熔蜡20 mL。
1.2 方法①首先使包埋机处于工作状态,将右侧的包埋盒预热槽温度设定在65°C,板台温度设定在60°C(图1)。
②将100个蜡块按顺序排放整齐,放置于包埋机右侧,用纸巾擦拭预热槽和板台,以免交叉污染。
③从石蜡槽中放取大约20 mL 左右熔蜡,倒入预热槽,使其底部有2 mm厚的溶蜡,右手拿起蜡块,使蜡块组织切面朝下,在预热槽底部蘸取熔蜡(图2)。
④拿起后迅速在包埋机板台上轻压划过(图3)蜡块切面表面则形成了一层平整的蜡膜。
封存后的蜡膜在数秒钟之内干燥(图4),按顺序排列归档。
图1 设定包埋机温度图2 蜡块蘸取熔蜡2 结果整个过程中100个组织蜡块封存时间仅耗时180 s,在此期间预热槽不需再加入溶蜡,100个组织蜡块仅需10 mL左右的熔蜡即可完成封存工序,无需其他设备、原料,外观蜡膜非常平整、光滑,蜡膜与蜡块结合非常牢固紧密。

石蜡包埋组织免疫荧光染色的技术改进发表时间:2013-04-11T14:06:13.500Z 来源:《医药前沿》2013年第4期供稿作者:陈琼霞陈莹黄萱刘丽江[导读] 石蜡包埋组织的免疫荧光染色技术,在基础研究以及临床病理诊断中仍发挥着重要的作用。
陈琼霞1 陈莹1 黄萱2 刘丽江2(通讯作者)(1江大病理诊断所技术部湖北武汉 430056)(2江大病理诊断所组织病理诊断部湖北武汉 430056)【摘要】目的探讨抗原修复方法在石蜡包埋组织免疫荧光染色中的应用。
方法石蜡切片经0.2%Triton X-100和0.5%Triton X-100梯度去垢剂(细胞表面活化剂)处理后,进行免疫荧光染色。
结果免疫荧光染色结果定位明确,无扩散效应和非特异性着色。
其染色强度接近石蜡包埋切片的免疫组化染色效果。
结论低浓度梯度去垢剂Triton X-100进行抗原修复,技术方法简单可行。
【关键词】免疫荧光染色抗原修复【中图分类号】R319 【文献标识码】A 【文章编号】2095-1752(2013)04-0368-02 石蜡包埋组织的免疫荧光染色技术,在基础研究以及临床病理诊断中仍发挥着重要的作用。
尤其是在多重标记物的定位、膜抗原的鉴定、抗体的类型(荧光标记抗体)、微量蛋白质的定位以及肾穿刺组织活检的病理诊断中具有非常重要的地位。
但是,组织经过福尔马林固定后,在固定的过程中Ca2+和其他二价离子与蛋白质所形成的紧密复合物,封闭了抗原,导致在石蜡切片上进行免疫荧光染色时,抗原抗体的结合受阻,直接影响染色结果的特异性和敏感性[1]。
在临床的实际工作中,常常又会遇到只有石蜡包埋的材料,而又必须进行免疫标记的情况。
如:肾穿刺活检组织冰冻切片中没有肾小球,不得不在石蜡包埋组织中解决诊断的问题等等[2-3]。
因此,在技术上解决石蜡包埋组织的免疫荧光染色问题,具有非常重要的临床应用价值。
我们采用去垢剂修复抗原法对石蜡切片进行抗原修复后,再行免疫荧光染色,取得了比较好的效果。

收稿日期:2005-09-27常规石蜡切片方法的改良杨捷频(中国科学技术大学生命科学学院,安徽合肥230027)摘要:针对传统石蜡切片方法中的缺陷,对制片方法进行了相应的改良。
总结了切片制作过程中可能存在的问题以及处理对策;提出了一些能缩短实验周期,解决实验有毒物质二甲苯污染的方案。
结合教学实践发现改良方案有助于提高石蜡切片的质量。
关键词:石蜡切片;组织学;改良方案中图分类号:Q336文献标识码:B文章编号:1008-9632(2006)01-0045-02石蜡切片是组织学、发育生物学研究的主要实验方法,同时也是病理学中观察病理变化的重要手段,为科研和临床诊断做出了卓越贡献。
该技术应用石蜡与动植物的组织能够很好地结合这一基本原理,经过标本采集、固定、脱水、透明、浸蜡、包埋、切片、摊片、贴片、烘片、脱蜡、染色、脱水、透明等一系列特殊的方法制成透明的薄片,在显微镜或电子显微镜下观察,可如实地反映机体的结构和形态变化;定量地测定样品中组织结构的大小、数量及所含物质的量的多少;同时,还可观察机体镜下结构或所含物质在不同实验条件下的变化,由此了解组织细胞的活动、分化以及细胞间的相互关系等[1~3]。
石蜡切片的制作过程并不复杂,但影响切片质量的因素是多方面的,要制出高质量的切片,每一个操作步骤都至关重要[4,5]。
经过长期的教学和科研实践,我们总结了石蜡切片制作中主要实验步骤的改良方法,本文将对石蜡切片制作各步骤中常遇到的影响切片质量的因素及相关的解决方法作重点介绍。
1固定固定的目的是为了使组织在石蜡切片制作过程中保持细胞的形态结构,使之与存活的原有形态和结构相似而不发生变形,因此应根据不同的观察目的选择特异性强的固定剂。
固定动物组织实验中通常采用10%中性福尔马林溶液为固定液,它不仅能完整地保存细胞生存时的形态结构,还可防止抗原的弥散。
小鼠、大鼠等动物的组织器官比较柔软细嫩,应将整个内脏器官投入固定液中整体固定4~6h,待组织稍硬化后再取材;其它动物脏器离体后可立刻取材,组织块以10@10@3mm大小为宜,取好的组织立刻投入固定液中固定组织6~12h。


中国乡村医药组织石蜡包埋改良方法的应用效果余波虞继红在苏木精-伊红染色的切片制作过程中组织包埋是一重要环节,在包埋过程中,我们常发现包埋完的蜡块不易被撬出,而撬出的蜡块四周带有大量残蜡,需费力地用刀削去,且易撬断。
笔者总结出一种组织包埋的改良方法,现报道如下:1 材料与方法1.1 材料与分组我院病理科2019年1月的病理标本,取材600个蜡块,其中大标本(直径>0.4cm)450个蜡块,小标本(直径≤0.4cm)150个蜡块,将标本随机分成传统组(225个大标本+75个小标本)和改良组(225个大标本+ 75个小标本),各300个。
1.2 方法传统组先往包埋模具中注入第1次蜡液,使蜡液注满包埋底模,置于热台上,放入组织,盖上包埋盒,再注入第2次蜡液,使蜡液的液面高度接近包埋盒上缘。
改良组首先将包埋机的注蜡流量调到适中,取出包埋盒置于包埋台的热台上并打开,左手取包埋模具注入第1次蜡液,包埋大标本时,蜡液液面不高于模具凹槽的上缘,包埋小标本时加适量即可,置于包埋台的冷台上。
右手持无齿镊将组织按正确方式放入模具中,压平整后迅速盖上包埋盒,进行第2次注蜡,蜡液液面没过包埋盒下缘,置于冷台,更换镊子,进行下一个包埋。
1.3观察指标两组单个蜡块耗蜡量、蜡块撬断量、撬出后蜡块质量。
1.4撬出蜡块质量评定标准甲级:四周边缘无残蜡;乙级:一边或两边仅有少量残蜡;丙级:一边有大量残蜡或三边以上有少量残蜡;丁级:两边及以上有大量残蜡。
1.5 统计学方法采用SPSS 18.0统计软件,计量资料以(x-±s)表示,采用t检验,计数资料采用χ2检验,P<0.05为差异有统计学意义。
2 结果2.1 两组耗蜡量比较传统组:大标本(5.1±0.6)g,小标本(4.2±0.4)g;改良组:大标本(3.9±0.5)g,小标本(2.5±0.3)g。
改良组大标本及小标本耗蜡量均少于传统组,差异有统计学意义(u=23.05、t=29.45,P<0.01)。


石蜡切片在中药制片中注意事项及方法改良邹江斌;卢建中;张娟娟【摘要】石蜡切片是组织学中应用最为广泛的常规制片技术,是鉴定和研究中药材重要的环节,是药学工作者必须掌握的技能之一。
但是要熟练掌握石蜡切片技术必须要对石蜡切片各个步骤要能做到精确把握,本文就石蜡切片中注意事项及存在的步骤改良加以总结,为能制作高效、合格的科研及教学用片奠定基础。
【期刊名称】《江西中医药》【年(卷),期】2013(000)012【总页数】2页(P71-72)【关键词】石蜡切片;方法;注意事项【作者】邹江斌;卢建中;张娟娟【作者单位】江西中医学院南昌330004;江西中医学院南昌330004;江西中医学院南昌330004【正文语种】中文【中图分类】S-3显微鉴定是中药材四大传统鉴定方法之一。
制作完整、均匀而薄的组织切片是确保科研工作者能够准确清晰看清组织构造,从而辨别药材真伪的前提条件。
石蜡切片具有简单易行,切片效果好,可以永久保存,普遍药材都适用等优点从而被广泛应用。
由于实验材料,试剂及方法等因素的影响,只要实验过程中某一过程处理不当都可以导致实验失败,在实际操作中还得对实验各个环节加以注意。
石蜡切片过程依次包括软化(干硬药材)、取材、固定、洗涤、脱水、透明、浸蜡、包埋,切片,贴片与烤片、脱蜡、复水、染色、脱水、透明、封片等。
本文总结了石蜡切片的某些过程的方法学改良和注意事项。
软化是指对干、硬药材的前处理。
实际工作中由于季节及地域的限制,我们很难及时弄到新鲜药材,因此我们常常采用干燥药材,这时我们就要对药材进行软化。
对于一些硬度不是很大的药材我们可以通过水浸泡,而对于药材硬度较大的药材就要通过其它方法处理。
据宗希明[1]报道,部分干燥药材采用适当溶剂软化可以得到良好效果。
如一般质地软,含薄壁组织较多,木化组织较少的材料可选用15%-20%甘油、50%-70%乙醇、甘油-乙醇溶液、冰乙酸-乙醇溶液浸泡软化。
质地硬,组织排列密度大,含纤维、石细胞、木栓化、木质化组织较多的材料可选用15%-20%甘油、甘油-乙醇溶液、18%氨水溶液浸泡软化。

石蜡切片制作方法的改良作者:毛晓霞来源:《安徽农学通报》2013年第08期摘要:创立了一种时间短、质量高的石蜡切片制作方法。
针对动植物材料结构特点不同,在脱水、透明、透蜡、包埋、染色和封固等环节进行了一系列改良,获得了染色清晰、组织结构完整的切片。
该文以小蜡树为例,详细介绍了改良后的石蜡切片制作方法。
实验结果表明,相比传统制作方法,改良后的制作方法减少了切片制作时间,缩短了实验周期。
同时,有效地提高了批量制备石蜡切片标本的整体质量,有利于实验教学和组织学、病理学等领域的研究工作。
关键词:组织学;石蜡切片;制作方法:改良中图分类号 Q-34 文献标识码 A 文章编号 1007-7731(2013)08-15-02石蜡切片制作技术近年来广泛应用于组织学、细胞生物学、法医学和病理学等领域。
细胞和组织多为无色透明,离开机体后会很快发生溶解和腐败,细胞原始形态和结构难以保存[1]。
通过石蜡切片制作技术,经过脱水、透明、浸蜡、包埋、切片、染色及封固等步骤,可以清晰辨认其形态结构,增加样品不同细胞成分之间的对比度。
但缺点是石蜡切片制作过程复杂,制作周期长,组织块易破碎,切片皱褶多等[2]。
笔者通过长期的摸索,改进了常规石蜡切片制作方法,缩短了时间,并将重点步骤加以改良,以利于短时间制作出高质量的切片。
本文以小蜡树为例,将改良后的石蜡切片制作方法介绍如下。
1 材料与方法1.1 材料小蜡树叶片采自安庆师范学院植物园。
试验仪器:石蜡切片机Leica RM2235、恒温培养箱、水浴锅、光学显微镜。
试验试剂:无水乙醇、95%乙醇、丙酮、二甲苯、石蜡为上海标本模型厂生产,熔点56~58℃,中性树胶为上海生工产品,其余试剂均为国产分析纯。
1.2 方法1.2.1 取材与固定摘取幼嫩的小蜡树叶片,拿双面刀片,过叶片主脉做横切面,切成1cm×1cm大小,取材后立即投入carnoy固定液中固定。
4℃保存,固定7d,可以延长固定时间,但最长不超过两周[3]。

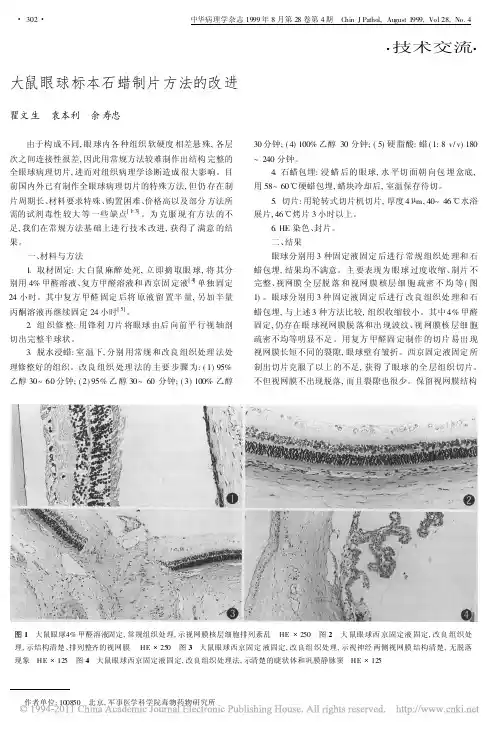
石蜡包埋制作眼球切片方法改良1张祥令,苏敏*2,黄悦,胡蓉, 许爱萍,李红(550004 贵阳,贵阳医学院组织学与胚胎学教研室)【摘要】目的:探讨和改良石蜡包埋制作眼球切片方法。
方法:取健康猫眼球10只,AFA (甲醛-乙醇-冰醋酸)固定液固定,乙醇梯度脱水,氯仿透明,石蜡包埋制作眼球切片,厚度7µm,HE染色,观察并记录。
结果:(1)石蜡包埋的眼球不变形,外观无明显收缩,结构完整,可获得整个眼球;(2)HE染色切片观察,眼球壁各层结构清晰,角膜、角膜缘、巩膜静脉窦、睫状肌等组织结构完整,视网膜无明显剥离、层次清楚,各层细胞排列整齐、容易辨认。
结论:采用此方法对眼球进行石蜡包埋,可获得较满意的眼球组织切片。
【关键词】眼球;石蜡包埋;改良;猫The improvement of method in making bulbus oculi section by paraffin imbedding. Zhang XiangLing, SU Min, XU AiPing,Huang Y ue, Li Hong, Hu Rong (Department of Histology and Embryology, Guiyang Medical College, Guiyang 550004, China)[Abstract] Objective To study the improvement of methods in making bulbus oculi section by paraffin imbedding. Methods 10 samples of healthy cat were collected, which were fixed by formaldehyde - alcohol - glacial acetic acid fixation fluid, and dehydrated with differented concentration of alcohol fluid. Then they were transparented by chloroform fluid, and imbeded by paraffin for making sections of 7µm thickness. At last the structure were observed by Hematoxlin-Eosin staining. Results (1) The shape of bulbus oculi were not variable and obviously shrinked by paraffin imbedding. We could obtain integral bulbus oculi tissue and keep their structure completement with this method. (2) the structure of every layer in bulbus oculi wall were clear. And the tissue strcture of cornea, limbus corneae, canalis schlemmi,ciliaris muscle were integrated. At the same time, the retina were not manifest decoherenced, their cells were lined up in order and easy to recognize , and the discus nervi optici could be displayed well. Conclusion We can obtain satisfied bulbus oculi tissue section by this improved method .[Key words] bulbus oculi;paraffin imbedding;improvement;cat1[基金项目] 贵州省自然科学基金,黔科合J字(2006)20822[通讯作者]苏敏,电话(0851)6908567.E-mail:**************眼球的结构外形近似球体,外层巩膜是致密的结缔组织,内层视网膜很柔软,容易剥离脱落,眼球腔中还有一个很硬的晶状体,其制作过程在组织学上是难点[1-2],传统用火棉胶包埋时,费时至少要三月,试剂易燃,毒性强,成本高,不能连续切片,切片较厚,而常规石蜡包埋切片,眼球易变硬变脆变形,视网膜容易剥离,不利于教学切片补充和组织病理学诊断[3-7]。

收稿日期:2010-01-06;修回日期:2010-01-18基金项目:十一五科技支撑项目(2006BAD07B06-10)作者简介:姜建福(1982-),男,硕士,汉族,主要从事果树栽培生理生态研究;通讯作者:方金豹(1963-),男,博士,汉族,研究员,E ma i :l jf ang @pub li c2 zz ha cn 。
do i 10.3969/j issn 1008-9632.2011 01 085植物石蜡切片包埋、修蜡过程的改进姜建福,赵长竹,方金豹(中国农业科学院郑州果树研究所 中国农业科学院果树生长发育与品质控制重点开放实验室,河南郑州450009)摘 要:传统的石蜡切片包埋、修蜡操作过程耗时费力。
采用金属框替代纸质包埋盒进行组织包埋,将蜡块冷水冷却改为自然冷却,趁蜡块未完全变硬之前进行快速修整。
该方法不仅提高了实验效率,而且修出的蜡块工整一致,同时对后面的切片过程无任何影响。
关键词:石蜡切片;包埋;修蜡;改进中图分类号:Q -336文献标识码:B文章编号:1008-9632(2011)01-0085-02Improve m ent i n paraffi n e mbedding and finis hingJIvANG Jian fu ,Z HAO Chang zhu ,FANG Ji n bao(K ey Laboratory f or Fruit T ree G ro w th ,D evel op m e nt and Q uality Contro,l Zhengzhou Fruit R esearc h I nst itute ,CAA S ,Zhengzhou 450009,China)Abstrac t :The traditiona l pa ra ffi n e mbedd i ng and fi n ishi ng was ti m e consu m i ng and l abo rious .The tissues w ere e m bedded by using m eta l fra m e i nstead o f pape r box ,na t ura l coo li ng i nstead of hydro coo ling ,repa i red para ffi n block qu i ckly before it turned harden co m p l etely .T h i s m ethod no t only enhanced the exper i m ental effic i ency but a l so un ifor m ed size of block .T here w as no any i nfl uence on late r process .K eywords :para ffi n sec tion ;e m bedd i ng ;paraffi n fi nish i ng ;i m prove m ent石蜡切片法是生物学中一种基础实验方法,广泛用于多个学科领域的研究,但其制作过程繁琐,包括脱水、透明、浸蜡、包埋、修蜡、切片、展片、染色、封片等一系列步骤,并且各步互相关联,任何一个环节出现差错都会影响整个实验的进程和质量[1-4]。
石蜡切片方法的改良赵亚林;闫青地;冯佳佳;肖锋;杨卓;王凤茹;董金皋【摘要】[目的]快速且安全高效制作石蜡切片.[方法]采用不同的方法,对植物材料进行透明和脱蜡以及包埋处理,把材料制成透明的玻片标本,利用正丁醇代替二甲苯作为透明剂和脱蜡剂,其他和传统的石蜡切片方法相同.[结果]正丁醇既能与乙醇混合,又能与中性树胶相融合;正丁醇作用相对较缓和,透明后的组织平整,没有明显的收缩、变形现象,并且不存在透明时间过长的问题,还减少了对实验人员的伤害.[结论]该方法可以快速地制作石蜡切片,且安全有效.%[Objective] The aim was to make paraffin section safely and fast.[Method] Different methods were used to transparent and dewax the plant material and embedding,and the material was made into a transparent glass slide,and the n-butanol could instead of xylene.The other steps were the same as the traditional paraffin section method.[Result] The n-butanol not only could be mixed with ethanol,but also could be mixed with neutral gum.The n-butanol was relatively gentle,could obtain transparent tissue after formation,had no obvious shrinkage,deformation and transparent problem of long time,and reduced the damage to experimental staff.[Conclusion] The method could make paraffin section safely and fast.【期刊名称】《安徽农业科学》【年(卷),期】2017(045)032【总页数】3页(P6-8)【关键词】石蜡切片;透明剂;正丁醇;花【作者】赵亚林;闫青地;冯佳佳;肖锋;杨卓;王凤茹;董金皋【作者单位】河北农业大学生命科学学院/河北省植物生理与分子病理学重点实验室,河北保定071001;河北农业大学生命科学学院/河北省植物生理与分子病理学重点实验室,河北保定071001;河北农业大学生命科学学院/河北省植物生理与分子病理学重点实验室,河北保定071001;河北农业大学生命科学学院/河北省植物生理与分子病理学重点实验室,河北保定071001;河北农业大学生命科学学院/河北省植物生理与分子病理学重点实验室,河北保定071001;河北农业大学生命科学学院/河北省植物生理与分子病理学重点实验室,河北保定071001;河北农业大学生命科学学院/河北省植物生理与分子病理学重点实验室,河北保定071001【正文语种】中文【中图分类】S-03石蜡切片是植物或者动物组织学常规制片技术中最为广泛应用的方法。
HE染色封固时出现的问题及解决方法支喜兰1 谭德银2 (1西安解放军323医院病理科 710054 2陕西省高级人民法院司法技术室病理组)【中图分类号】 R361.2 【文献标识码】 B 【文章编号】1007-8096(2000)04-0303-01 要获得一张满意的HE切片,除与取材、切片、染色关系密切外,封固也是很重要的一个步骤。
我们在观察切片中,发现有许多与封固有直接关系的质量问题,影响病理诊断。
作者根据多年的制片经验,就封固中出现的问题进行总结:1 类似色素样颗粒(俗称空气色素)即在封固干燥后,切片中出现类似色素样颗粒,散在或呈片状,圆形或不规则形,易被误认为黑色素或甲醛色素沉着。
但这种类似色素样的物质分布无规律,可在任何组织切片中出现。
其产生的原因是切片染色后,封固时切片中的二甲苯已完全挥发,中性树胶封固剂不能完全封固而形成的组织片干燥的空气气泡或腔隙。
1.1 导致气泡或腔隙产生的诱因1.1.1 操作者为了减少二甲苯的吸收,习惯于将切片从二甲苯中取出,待二甲苯挥发后再封固。
或切片很多,封固开始并未出现此情况,待二甲苯基本挥发或完全挥发,组织干燥后封固可出现。
1.1.2 树胶封固剂过稀,封固当时并不出现,当封固干燥或待二甲苯挥发后可出现上述情况。
1.1.3 树胶封固剂粘稠时,滴加的封固剂不能完全覆盖切片所致。
1.2 解决方法1.2.1 封固时,当切片中二甲苯挥发后,应重新放入到二甲苯中透明。
1.2.2 调整树胶封固剂的浓度,不能过于粘稠或过稀。
以细玻璃棒蘸树胶,拿起成滴状,滴速2~3滴/sec适中。
2 形成气泡气泡是封固切片中最常见的问题,直接影响病理观察。
2.1 形成气泡的原因2.1.1 切片厚薄不均,主要是组织纤维成分多,切片困难,或切片刀不锋利,切片形成搓板样结构,切片不平整所致。
2.1.2 捞片水温低,切片未完全展开,或在捞片过程中,水底产生气泡漂浮于组织片上而形成。
2.1.3 树胶封固剂过稀或过于粘稠均可引起。
石蜡切片制作方法的改良石蜡切片是一种广泛应用于生物学和医学领域的样品制备技术,能够将生物组织固定在石蜡块中,并进行连续切片。
近年来,随着科技的不断进步,石蜡切片的制作方法也在不断改良,以提高切片的品质和效率。
本文将介绍一种改良后的石蜡切片制作方法及其优点和效果。
关键词:石蜡切片、制作方法、改良、组织学、医学在传统的石蜡切片制作过程中,存在着一些问题和不足,如切片厚度不均、石蜡渗透不完全、组织结构变形等。
为了解决这些问题,研究者们不断探索新的改良方法,以提高石蜡切片的品质和效率。
目前,一种较为常用的改良方法是通过优化组织处理和石蜡渗透工艺来改善切片质量和效率。
这种改良方法的制作流程为:将生物组织块进行固定、脱水处理;将组织块进行浸泡、冲洗和脱水;将组织块放入石蜡中浸泡一定时间,然后用旋转切片机进行切片。
通过这种改良方法,可以有效地提高切片的品质和效率。
与传统的制作方法相比,这种改良方法具有以下优点:切片厚度更加均匀,避免了传统方法中因组织处理不当而引起的厚度不均和结构变形等问题。
石蜡渗透效果更好,通过优化石蜡渗透工艺,使石蜡能够充分渗透到组织内部,提高了切片的硬度和稳定性。
制作效率更高,通过简化制作流程和缩短处理时间,减少了人力和物力的消耗,提高了制作效率。
通过这种改良方法制作出的石蜡切片,能够更好地保持组织结构,真实反映出生物组织的本质特征,同时提高了病理诊断的准确性和可靠性。
改良方法还减少了制作过程中的人为误差,提高了切片的可重复性和稳定性。
虽然这种改良方法在一定程度上提高了石蜡切片的品质和效率,但仍存在一些问题需要进一步解决。
例如,如何更好地优化石蜡渗透工艺,提高切片的品质和稳定性,以及如何实现自动化生产,提高生产效率等问题。
这种改良后的石蜡切片制作方法是一种有效的制备技术,通过优化组织处理和石蜡渗透工艺来提高切片的品质和效率。
虽然在某些方面仍存在一定的不足之处,但相信随着科技的不断进步和研究者的不断探索,这些问题将逐渐得到解决,为生物医学领域的研究和发展提供更好的技术支持和服务。
石蜡包埋技术制作石蜡切片,切片前须将石蜡渗透组织包埋于石蜡中,而水与石蜡又是不相混合的,所以在浸蜡,包埋前必须将组织内所含的水分脱去。
而大多数的组织固定剂是水溶液,随后的水冲洗也使其含有大量水分,因此必须先行脱水,一般是浸入逐级增加浓度的酒精来完成。
由于酒精和石蜡不能混合,须再用一种石蜡的溶剂来置换酒精,因大多数石蜡溶剂有使组织的折光率增高并表现为透明或半透明状,所以此步骤又称透明。
最后用石蜡浸渍组织并铸制成坚实的蜡块。
常规的石蜡包埋过程包括五个基本步骤,即固定,脱水,透明,浸蜡和包埋,前一章中已述过固定。
第一节脱水脱水就是用脱水剂完全除去组织内的水分,为下一步透明及浸蜡创造条件。
此外,脱水还可以使组织再次发生一定的硬化,脱水剂必须是与水在任何比例下均能混合的液体。
一.常用的脱水剂1.酒精:是制片最常用的试剂,可与水在任何比例下相混合,酒精的脱水能力比较强,又能硬化组织。
但是酒精的船头速度很快,对于组织会有明显的收缩作用。
因此在以酒精作为脱水剂时,应该先从浓度较低的酒精开始,然后递增其浓度,这样可以避免组织过度收缩。
第一瓶酒精浓度随固定剂,脱水组织的大小和种类而异,经水溶性固定剂固定的细柔组织需要慢慢脱水,从50%酒精开始。
如眼球,组胚组织等大多数组织标本则是从70%酒精开始,再经80%,95%以至无水酒精。
但是有时为了某种特殊要求,例如要做糖元的切片标本或是要做尿酸结晶染色切片标本,为了防止糖元和尿酸结晶在水中消失却要直接投入无水酒精中固定,而不需要经过水洗和低浓度酒精的脱水过程。
经无水酒精固定后的组织只需要再经过换一次无水酒精脱水即可。
用AAF固定液固定的组织可直接置于95%酒精开始脱水。
用醇性固定剂(如Carnoy)则可置于高浓度无水酒精内,但应多次换液以除酸。
一般情况下,组织经过70%,80%,90%,95%,以至无水酒精的脱水程序,即可达到脱水的要求。
但是为了能使大量的组织块同时进行脱水,则要求保持液体的浓度以保证脱水的作用,最好是以两次95%酒精,两次100%酒精重复进行脱水,以保证组织的水分脱净。
HE染色封固时出现的问题及解决方法
支喜兰1 谭德银2 (1西安解放军323医院病理科 710054 2陕西省高级人民法院司法技术室病理组)【中图分类号】 R361.2 【文献标识码】 B 【文章编号】1007-8096(2000)04-0303-01
要获得一张满意的HE切片,除与取材、切片、染色关系密切外,封固也是很重要的一个步骤。
我们在观察切片中,发现有许多与封固有直接关系的质量问题,影响病理诊断。
作者根据多年的制片经验,就封固中出现的问题进行总结:
1 类似色素样颗粒(俗称空气色素)
即在封固干燥后,切片中出现类似色素样颗粒,散在或呈片状,圆形或不规则形,易被误认为黑色素或甲醛色素沉着。
但这种类似色素样的物质分布无规律,可在任何组织切片中出现。
其产生的原因是切片染色后,封固时切片中的二甲苯已完全挥发,中性树胶封固剂不能完全封固而形成的组织片干燥的空气气泡或腔隙。
1.1 导致气泡或腔隙产生的诱因
1.1.1 操作者为了减少二甲苯的吸收,习惯于将切片从二甲苯中取出,待二甲苯挥发后再封固。
或切片很多,封固开始并未出现此情况,待二甲苯基本挥发或完全挥发,组织干燥后封固可出现。
1.1.2 树胶封固剂过稀,封固当时并不出现,当封固干燥或待二甲苯挥发后可出现上述情况。
1.1.3 树胶封固剂粘稠时,滴加的封固剂不能完全覆盖切片所致。
1.2 解决方法
1.2.1 封固时,当切片中二甲苯挥发后,应重新放入到二甲苯中透明。
1.2.2 调整树胶封固剂的浓度,不能过于粘稠或过稀。
以细玻璃棒蘸树胶,拿起成滴状,滴速2~3滴/sec适中。
2 形成气泡
气泡是封固切片中最常见的问题,直接影响病理观察。
2.1 形成气泡的原因2.1.1 切片厚薄不均,主要是组织纤维成分多,切片困难,或切片刀不锋利,切片形成搓板样结构,切片不平整所致。
2.1.2 捞片水温低,切片未完全展开,或在捞片过程中,水底产生气泡漂浮于组织片上而形成。
2.1.3 树胶封固剂过稀或过于粘稠均可引起。
2.1.4 封固方法不当,在封固时,有些操作者习惯于用手拿着盖玻片,平放于滴了树胶的组织切片上所致。
2.2 解决方法
2.2.1 封固时用镊子夹起盖玻片,先一侧放置于滴有树胶的组织切片上,然后缓慢放下将空气完全排除。
2.2.2 调整树胶封固剂的浓度及水的温度。
2.2.3 根据组织的取材适当缩短或延长组织脱水时间。
3 切片中出现云雾现象
有时在切片中出现模糊一片的云雾,组织结构不清,严重影响观察。
其产生原因是染色封固时,切片内有水分所致。
3.1 形成的原因
3.1.1 组织取材太厚,脱水不净,导致切片厚薄不均,影响封固质量。
3.1.2 组织固定液及脱水剂时间过长,未及时更换,影响组织脱水。
3.1.3 切片染色时,封固前脱水不净,致使切片不能透明,封固后出现云雾现象。
3.2 解决方法 组织取材厚度适中,及时更换脱水机的各种试剂和各种染色试剂。
尤其是染色过程中,切片进入二甲苯透明前一定要脱水彻底,即可避免产生切片的质量问题。
以上方法适用于所有需要封固的组织。
(收稿1999-10-28 修回1999-12-13)
常规石蜡切片中浸蜡包埋方法的改进
弯雪燕 景春果 张晓辉 (山西省闻喜县东镇541医院 043801)
【中图分类号】 R361.2 【文献标识码】 B 【文章编号】1007-8096(2000)04-0303-02
病理技术的常规工作是制片。
其程序一般是对取材组织进行脱水、透明、浸蜡、包埋、切片、染色、封固。
每一操作环节的好坏,都会影响制片质量。
其中,浸蜡、包埋则是制片过程中手工操作较复杂而又重要的一个环节。
目前大部分医院在病理制片过程中,尚未能完全取代手工操作。
为确保制片质量,提高效率,避免差错,我们对多年沿用的浸蜡、包埋方法和步骤进行了改进,取得了满意的效果,现介绍如下。
1 材料与方法
1.1 材料 单孔或多孔恒温水浴箱1台,自制浸蜡包埋框、小镊子和其他常用包埋用具。
・
3
3
・
诊断病理学杂志2000年12月第7卷第4期
1.2 方法 卸掉恒温水浴箱顶盖,放置自制浸蜡包埋框。
此框用白铁皮或铜铁皮制成一凹形方盘,其外形尺寸依恒温水浴箱大小而定,以能顺利地放入、取出为宜。
框上沿向外折015~1cm,深约213~215cm,底面应平整光洁,其内放置用铁皮制作上下嵌合的活动性“井”字形方格,边长2cm,高2cm,此格即石蜡包蜡模型。
包埋框内注入熔蜡,液面同框面高度相同或稍低。
水浴箱内蒸馏水与框底底面接触或稍高,水温调至60~62℃。
准备工作就绪后,用镊子将已透明好的组织连同事先写好的病理号码,一一对应移入浸蜡包埋框内的“井”字形方格内,并做适当调整,使组织置平,碎小组织集中但不重叠。
框顶可用玻璃板盖好(或不加盖)。
在此条件下浸蜡3~4h。
之后,把浸蜡包埋框轻轻从水浴箱里取出,置操作台上或冰箱中冷却,并用小镊子将病理号从包埋框底部夹置其顶部漂浮于蜡面。
待熔蜡完全(或不完全)凝固后,取出包埋蜡块,整个浸蜡、包埋过程即告结束。
2 结果与讨论
两年多来我们采用本方法对4000多病例进行了制片,体会到具有以下优点:
2.1 操作简便。
浸蜡包埋过程一次即完成,浸蜡与包埋合为一框,并且旧蜡不断消耗又不断添加新蜡补充,完全能达到浸蜡效果与保证包埋质量。
不象过去那样须先行浸蜡,打开脱水盒,向包埋框内倾注熔蜡,再进行组织包埋等多项操作步骤,本法步骤的减少相对减少了差错。
故本方法省时省力,实用经济。
2.2 提高浸蜡包埋质量。
组织透明后直接进行浸蜡、包埋,减少了中间环节。
恒定温度下操作直至包埋结束,不存在由于浸蜡、包埋时温度差所带来的缺点,不会因温度过高使组织烫坏或使碎小组织变脆、变硬,不会因温度过低使组织与石蜡脱离;组织中不会出现因包埋而形成的气泡、裂隙、松浮的斑点(蜡花);包埋组织同石蜡连接坚实可靠,易于切片。
2.3 包埋中较困难的是对碎小组织的包埋。
如各种内窥镜钳取组织、穿刺组织等,包埋时往往不能将其包埋在同一平面,造成切片不全、漏切,而需深切、复切及重新包埋,增加了工作量也影响诊断〔1〕,改进的浸蜡包埋法则能完全避免上述缺点。
由于浸蜡和包埋过程连续不间断,温度恒定,包埋框顶部和底部都在56~58℃之间,浸蜡的碎小组织在熔蜡中受重力作用下沉,浸蜡结束后,都会整齐地排列于包埋框底的同一平面上,并且不重叠,避免了碎小组织包埋不平整的弊端(图1,2)。
2.4 透明组织从脱水盒置包埋框中浸蜡包埋,不用把组织连同脱水盒一起浸蜡,所以也不必再去清除脱水盒上的余蜡,减轻了工作负担,减少了材料消耗。
实践证明,运用自制的浸蜡包埋框和恒温水浴箱进行浸蜡包埋的方法,具有操作简单,经济实用、节能低耗,保证和改善包埋质量,提高工作效率,减少差错事故,且安全无明火等优点,非常适用于无自动包埋机的基层单位。
(本文图1,2见插页第74页)
参考文献
1 叶珍华,曹之清.碎小组织石蜡包埋的改进.诊断病理学杂志, 1999,6:119
(收稿1999-12-22 修回2000-7-14)
淋巴细胞分离液在脱落细胞学中的应用
赵 印 李树桐 高保华 (河北唐山开滦医院 063000)
【中图分类号】 R446 【文献标识码】 B 【文章编号】1007-8096(2000)04-0304-02
肿瘤细胞学检查是肿瘤诊断中的一种手段,正确采集脱落细胞是细胞学诊断的先决条件,也是提高诊断准确率的关键。
临床送检的体液大都为血性,红细胞多,常规离心涂片背景污浊,肿瘤细胞少不易查到。
而用淋巴细胞分离液提取的涂片背景清晰,肿瘤细胞多,易查到。
通过201例实践表明此法效果最佳,一次就能查到肿瘤细胞,提高了诊断的阳性率。
现报道如下。
1 材料与方法
1.1 材料 淋巴细胞分离液(中国医科院血液学研究所制),本院住院病人胸、腹水,尿,心包积液,脑脊液。
1.2 方法
1.2.1 取清洁的10ml玻璃试管1支,加入2ml淋巴细胞分离液,沿管壁轻轻加入被检液体8ml。
1.2.2 离心沉淀10min(2000r/min),此时试管内分4层,最上层为淡黄色体液,其下层为灰白色的核细胞层(主要是肿瘤细胞、间皮细胞、淋巴细胞等),再下层是无色透明的淋巴细胞分离液,最下层为红细胞层。
1.2.3 用滴管轻轻吸取有核细胞层数滴,滴于洁净的载玻片上,然后均匀涂片数张。
1.2.4 涂片自然干后,用95%乙醇固定10min后,行HE染色或特染,或作免疫组化,而后镜检。
2 结果
2.1 病理资料 201例中有122例为特异、非特异性炎症,及其他原因引起的胸、腹水,心包积液,血尿等,均经临床各种检查及脱落细胞学(本方法)检查所确诊。
余下的79例均系肿瘤,其中胸水52例(腺癌48例,鳞癌2例,乳腺癌转移2
・
4
3
・J Diag Pathol,December2000,V ol.7,N o.4。