元素周期表第二课时最新版本
- 格式:ppt
- 大小:2.01 MB
- 文档页数:28


第2课时三维目标知识与技能1.掌握卤族元素的性质与原子结构的关系。
2.了解核素、同位素、质量数等概念。
过程与方法1.归纳、比较法:归纳总结卤族元素性质。
2.自主探究:探究卤族元素性质递变规律。
情感、态度与价值观1.通过探究、分析,培养学生创新思维能力。
2.培养理论联系实际的能力。
要点提示教学重点卤族元素性质与原子结构的关系。
教学难点质量数、同位素、核素的概念。
教具准备多媒体课件、实物投影仪、试管、烧杯、胶头滴管;新制饱和氯水、NaBr溶液、KI溶液、CCl4、苯、溴水。
教学过程导入新课师:上节课我们学习了元素周期表的结构,请同学们画出周期表的短周期部分。
生:练习。
(实物投影:两份同学的作业)请几位同学点评存在的问题。
生1:未标主、副族。
生2:未把过渡元素位置留出。
师:看似简单,要正确画出,必须做有意识的记忆。
推进新课师:在必修1中我们已经学过氯气的性质,请同学们画出Cl 原子结构示意简图。
并在周期表中找到氯元素所在的位置,说出卤族元素包含哪几种元素。
生:看书。
翻阅周期表。
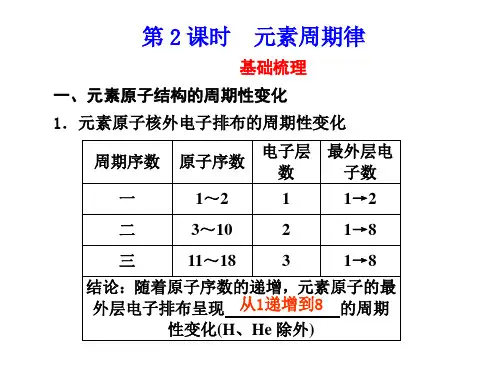
师:借鉴上节课推导碱金属元素的性质递变规律的方法,结合已学过的氯元素的性质,根据教材提供的卤素的原子结构,请同学们推测氟、溴、碘的可能性质,并比较与Cl2的相同与不同之处。
板书:一卤族元素1.结构2.性质生1:氯原子最外层有7个电子,很容易得到1个e-而表现出很强的氧化性,Cl2很活泼,是典型的强氧化剂,可以和金属、H2、H2O等反应,我认为F、Br、I原子结构与Cl原子相似,最外层都有7个电子,F2、Br2、I2也应该是较强的氧化剂,也可以和金属、H2、H2O等发生反应。
板书:3.性质变化规律生2:碱金属元素中,Li、K与Na性质相似,是由于它们的原子结构相似。
但它们的原子结构也有不同之处:原子序数不等,原子半径不等,因此导致了性质上的不同。
F、Br、I原子结构也有与Cl原子结构不同地方,因此,F2、Br2、I2的性质与Cl2也有不同的地方。