元素周期表 第二课时
- 格式:pptx
- 大小:315.10 KB
- 文档页数:15



第2课时三维目标知识与技能1.掌握卤族元素的性质与原子结构的关系。
2.了解核素、同位素、质量数等概念。
过程与方法1.归纳、比较法:归纳总结卤族元素性质。
2.自主探究:探究卤族元素性质递变规律。
情感、态度与价值观1.通过探究、分析,培养学生创新思维能力。
2.培养理论联系实际的能力。
要点提示教学重点卤族元素性质与原子结构的关系。
教学难点质量数、同位素、核素的概念。
教具准备多媒体课件、实物投影仪、试管、烧杯、胶头滴管;新制饱和氯水、NaBr溶液、KI溶液、CCl4、苯、溴水。
教学过程导入新课师:上节课我们学习了元素周期表的结构,请同学们画出周期表的短周期部分。
生:练习。
(实物投影:两份同学的作业)请几位同学点评存在的问题。
生1:未标主、副族。
生2:未把过渡元素位置留出。
师:看似简单,要正确画出,必须做有意识的记忆。
推进新课师:在必修1中我们已经学过氯气的性质,请同学们画出Cl 原子结构示意简图。
并在周期表中找到氯元素所在的位置,说出卤族元素包含哪几种元素。
生:看书。
翻阅周期表。
师:借鉴上节课推导碱金属元素的性质递变规律的方法,结合已学过的氯元素的性质,根据教材提供的卤素的原子结构,请同学们推测氟、溴、碘的可能性质,并比较与Cl2的相同与不同之处。
板书:一卤族元素1.结构2.性质生1:氯原子最外层有7个电子,很容易得到1个e-而表现出很强的氧化性,Cl2很活泼,是典型的强氧化剂,可以和金属、H2、H2O等反应,我认为F、Br、I原子结构与Cl原子相似,最外层都有7个电子,F2、Br2、I2也应该是较强的氧化剂,也可以和金属、H2、H2O等发生反应。
板书:3.性质变化规律生2:碱金属元素中,Li、K与Na性质相似,是由于它们的原子结构相似。
但它们的原子结构也有不同之处:原子序数不等,原子半径不等,因此导致了性质上的不同。
F、Br、I原子结构也有与Cl原子结构不同地方,因此,F2、Br2、I2的性质与Cl2也有不同的地方。

《元素周期表》(第二课时)一、教材分析物质结构和元素周期律是化学的重要理论知识,也是中学化学教学的重要内容。
而元素周期表是元素周期律的具体表现形式,是学习化学的重要工具。
元素周期表在初中化学中已有简单介绍,本节书的总体思路是在初中已有知识的基础上让学生学习元素周期表,突出原子结构与元素原子在周期表中的位置关系后,引导学生思考原子结构与元素性质的关系,得出元素性质主要与原子核外电子排布密切相关的结论,最后,引导学生思考原子核与元素的性质是否有关引出核素概念,了解放射性同位素的应用。
在教学时可将本节教材分为三个课时,第一课时主要认识元素周期表的结构以及其与原子结构的关系;第二课时主要探究元素的化学性质与原子结构的关系;第三课时探究元素的化学性质与原子结构的关系,小结元素性质与原子核外电子排布密切相关后,学习核素及同位素概念。
二、学情分析在人教版九年级上册第四单元物质构成的奥秘中,学生对元素周期表的简介以及原子的核外电子排布等知识已有所了解,从元素周期表中能够获取元素名称、符号、原子序数、原子相对原子质量等信息,知道最外层电子数为8(第一周期为2)的结构化学性质稳定,金属元素最外层电子数一般少于4,反应中易失去电子,非金属元素的最外层电子数一般多于4,反应中易得到电子。
结合学生过往已有的知识,本节课将从实验出发,以一系列的实验事实凸显元素的原子结构(尤其是最外层电子数)与化学性质之间的密切联系,丰富学生对元素周期表的认识,深刻理解“元素周期表是学习和研究化学的重要工具”的含义。
教材中对碱金属元素化学性质的探究通过实验归纳得出,这要求学生能够准确描述实验现象并进行对比归纳;对卤族元素化学性质的探究则将实验事实以表格的形式呈现,这对学生处理信息的能力提出了较高的要求,能够从文字中筛选出关键内容进行对比,归纳出“递变性”规律。
另外,本节课除了要让学生发现同一主族元素“递变性”外,还要从同一主族元素化学性质的“相似性”归纳出结构与性质的关系,要求学生有较为全面的思维能力,能够充分挖掘未知的潜在性规律。



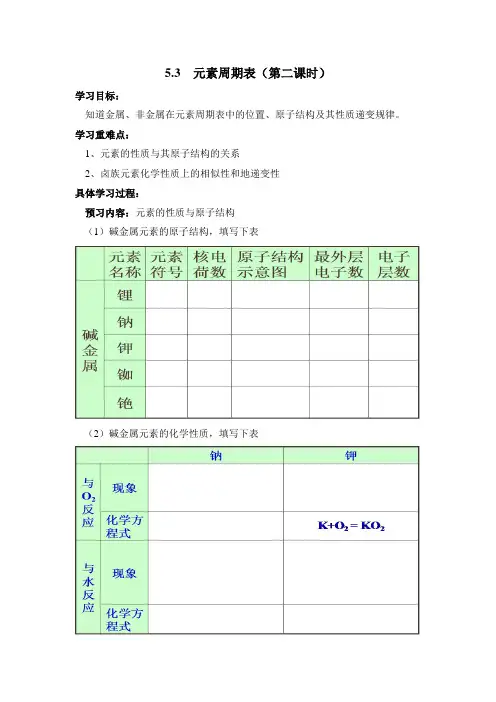
5.3 元素周期表(第二课时)学习目标:知道金属、非金属在元素周期表中的位置、原子结构及其性质递变规律。
学习重难点:1、元素的性质与其原子结构的关系2、卤族元素化学性质上的相似性和地递变性具体学习过程:预习内容:元素的性质与原子结构(1)碱金属元素的原子结构,填写下表(2)碱金属元素的化学性质,填写下表思考与交流:通过以上比较,思考并讨论钠和钾的性质有什么相似性和不同。
你认为元素的性质与它们的原子结构有关系吗?归纳于小结:1、相似性原因:碱金属元素原子的最外层都只有__个电子,它们的化学性质_____。
碱金属元素的化合价都显___价,它们都能跟氧气等非金属单质以及水发生反应。
完成下列化学方程式:Li + O2 2Na+O2 = Na2O2Li + H2O =2、差异性原因:随着核电荷数的增加,碱金属元素原子的电子层数__________,原子核对最外层电子的引力__________,所以碱金属元素的性质也有差异。
从锂到铯,原子的失电子能力__________,元素的金属性__________,具体表现在:_________________________________。
自主学习问题:(1)碱金属的物理性质,填写下表(2)碱金属元素的性质与结构,填写下表课堂测评:1、下列关于碱金属的原子结构和性质的叙述中不正确的是()A.碱金属原子最外层都只有一个电子,在化学反应中容易失去B.都是强还原剂C.都能在O2里燃烧生成过氧化物D.都能与水反应生成碱2、钾的金属活动性比钠强,根本原因是()A. 钾的密度比钠的小B. 钾原子的电子层比钠原子多一层C. 钾与水反应比钠与水反应更剧烈D. 加热时,钾比钠更易汽化3、下列叙述中错误的是()A、随着电子层数增多,碱金属的核电荷数逐渐增大B、碱金属具有强还原性,它们的离子具有强氧化性C、碱金属单质的熔沸点随着核电荷数的增大而降低D、碱金属元素都是以化合态存在4、碱金属钫(Fr)具有放射性,它是碱金属元素中最重的元素,下列对其性质的预言中,错误的是()A.在碱金属元素中它具有最强的金属性B.它的氢氧化物化学式为FrOH,是一种极强的碱C.钫在空气中燃烧时,只生成化学式为Fr2O的氧化物D.它能跟水反应生成相应的碱和氢气,由于反应剧烈而发生爆炸合作讨论:卤族元素1、卤族元素是元素周期表中的第____纵行,是第_____族,包括的元素的名称和符号:______________________________________。


第一节 元素周期表(第2课时)知识点一、元素的性质与原子结构(一)碱金属的化学性质1、与非金属的反应 Li +O 2 = Na +O 2 = K+O 2=K 、Rb 等碱金属与O 2反应,会生成超氧化物。
Rb 、Cs 在室温时,遇到空气会立即燃烧。
2、与水的反应 K +H 2O= Rb +H 2O=除Na 、K 外,其他碱金属元素也都可以和水反应生成相应的碱与H 2。
(二)碱金属的物理性质的比较(三)卤素单质的物理性质颜色: 状态: 密度:熔沸点: 在水中的溶解性:(四)卤素的化学性质:1、卤素单质与氢气的反应卤素和H 2的反应可用通式H 2+X 2==== 来表示,反应时按F 2、Cl 2、Br 2、I 2的顺序,反应条件越来越 ,反应程度依次 ,形成的卤化氢的稳定性也依次 。
2、 卤素单质间的置换反应:(1)卤素单质随着原子核电荷数的递增,在物理性质和化学性质方面,均表现出一定的 性和 性。
(2)同一主族元素性质具有一定的相似性和递变性;同一主族,从上到下:原子半径逐渐增大,失电子能力逐渐 ,得电子能力逐渐 ,金属性逐渐 ,非金属性逐渐 ;练一练:1、碱金属钫(Fr)具有放射性,它是碱金属元素中最重的元素,下列预言错误的是:A.在碱金属中它具有最大的原子半径 B.它的氢氧化物化学式为FrOH,是一种极强的碱C.钫在空气中燃烧时,只生成化学式为Fr 2O 的氧化物D.它能跟水反应生成相应的碱和氢气,由于反应剧烈而发生爆炸 2、现有下列几种物质的溶液KCl 、KI 、新制氯水、KBr 、淀粉、AgNO 3,不用其他试剂,怎样鉴别它们?3、砹(At)是卤族元素中位于碘后面的元素,试推测砹和砹的化合物最不可能具备性质A.砹易溶于某些有机溶剂B.砹化氢很稳定不易分解C.砹是有色气体D.砹化银不溶于水或稀HNO 34、在下列各元素组中,除一种元素外,其余都可以按某种共性归属一类,请选出各组的例外元素,并将该组其他元素的可能归属,按所给六种类型的编号填入表内。

第一章物质结构元素周期律第一节元素周期表第2课时一、教材分析《碱金属元素和卤素元素》是人教版高中化学必修二第一章第一节《元素周期表》第二课时的教学内容,主要学习本节学习碱金属元素和卤素元素性质与结构的关系,使学生会从理论上推测同主族元素性质的递变规律,使学生能够会运用化学实验来证明其推测的正确性,进而知道元素强弱的判断依据。
本课时是学好元素性质的基础,也是学好元素周期律的基础。
二、教学目标:一、知识目标:1)通过对比学习碱金属元素和卤素元素性质与结构的关系;2)知道元素金属性和非金属性强弱的判断依据。
二、能力目标:1)会从理论上推测同主族元素性质的递变规律;2)使学生能够会运用化学实验来证明其推测的正确性。
3、情感目标:学会合作学习三、教学重难点一、推测同主族元素性质的递变规律。
二、运用化学实验来证明其推测的正确性,进而知道碱金属和卤素元素强弱的判断依据四、学情分析因为必修一咱们已经学习了钠元素和氯元素的性质,而且学生通过预习对碱金属和卤素元素也有简单的了解,所以,本节内容碱金属和卤素元素的性质学生应该很容易接受。
五、教学方式启发、诱导、阅读、讨论、练习、探讨等六、课前准备一、学生的学习准备:通过对比学习碱金属元素和卤素元素性质与结构的关系二、教师的教学准备:多媒体课件制作,课前预习导学案,课内探讨导学案,课后延伸拓展学案,教学环境设计和布置,合理给学生进行分组。
七、课时安排一课时八、教学进程(一)预习检查、总结疑惑检查落实学生的预习情况并了解学生的疑惑,使教学具有了针对性。
(二)情境导入、展示目标〔提问〕碱金属是指哪一族?卤族是指哪一族?教师:这节课咱们就来学习碱金属和卤族元素的递变规律。
大家看本节的目标、重点、难点。
然后看第一个探讨问题,碱金属的递变规律。
咱们已经布置了同窗们课前预习这部份,检查学生预习情况并让学生把预习进程中的疑惑说出来。
设计用意:提出问题,吸引学生的注意力,明确学习目标。
1.1元素周期表(第2课时)二、沅素的性质与原子结构1、碱金属元素(1)碱金属的原子结构观察碱金属的原子结构示意图,分析碱金属原子结构的共同Z处。
S)21> J、、、、、、、、、、、、、r、、Li Na K Rb Cs锂钠钾艳①相同点:碱金属元素原子结构的__________________ 相同,都为__________ 。
②递变性:从Li到Cs,碱金属元素的原子结构中,___________________ 依次增多。
【思考】物质的性质主婆取决于原子的最外层电子数,从碱金属原子的结构可推知其化学性质如何?是否完全相同?(2)钠、钾分别跟02和比0的反应实验【实验1】取一小块钾,擦干表而的煤油后放在石棉网上加热,观察现象。
同钠与氧气的反应比较。
(完成下表)【实验2】在小烧杯中放入一些水,然后取绿豆大的钾,吸干表面的煤油,投入到小烧杯中, 观察现象。
同钠与水的反应进比较。
(完成下表)钠、钾化学性质的比较钠钾与氧气反应剧烈燃烧,火焰呈色,生成色的固体剧烈燃烧,火焰呈色与水反应在水面上、成银口色在水而上、成银口色小球、(绿豆大一小球、在水而上四处、在水而上四处、滴入酚駄溶液块)滴入酚瞅溶液呈色呈色,有微弱爆炸【思考与交流】根据实验讨论钠与钾的性质冇什么相似性和不同性。
你认为元索的性质与他们的原子结构有关系吗?【结论】(1)碱金属元素原子的最外层都有1个电子,它们的化学性质相似①与。
2的反应②与水的反应碱金属(R)与水反应规律相同,但反应程度(从Li到Cs)___________________2R + 2H20 =【例】某碱金属3. 9g与足最水反应,生成蛍气0. lg,则该金属是什么?(2)碱金属元素从上到下(Li、Na. K、Rb、Cs),随着核电荷数的增加,碱金属元素原了的电了层数逐渐_________ ,原了核对____________ 的引力逐渐减弱,原了失电了的能力逐渐__________ o元索的金属性逐渐__________ ,与水和氧气的反应越來越____________ ,生成的氧化物越来越_____________ c最高价氧化物对应水化物的碱性越來越_________________ o(3)[知识拓展】元素金属性强弱判断依据:1、根据金属单质与水或与酸反应置换出氮的难易程度。
【教学设计】《元素周期律(第二课时)》(人教)讲授式教学律,元素周期表的相关知识在必修模块中起着承上启下的作用,帮助学生结束元素化合物等感性知识的学习,进入逻辑性很强的理论知识学习。
◆思路分析引导学生联系上节课所学内容,认识到元素在周期表中的位置,元素的原子结构,元素的性质之间的关系。
创造一个真实而有意义的教学情境,通过客观事实以及习题从大量的事实和数据中分析总结规律让学生感受到化学学科素养和化学思维方式在日常生活中的应用和体现。
◆教学目标【知识与能力目标】1、掌握元素周期表和元素周期律;2、掌握元素化合价与元素在周期表中位置的关系;3、归纳、比较。
通过对前面所学知识的归纳比较,掌握“位、构、性”的关系;4培养学生科学创新品质,培养学生理论联系实际的能力。
【过程与方法目标】1、培养学生对大量数据、事实进行分析、归纳和总结的能力;2、培养学生的逻辑推理能力。
【情感态度价值观目标】1、使学生了解辩证唯物主义理论联系实际的观点,量变、质变的观点;2、通过对元素周期律的学习,使学生初步掌握化学学科的思维方式即透过现象看本质,宏观与微观相互转化等观点。
◆教学重难点【教学重点】周期表、周期律的应用。
【教学难点】“位、构、性”的推导。
◆教学过程第二节元素周期律 (第2课时) 教学环节:师生活动预设个性化批注一、复习导入:知识回顾导入新课:元素周期律、元素周期表是一种重要的结构理论,它的重要性体现在什么地方呢?这就是我们这节课要学习的内容。
二、推进新课三、元素周期表和元素周期律的应用。
元素在周期表中的位置(简称“位”)、反映了元素的原子结构(简称“构”),而元素的原子结构,则决定、影响着元素的性质(称简“性”)。
因此,我们只要知道三种量(位、构、性)中的一种,即可推出另外2种量。
[指导阅读]请大家观察附录中的元素周期表。
表格底色有几种?为什么要这样表示?元素周期表中,金属元素和非金属元素的区域特别集中,沿着周期表中硼、硅、砷、碲、砹跟铝、锗、锑、钋之间画一条线,线的左面是元素,右面是元素。