3.5《元素周期表》第二课时
- 格式:pptx
- 大小:1.19 MB
- 文档页数:23

《元素周期表》郑怡10101570104 一、教学内容分析《元素周期表》选自人教版高中《化学》(必修二)第一章《物质结构元素周期律》第一节《元素周期表》。
本节课为《元素周期表》第二课时,以元素的性质与原子结构为主要教学内容。
物质结构和元素周期律是化学的重要理论知识,也是中学化学教学的重要内容.通过学习这部分知识,可以使学生对所学元素化合物等知识进行综合、归纳,从理论进一步加深理解.同时作为基础元素化学的理论指导,也为学生继续学习打下理论基础.本章内容虽然是理论性知识,但教材结合元素化合物知识相互融合,这对于学生理解和掌握是很有利的。
二、学情分析在初中化学,学生虽然已经知道元素周期表结构,学生的每本书的最后也附有元素周期表的彩图。
但那时学生们所学的元素彼此是独立的。
而高中学习本节之前,老师也相应地提到过不少的元素周期律,但并没有明确指出此为元素周期律。
通过上一课时的讲解学生们已经明确地知道了元素周期表的基本结构、元素周期表的编排原则以及元素的原子结构与其在周期表中的位置关系。
但对于同主族元素随着原子核外电子排布呈周期性变化还理解不够深入和全面,关于应用周期律还没有涉及。
三、教学目标(一)知识与技能目标1、通过对有关数据和实验事实分析,了解原子结构与元素性质之间的关;。
2、通过碱金属单质与水反应、卤素单质与氢气反应、卤素单质间的置换反应来感知主族元素的递变规律;3、通过对同主族元素性质的金属性与非金属性的递变规律的归纳,能初步学会总结元素递变规律的能力,具有把元素的性质、元素周期表的位置与元素组成微粒的结构初步联系起来并在一定条件下相互转化的运用能力。
(二)过程与方法目标1、通过对获取的大量事实和数据等信息进行加工、分析,培养学生学归纳、概括能力、口头表达能力和交流能力;2、通过案例的探究,激发学生主动学习的意识,并且掌握从大量的事实和数据中分析总结规律、透过现象看本质等科学抽象的方法;3、通过对元素周期律的探究,培养学生利用各种图表的分析、处理数据能力。

第一章物质结构元素周期律第一节元素周期表第二课时一、教材分析《碱金属元素与卤族元素》是高中化学(人教版)必修二第一章第一节《元素周期表》第二课时的教学内容,本节主要学习碱金属元素与卤族元素性质与结构的关系,使学生会从理论上推测同主族元素性质的递变规律,使学生能够会运用化学实验来证明其推测的正确性,进而知道元素强弱的判断依据。
本课时是学好元素性质的基础,也是学好元素周期律的基础。
二、教学目标分析知识与技能:1、通过对比学习碱金属元素和卤族元素性质与结构关系2、能初步学会总结元素递变规律的能力。
3.是学生能够会运用化学实验来证明其推测的正确性。
过程与方法:具有把元素的性质、元素周期表的位置与元素组成微粒的结构初步联系起来并在一定条件下相互转化的运用能力。
情感态度与价值观:通过对元素性质的递变规律与元素组成微粒结构的联系。
从而认识事物变化过程中量变引起质变的规律性,接受辨证唯物主义观点的教育。
三、学情分析因为必修一我们已经学习了钠元素和氯元素的性质,而且学习通过预习对碱金属和卤素元素也有简单的理解,所以本书内容碱金属和卤族元素的性质学生应该很容易接受。
四、教学重难点1、理解碱金属元素和卤族元素的原子结构特点及递变规律,推测同主族元素性质的递变规律。
2、运用化学实验来证明其推测的正确性,进而知道碱金属和卤素元素强弱的依据。
五、教学方法启发、诱导、阅读、讨论六、教具准备1、学校多媒体网络教室。
2、《元素周期表》网页式课件。
七、教学过程八、板书设计一、碱金属元素的递变规律1、物理性质2、化学性质二、卤族元素的递变规律1、物理性质2、化学性质三、同主族元素性质的递变规律四、金属性和非金属性强弱的判断。
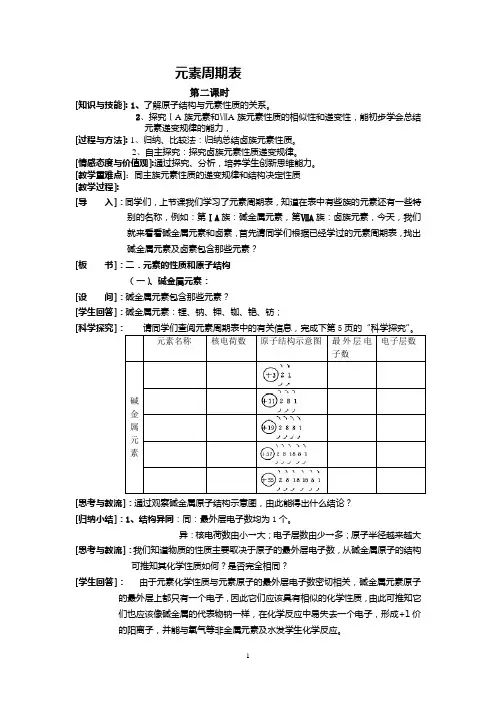
元素周期表第二课时[知识与技能]: 1、了解原子结构与元素性质的关系。
2、探究ⅠA族元素和ⅦA族元素性质的相似性和递变性,能初步学会总结元素递变规律的能力,[过程与方法]: 1、归纳、比较法:归纳总结卤族元素性质。
2、自主探究:探究卤族元素性质递变规律。
[情感态度与价值观]:通过探究、分析,培养学生创新思维能力。
[教学重难点]:同主族元素性质的递变规律和结构决定性质[教学过程]:[导入]:同学们,上节课我们学习了元素周期表,知道在表中有些族的元素还有一些特别的名称,例如:第ⅠA族:碱金属元素,第ⅦA族:卤族元素,今天,我们就来看看碱金属元素和卤素,首先请同学们根据已经学过的元素周期表,找出碱金属元素及卤素包含那些元素?[板书]:二.元素的性质和原子结构(一)、碱金属元素:[设问]:碱金属元素包含那些元素?[学生回答]:碱金属元素:锂、钠、钾、铷、铯、钫;[科学探究][思考与教流]:通过观察碱金属原子结构示意图,由此能得出什么结论?[归纳小结]:1、结构异同:同:最外层电子数均为1个。
异:核电荷数由小→大;电子层数由少→多;原子半径越来越大[思考与教流]:我们知道物质的性质主要取决于原子的最外层电子数,从碱金属原子的结构可推知其化学性质如何?是否完全相同?[学生回答]:由于元素化学性质与元素原子的最外层电子数密切相关,碱金属元素原子的最外层上都只有一个电子,因此它们应该具有相似的化学性质,由此可推知它们也应该像碱金属的代表物钠一样,在化学反应中易失去一个电子,形成+1价的阳离子,并能与氧气等非金属元素及水发学生化学反应。
[过 渡]:实验是检验真理的标准,下面我们通过实验来探讨同一族元素的性质。
[实 验1] 将一干燥的坩埚加热,同时取一小块钾,擦干表面的煤油后,迅速的投入到热坩埚中,观察现象。
同钠与氧气的反应比较。
[板 书]:2、碱金属单质化学性质(1)、碱金属与氧气的反应[思考与交流]: 请写出钠与氧气在加热条件下的化学反应方程式,并尝试的写出锂、钾[设 问]:从钾、钠与氧气反应实验中,请总结出碱金属与氧气的反应有什么相似性、递变性?[归纳小结]:相似性:碱金属都能与氧气反应。



