含硫物质的转化
- 格式:docx
- 大小:257.36 KB
- 文档页数:7





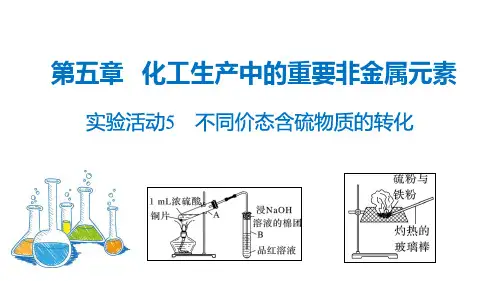

实验活动5 不同价态含硫物质的转化实验目的1.通过实验加深对硫及其化合物性质的认识。
2.应用氧化还原反应的原理实现不同价态含硫物质的转化。
实验仪器试管、托盘天平、量筒、酒精灯、铁架台、试管架、橡胶塞、乳胶管、胶头滴管、玻璃导管、石棉网、玻璃棒、药匙、棉花、镊子、火柴。
实验药品浓硫酸、铜片、硫粉、铁粉、硫化钠溶液、酸性高锰酸钾溶液、氢氧化钠溶液、亚硫酸溶液、品红溶液。
实验步骤1.硫化钠转化为单质硫(1)向盛有1 mL 硫化钠溶液的试管中,边振荡边滴加亚硫酸溶液,观察到的现象是有淡黄色沉淀生成。
(2)向盛有1 mL 硫化钠溶液的试管中,边振荡边滴加酸性高锰酸钾溶液,观察到的现象是有淡黄色沉淀生成。
(3)上述两个实验中,都要用浸有氢氧化钠溶液的棉团塞住试管口,其原因是吸收实验过程中可能产生的有毒气体硫化氢和二氧化硫。
2.浓硫酸转化为二氧化硫 (1)实验装置及操作如图所示(2)试管甲中观察到的现象是铜片上有气泡逸出,溶液变蓝色,铜片溶解,试管乙中观察到的现象是品红溶液逐渐变为无色。
(3)浓硫酸与铜反应的化学方程式是Cu +2H 2SO 4(浓)=====△CuSO 4+SO 2↑+2H 2O 。
3.硫转化为硫化亚铁(1)实验装置及操作如图所示。
(2)观察到的现象是混合物继续保持红热,最后生成黑色固体。
(3)反应的化学方程式为Fe +S=====△FeS 。
部分含硫物质的分类与相应化合价关系如图所示。
下列推断不合理的是( )A .a 可与O 2反应直接生成cB .b 既可被氧化,也可被还原C .可向H 2O 2中加入b 制得dD .可存在b c d b →→→的转化关系【答案】A【分析】根据元素的化合价及物质类型,可知a 是S 单质,b 是SO 2,c 是SO 3,d 是H 2SO 4,e 是H 2SO 3,然后结合物质的性质分析解答。
【详解】A .a 是S 单质,c 是SO 3。
S 与O 2在点燃时发生反应产生SO 2,不能产生SO 3,A 错误; B .b 是SO 2,S 元素化合价为+4价,介于S 元素的最高+6价和最低-2价之间,因此SO 2既有氧化性,又有还原性,也就是说该物质既可被氧化,也可被还原,B 正确;C .H 2O 2具有氧化性,b 是SO 2,该物质具有还原性,向H 2O 2中加入SO 2,二者发生氧化还原反应产生H 2SO 4,C 正确;D .SO 2与O 2在催化剂存在条件下被氧化为SO 3,SO 3与H 2O 反应产生H 2SO 4,H 2SO 4与Na 2SO 3在溶液中→→→的转化关系,D正确;发生反应产生SO2气体,故存在b c d b故合理选项是A。


【同步实验课】 不同价态含硫物质的转化【实验目的】1.通过实验加深对硫及其化合物性质的认识。
2.应用氧化还原反应原理实现不同价态含硫物质的转化。
【实验原理】2 Na 2S + 3H 2SO 3== 3S ↓+ 3H 2O+2Na 2SO3 ; Cu +2H 2SO 4(浓)CuSO4+SO 2↑+2H 2O5S 2+2Mn O 4-+16H +==== 2M n 2++8H 2O +5S↓; Fe + S FeS【实验试剂】浓硫酸、铜片、硫粉、铁粉、Na 2S 溶液、酸性KMnO 4溶液、NaOH 溶液、H 2SO 3溶液、品红溶液。
【实验仪器】试管、天平、量筒、酒精灯、铁架台、试管架、橡胶塞、乳胶管、胶头滴管、玻璃导管、石棉网(或陶土网)、玻璃棒、药匙、棉花、镊子、火柴。
【实验一】Na 2S 的还原性实验操作图解操作实验现象 实验结论 (1)在试管中加入1mL N a 2S 溶液,边振荡边滴加H 2S O 3溶液,用浸NaOH 溶液的棉团塞住试管口,观察并记录实验现象。
(2)在试管中加入1mL N a 2S 溶液,边振荡边滴加酸性KMnO 4溶液,用浸NaOH 溶液的棉团塞住试管口,观察并记录实验现象。
1.滴加H 2SO 32.出现黄色沉淀 ,棉团塞住试管口1.滴加KMnO 4,出现黄色沉淀,棉团塞住试管口产生淡黄色沉淀。
溶液紫红色褪去,产生淡黄色沉淀。
2 Na 2S + 3H 2SO 3=3S ↓+3H 2O+2Na 2SO 35S 2+2MnO 4-+16H += 2Mn 2++8H 2O+5S↓ S 元素化合价变化 2价S 具有还原性,+4价S 表现氧化性。
【实验二】验证浓硫酸的氧化性实验操作图解操作实验现象实验结论△ △01实验梳理 02实验点拨 03典例分析 04对点训练 05真题感悟如上图所示连接仪器装置,向试管中加入1mL浓硫酸和一根铜丝,塞上带导管的单孔橡胶塞,加热,观察并纪录实验现象。


不同价态含硫物质的转化实验原理含硫物质是一类在工业生产和环境中广泛存在的物质,其存在往往会带来一系列问题,比如对环境造成污染,对人体健康造成危害等。
因此,研究含硫物质的转化机理和方法显得尤为重要。
含硫物质的主要形态包括硫酸盐、硫醇、硫醚、硫烷等。
这些物质在不同的条件下会发生不同的化学反应,而其中一个重要的反应就是氧化还原反应。
氧化还原反应是指物质失去电子的过程称为氧化,而获得电子的过程称为还原。
利用氧化还原反应可以实现含硫物质的转化和去除。
在实验室中,常用的含硫物质转化方法包括氧化反应和还原反应。
氧化反应是指通过氧化剂使含硫物质发生氧化,从而将其转化为相应的氧化物或酸。
而还原反应则是通过还原剂将含硫物质还原成较为稳定和无害的形态。
以硫酸盐为例,硫酸盐是一类广泛存在的含硫物质,在工业生产和生活中常见。
硫酸盐可以通过氧化反应转化为硫酸,从而实现其去除。
而硫酸则是一种具有强酸性的物质,可以通过稀释或中和等方法进一步处理,使其达到排放标准。
另外,硫醇和硫醚等含硫物质也可以通过还原反应转化为较为稳定和无害的形态。
还原反应常常需要在一定的温度和压力条件下进行,通过选择合适的还原剂和催化剂,可以有效地将含硫物质转化为无害的产物。
含硫物质的转化实验需要严格控制实验条件,包括温度、压力、pH值等参数。
此外,选择合适的氧化剂和还原剂也至关重要,不仅要考虑其反应活性和选择性,还要避免产生有害副产物。
总的来说,含硫物质的转化实验是一项复杂而重要的研究课题。
通过深入理解不同价态含硫物质的转化机理,可以为环境保护和工业生产提供重要的参考。
希望通过不断的研究和实验,能够找到更加高效和环保的含硫物质处理方法,为人类社会的可持续发展做出贡献。
不同价态含硫物质的转化含硫物质是指其中所含的主要化学元素为硫的化合物。
在不同价态下,含硫物质的化学性质也不尽相同。
下面就来介绍一下含硫物质不同价态下的转化情况。
一、硫氧化物的转化1、二氧化硫的转化在高温条件下,二氧化硫可被还原成硫化氢,如下面的化学反应所示:SO2 + 2H2S → 3S + 2H2O而当存在过量的氧气时,则会发生下面的化学反应:2SO2 + O2 → 2SO3SO3 + H2O → H2SO4由此可见,二氧化硫可同时被还原和氧化,从而形成硫化氢和硫酸。
2、三氧化硫的转化三氧化硫在高温下可分解为二氧化硫和氧气,如下反应式:2SO3 → 2SO2 + O2此外,三氧化硫还可以被水蒸气还原成二氧化硫和水:SO3 + H2O → H2SO4二、不同硫酸盐的转化1、硫酸亚铁的转化硫酸亚铁(FeSO4)如果在空气中放置很长一段时间,会逐渐氧化成硫酸铁(Fe2(SO4)3)。
同时,如果将其在氧气条件下加热,也会发生同样的氧化反应。
2、硫酸钠的转化硫酸钠(Na2SO4)和氢氧化钠(NaOH)在适当的条件下可以发生置换反应,生成硫酸氢钠(NaHSO4)和氢氧化钠(NaOH):Na2SO4 + 2NaOH → 2Na2O + H2SO42Na2O + CO2 → 2Na2CO33、硫酸铜的转化硫酸铜(CuSO4)如果加热到500℃以上就会发生分解反应,生成氧化铜(CuO)和二氧化硫(SO2):CuSO4 → CuO + SO2 + 1/2O24、硫酸钙的转化硫酸钙(CaSO4)在高温条件下可分解为次氟酸(HF)和二氧化硫(SO2),如下所示:Ca SO4 → CaF2 + SO2 + 1/2O2以上就是含硫物质不同价态转化的相关内容。
可能比较枯燥,但具有一定的学术价值。
不同价态含硫物质的转化化学方程
不同价态含硫物质之间的转化涉及到多个化学反应。
以下是一些常见的含硫物质转化及其化学方程式:
硫化氢(H2S)与二氧化硫(SO2)的反应:
H2S + SO2 = 3S + 2H2O
这个反应中,硫化氢和二氧化硫反应生成硫和水。
硫与氧气的反应,生成二氧化硫:
S + O2 = SO2
这个反应中,硫在氧气中燃烧生成二氧化硫。
二氧化硫与氧气的反应,生成三氧化硫(SO3):
2SO2 + O2 = 2SO3
这个反应中,二氧化硫在氧气中进一步氧化生成三氧化硫。
三氧化硫与水的反应,生成硫酸(H2SO4):
SO3 + H2O = H2SO4
这个反应中,三氧化硫与水反应生成硫酸。
硫酸与氢氧化钠的反应,生成硫酸钠(Na2SO4)和水:
H2SO4 + 2NaOH = Na2SO4 + 2H2O
这个反应中,硫酸与氢氧化钠发生中和反应生成硫酸钠和水。
这些反应展示了不同价态含硫物质之间的转化关系。
需要注意的是,这些反应的条件和产物可能会受到反应条件(如温度、压力、催化剂等)的影响而有所变化。
因此,在实际应用中,需要根据具体情况选择合适的反应条件和反应方程式。
含硫物质的转化一、自然界中硫的存在和转化
(一)硫的存在
(二)硫的转化
自然界的含硫物质在一定条件下能够进行转化,这种转化在人工的条件下也能发生,例如工业制硫酸。
二、不同价态含硫物质的转化
(一)不同价态之间的转化基本规律
硫元素化合价不同的物质之间的转化,属于氧化还原反应,主要试剂是氧化剂和还原剂。
(二)价态变化规律
(1)2
S -是硫元素的最低价态,只有还原性;
(2)0S 、4
S +处于中间价态,既有氧化性,又有还原性; 6S +是硫元素的最高价态,只有氧化性。
(2)当硫元素的化合价升高或降低时,一般升高或降低到其相邻的价态。
()222
222
4
6
O O O 223H H S
H S
S
S O S O -++−−→不足、△
例如:()242222H SO C
2SO CO 2H O +↑+↑+△
浓
(3)有时硫的化合价发生跳位转化。
如2
S -、0
S 遇到强氧化剂时可被氧化为+6价:
3
HNO 24S H SO −−−→、26
S S -+−−−→浓硝酸。
(4)硫元素相邻价态的微粒之间不发生氧化还原反应。
如S 和2H S 、S 和2SO 、2
SO
H SO之间不发生氧化还原反应。
和24
(三)氧化还原反应转化关系
三、同种价态含硫物质的转化
(一)转化基本规律
硫元素的化合价相同的物质之间的转化,属于非氧化还原反应,主要试剂是酸、碱、盐、氧化物等。
(二)重要的转化关系
1.含−2价硫元素的化合物之间的转化
(1)H2S的制备
【制备原理】
根据强酸制弱酸的原理,可采用非氧化性的强酸(稀硫酸或稀盐酸)与弱酸盐(FeS)反应,可生成硫化氢气体。
FeS + 2HCl====FeCl2 + H2S↑;FeS + H2SO4====FeSO4 + H2S↑由于盐酸具有挥发性,所以制得的气体中含有较多的氯化氢杂质。
【制取装置】
制取H2S可以使用启普发生器或制气体的简易装置。
把FeS放入启普发生器的球形体
内,漏斗里注入稀HCl。
需用H2S时,打开导气管活塞,FeS与稀HCl接触产生H2S,停止用气时,只需关闭活塞反应既可停止。
【气体收集】
H2S能溶于水、形成氢硫酸,因此不能用排水法收集。
因硫化氢的密度比空气大,可用瓶口向上的排空气集气法收集。
【气体检验】
用蘸有硝酸铅(或醋酸铅)溶液的试纸,放在集气瓶口试验,如果试纸变黑则证明集气瓶里已充满了H2S气。
(CH3COO)2Pb + H2S====PbS↓+ 2CH3COOH (2)H2S与NaOH的反应
【反应原理】
H2S为二元弱酸,NaOH为一元强碱,两者发生酸碱中和反应。
NaOH+H2S(足量)====NaHS+H2O
2NaOH+H2S(少量)====Na2S+2H2O
书写方程式时,一定要注意H2S和NaOH的相对多少。
【主要应用】
硫化氢有毒,在实验室中常用氢氧化钠溶液除去杂质气体硫化氢,洗气装置如下:
(3)金属硫化物
金属硫化物即为硫化某的形式,例如CuS 、Na 2S 、FeS 、K 2S 等。
金属硫化物可由硫与金属生成二元化合物,也可由硫化氢(或氢硫酸)与金属氧化物或氢氧化物作用生成。
2.含+4价硫元素的化合物之间的转化
224
24
H O NaOH NaOH 2
23
3
23H SO H SO SO H SO NaHSO Na SO 溶液溶液△
稀稀
(1)SO 2的制备
Na 2SO 3+H 2SO 4=Na 2SO 4+H 2O+SO 2↑
(2)SO 2与NaOH 的反应
SO 2+2NaOH =Na 2SO 3+H 2O (少量SO 2)
SO 2+NaOH =NaHSO 3(过量SO 2)
(三)二元弱酸与一元碱的计算
SO 2与碱反应的有关计算分析
⎩
⎪⎨⎪⎧
SO 2+2NaOH===Na 2SO 3+H 2O……①SO 2+NaOH===NaHSO 3……① SO 2与强碱NaOH 发生反应时,产物是Na 2SO 3还是NaHSO 3,取决于二者的用量,遇
到类似这样的问题,设SO 2的物质的量为n (SO 2),NaOH 的物质的量为n (NaOH),数轴代表n NaOH
n SO 2
,如下列数轴所示:
若NaOH 与SO 2按1:1反应时,发生反应:NaOH +SO 2===NaHSO 3。
若NaOH 与SO 2按2:1反应时,发生反应:2NaOH +SO 2===Na 2SO 3+H 2O 。
若n NaOH n SO 2
=2时,发生反应①,反应后的物质为Na 2SO 3。
(2)若
n NaOH
n SO 2
≤1时,发生反应①,反应后的物质为NaHSO 3。
(3)若1<n NaOH
n SO 2<2,同时发生反应①、①,反应后的物质为Na 2SO 3与NaHSO 3。
(4)若
n NaOH
n SO 2
>2,发生反应①,反应后的物质为NaOH 与Na 2SO 3。
还可以根据反应前后的Na 、S 元素守恒来进行计算
①若产物只有Na 2SO 3,可以根据Na 2SO 3的化学式可知钠原子和硫原子之比为2:1,则可以反推参加反应的NaOH 与SO 2中的钠原子和硫原子之比为2:1,则可以反推参加反应的n(NaOH):n(SO 2)=2:1。
②若产物只有NaHSO 3,可以根据NaHSO 3的化学式可知钠原子和硫原子之比为1:1,则可以反推参加反应的NaOH 与SO 2中的钠原子和硫原子之比为1:1,则可以反推参加反应的n(NaOH):n(SO 2)=1:1。
③若产物成分复杂,那也不过只有以下几种情况:a.SO 2与NaHSO 3;b.Na 2SO 3与NaHSO 3;c.NaOH 与Na 2SO 3,均可以先设未知量列,再根据钠元素和硫元素守恒来列等式进行计算。
四、陌生的含硫化合物
近几年高考对硫及其化合物的考查,除了常见的二氧化硫、硫酸、亚硫酸盐等物质外,还涉及硫代硫酸钠(Na 2S 2O 3)、焦亚硫酸钠(Na 2S 2O 5)、陌生的含硫化合物等。
下面介绍几种含硫化合物的性质,理解这些物质的性质主要从S 元素的化合价入手。
(一)硫代硫酸钠(Na 2S 2O 3)
其结晶水合物俗称海波或大苏打,S 元素的化合价为+2价,具有还原性。
①遇酸不稳定:Na 2S 2O 3+2HCl===2NaCl +S↓+SO 2↑+H 2O ;
②还原性:2Na 2S 2O 3+I 2===Na 2S 4O 6+2NaI ,这是分析化学中“碘量法”定量测定碘的一个重要反应。
(二)焦亚硫酸钠(Na 2S 2O 5)
S 元素的化合价为+4价,与亚硫酸盐一样具有还原性。
①制备:2NaHSO 3=====△
Na 2S 2O 5+H 2O 。
②还原性:S 2O 2-5+2I 2+3H 2O===2SO 2-
4+4I -+6H +。
(三)连二亚硫酸钠(Na 2S 2O 4)
Na 2S 2O 4俗称保险粉,S 元素的化合价为+3价,具有还原性,在空气分析中常用来吸收氧气。
(四)过二硫酸钠(Na 2S 2O 8)
Na 2S 2O 8中S 元素的表观化合价为+7价,实质上S 的化合价依然是+6价,其阴离子
S 2O 2-
8结构中含有过氧链,其中2个O 原子为-1价,其余6个O 原子为-2价。
因为有过
氧链的结构,所以Na 2S 2O 8是一种强氧化剂,在Ag +催化下,能将Mn 2+氧化为MnO -4,反应的离子方程式为2Mn
2+
+5S 2O 2-8+8H 2O=====Ag +
2MnO -4+10SO 2-
4+16H +。