硫的转化第一课时资料
- 格式:ppt
- 大小:1.20 MB
- 文档页数:18

第3节硫的转化〔第一课时〕
教学目标:
2、应用氧化复原反响的知识,探究硫单质的性质。
3、认识硫黄是黄色固体,既有氧化性又有复原性,能够与铁、氧气等物质发生氧化复原反响。
知识重点:硫单质的氧化性和复原性
教法:阅读、探究
课型:新授
教学设想:以火山喷发作为硫元素在自然界中转化的切入口,在描述不同价态硫元素在自然界中转化的过程中,逐渐让学生接触含有硫元素的物质。
通过“观察与思考〞以硫与铁、硫与氧气的反响为例,引导学生学习硫与金属或非金属单质的反响,认识硫单质的氧化性和复原性。
教学过程:
板书设计:
第3节 硫的转化
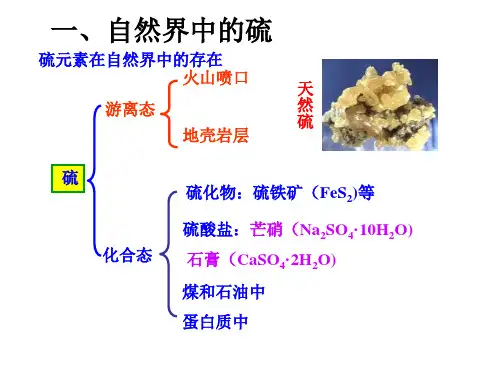
一、自然界中的硫
1、自然界中不同价态硫元素之间的转化
二、认识硫单质
1、硫的物理性质
俗称硫黄,黄色或浅黄色固体,脆,不溶于水,微溶于酒精,易溶于二硫化碳,熔、沸点不高。
2、硫的化学性质
〔1〕氧化性:〔0→-2〕
Fe + S FeS 〔黑色固体〕
Hg + S HgS 〔实验室用硫粉处理洒落的水银〕
H 2 + S H 2S 氧化性:Cl 2>O 2>S
〔2〕复原性:〔0→+4〕
S + O 2 SO 2 △ △
点燃。

硫的转化第1课时硫在自然界的存在(游离态)火山口的硫单质单斜硫硫磺斜方硫石膏 黄铁矿 CaSO 4·2H 2O FeS 2芒硝 Na 2SO 4·10H 2O 重晶石(BaSO 4) 硫在自然界的存在(化合态)(1)颜色 状态 。
硬度 。
(2)熔沸点 . (3)溶解度: 于水;微溶于, 易溶于 。
硫单质的物理性质:黄色或淡黄色 固体 小,很脆,易研成粉末 不高 不 酒精 CS 2硫的早期应用Hg + S = HgS(丹砂)S + 2KNO3 + 3C = K2S + 3CO2↑+ N2↑预测硫单质还能和哪些物质反应?0价的硫单质可升可降。
既有氧化性和还原性。
现象:燃烧、放热生成黑色物质 Fe + S = FeS 0 -2 △ 思考:硫与氯气的氧化性强弱对比现象:燃烧、放热生成黑色物质Fe + S = FeS0 -2 △ 思考:硫与氯气的氧化性 强弱对比 生成 FeS,不是Fe 2S 3 +2 +3 S 与一些变价金属(如Fe,Cu)反应时一般得到的是低价态的硫化物氯气的氧化性强于硫2Cu + S = Cu 2S △ 0 -2 生成 Cu 2S,不是 CuS+1 +2与钠反应与钠反应现象:燃烧并爆炸0 -22Na + S = Na 2S硫与非金属的反应 S + O 2 = SO 2点燃 0 +4 硫作为还原剂,具还原性 H 2 + S = H 2S△ C + 2S = CS 2 高温 0 -2 -2 0 硫作为氧化剂,具氧化性。
划火柴时常闻到的一股呛鼻的气味,就是 火柴头成份中的硫燃烧后产生的二氧化硫。
硫的用途制造硫酸 硫化橡胶 农药(石灰 硫黄合剂) 黑火药焰 火 火 柴 医药 (硫黄软膏)硫很难除去。
问题解决请你用所学的知识,帮他把试管清洗干净。
用CS2清洗硫很难除去。
请你用所学的知识,帮他把试管清洗干净。
另一位同学利用如下的原理清洗: 这一反应体现了硫的() B、还原性C、既有氧化性 又有还原性D、既无氧化性 又无还原性 3S+6KOH = 2K 2S+K 2SO 3+3H 2O△ A、氧化性 C 问题解决S 0 S S -2 +4还原性 氧化性加氧化剂 加还原剂 S + O 2 = SO 2 点燃 0 +4 硫作为还原剂H 2 + S = H 2S△ Fe + S = FeS高温 0 -2-20 硫作为氧化剂S 0 S S -2 +4 思考 如何实现下列过程? SO 2 + 2H 2S = 3S↓ + 2H 2O-10℃,易液化 颜色: 气味:毒性:状态:密度:沸点:溶解度:无色刺激性 有毒 气体 大于空气 易溶于水,(1:40) 二氧化硫的物理性质:二氧化硫的化学性质:SO2是亚硫酸的酸酐,是酸性氧化物。






硫的转化第一课时硫的转化第一课时硫的转化(第1课时)高一化学组【学习目标】1、了解硫元素在自然界中的转化、含硫元素在自然界中的存在,了解含硫物质的主要来源。
2、认识硫的物理性质,掌握硫的化学性质。
【重点、难点】硫单质的性质【学习方法】自主学习、合作学习、实验探究【学习过程】一、自然界中的硫阅读课本85页内容及86页图3-3-2,完成下列内容1、存在:硫元素在自然界中主要存在于2、转化二、认识硫单质阅读课本86页观察思考中的内容,完成实验记录,总结硫单质的性质1、存在:硫单质俗称常见的同素异形体有。
1硫的转化第一课时3、化学性质(1)硫单质的还原性写出硫与氧气反应的化学反应方程式:现象:(2)硫单质的氧化性①硫单质还可以与H2、Na、Fe、Cu、Hg等物质在一定条件下发生反应,写出它们的反应方程式:在上述反应中硫元素的化合价,表现,做。
问题:硫与变价金属反应时,能把金属氧化为高价态还是低价态?氯气呢?这说明硫与氯气哪个氧化性更强?②阅读课本87页身边的化学中的内容完成下列内容:黑火药的主要成分是反应,主要反应方程式为:在该反应中化合价发生变化的元素是氧化剂,还原剂;氧化产物还原产物(3)硫与热的碱溶液反应时,反应方程式为:2S+3K2SO3+3H2O (此反应用于除去试管中残留的硫)在该反应中硫元素的化合价,氧化剂,还原剂氧化产物,还原产物4、硫黄的用途:总结:硫元素的常见化合价有。
2硫的转化第一课时硫单质的化学性质:【自主学习】硫单质能与氢气反应生成硫化氢,试谈谈你对硫化氢的认识:【课堂检测】1、在自然界中既有游离态,又有化合态存在的元素是()A、氯B、钠C、氧D、硫2、在一定条件下,下列物质能与硫发生反应,且硫作为还原剂的是(A、CuB、H2C、FeD、O23、下列说法正确的是()A、硫是一种淡黄色的能溶于水的固体B、硫在自然界中仅以化合态存在C、可用二硫化碳除去附着在试管内壁上的硫D、硫仅有斜方硫和单斜硫两种同素异形体4、下列化合有物不能由两种单质直接化合而生成的是()A、Fe2S3B、NaC、FeCl2D、FeCl35、做完实验后的试管内壁上的硫可用哪些物质来清洗:3 )硫的转化第一课时【课后练习】1、能说明硫的非金属性比氯弱的事实是()A、氯气可溶于水而硫不溶于水B、硫的最高价态为+6价,而氯的最高价态为+7价C、硫的最低价态为-2价,而氯的最低价态为-1价D、与铁和铜金属反应时,硫将金属氧化为低价态,而氯却能将它们氧化成高价态2、对于反应2SO3+2K2S+3H20,下列说法中正确的是( )A.S是氧化剂,KOH是还原剂B.若3mol硫完全反应,则反应中共转移了4mol电子C.还原剂与氧化剂的质量之比为2:1D.氧化产物与还原产物的物质的量之比为3:23、6.4gCu和3.2gS充分反应后,对其结果叙述不正确的是()A、Cu有剩余B、S有剩余C、产物中只有Cu2SD、反应中有0.1mol电子转移4、某同学做实验是不小心将温度计打碎了,他首先将大个的汞珠收集起来,然后在碎汞上面撒了一层硫粉。

《硫的转化》讲义一、硫的存在硫在自然界中分布广泛,存在形式多样。
在地球上,硫主要以化合态和游离态存在。
化合态的硫存在于多种矿物质中,如黄铁矿(FeS₂)、黄铜矿(CuFeS₂)、石膏(CaSO₄·2H₂O)等。
这些矿物质是工业上获取硫的重要来源。
游离态的硫通常存在于火山口附近以及地壳的岩层中。
此外,硫还存在于生物体中,是某些氨基酸(如半胱氨酸、甲硫氨酸)的组成成分,对于生命活动具有重要意义。
二、硫单质的性质1、物理性质硫是一种黄色固体,有多种同素异形体,常见的有斜方硫和单斜硫。
硫不溶于水,微溶于酒精,易溶于二硫化碳。
2、化学性质(1)氧化性硫与金属反应时,一般生成低价金属硫化物。
例如,硫与铁加热反应生成硫化亚铁(FeS),化学方程式为:Fe + S =△= FeS 。
硫与铜在加热条件下反应生成硫化亚铜(Cu₂S),化学方程式为:2Cu + S =△= Cu₂S 。
(2)还原性硫在一定条件下可以被氧气氧化为二氧化硫。
化学方程式为:S +O₂=点燃= SO₂。
三、硫的氧化物1、二氧化硫(SO₂)(1)物理性质二氧化硫是一种无色、有刺激性气味的气体,易溶于水,密度比空气大。
(2)化学性质①酸性氧化物的通性与水反应生成亚硫酸:SO₂+ H₂O ⇌ H₂SO₃。
与碱反应,如与氢氧化钠溶液反应:SO₂(少量)+ 2NaOH = Na₂SO₃+ H₂O ;SO₂(过量)+ NaOH = NaHSO₃。
②氧化性和还原性二氧化硫既有氧化性又有还原性。
氧化性表现为:SO₂+ 2H₂S =3S↓ + 2H₂O 。
还原性表现为:2SO₂+ O₂=催化剂、加热= 2SO₃。
③漂白性二氧化硫能使品红溶液褪色,但加热后又恢复原色,这是因为二氧化硫与某些有色物质结合生成不稳定的无色物质。
2、三氧化硫(SO₃)(1)物理性质三氧化硫是一种无色易挥发的固体,熔点为168℃,沸点为448℃。
(2)化学性质三氧化硫是酸性氧化物,与水剧烈反应生成硫酸:SO₃+ H₂O =H₂SO₄。
第三章第3节硫的转化(第一课时硫、二氧化硫)课前延伸学案教师寄语:学贵有思:不积跬步,无以至千里,不积小流,无以成江海。
[教学目标]: 1.了解硫元素在自然界中的转化。
含硫物质在自然界的存在以及主要来源。
2.认识单质硫的物理性质和化学性质。
重点:单质硫的氧化性、还原性(与Fe,O2的反应)一、自然界中的硫1.自然界中不同价态硫元素间的转化【阅读】:教材85页和86页图3-3-2问题:1.硫元素常见的化合价有哪些?2.火山爆发后地表中不同价态的硫是如何转化?(画出转化关系图)3.火山爆发后地下中不同价态的硫是如何转化?(画出转化关系图)2.单质硫⑴、物理性质观察实验完成下表,认识硫的物理性质。
⑵化学性质:预测:1、S元素常见的化合价有-2,0,+4,+6,从氧化还原角度预测硫的性质:。
2.硫是一种非金属单质,从物质分类的角度预测硫可以与哪些类别的物质反应?。
⑴【实验探究】实验记录:⑵、硫是一种非金属,加热条件下能与氢气反应,写出反应的化学方程式。
⑶用途:自读课本了解硫用途。
黑火药爆炸所发生的主要反应得化学方程式为:S+2KNO3+3C==K2S+3CO2↑+N2↑,在此反应中硫表现什么性质?指出氧化剂、还原剂。
二、二氧化硫1.物理性质:二氧化硫是一种色有气味的有毒气体,易液化;密度比空气,溶于水,常温、常压下1体积水大约能溶解体积的二氧化硫。
2.化学性质:二氧化硫是一种酸性氧化物,它的水溶液呈。
A、SO2是酸性氧化物:a.与水反应:(H2SO3容易被氧化,生成硫酸)b.与碱反应:与NaOH溶液反应与Ca(OH)2溶液反应将SO2持续通入澄清石灰水中,现象如何?【预习达标】1.下列关于叙述正确的是()A.硫单质为淡黄色的晶体,不溶于水,易溶于酒精B.硫单质质脆易粉碎,易溶二硫化碳,加热易熔化C.只能以化合态存在于自然界中D.硫是生物生长所需要的一种元素2.下列化合物中,不能由单质直接化合而成的是()A.FeSB.FeCl2C.SO2D.NO3.Cl2的氧化性比S的氧化性强,最主要的事实是()A.通常情况下硫为浅黄色固体,而氯气为黄绿色气体B.硫不溶于水,而氯气能溶于水C.与金属或氯气反应时,硫被还原为—2价而氯被还原成—1价D.与同一种金属反应时,金属被硫氧化成低价态,被氯气氧化成高价态4.实验室常用热的NaOH溶液洗去试管口的沾有的S,其反应如下6NaOH+3S=2Na2S+Na2SO3+3H2O 在此反应中硫表现的是()A.氧化性 B.还原性.C.既有氧化性又有还原性D.既无氧化性又无还原性第三章第3节硫的转化(第一课时硫、二氧化硫)课内探究学案教师寄语:学贵有思:不积跬步,无以至千里,不积小流,无以成江海。