第4章 多组分系统自测题
- 格式:doc
- 大小:75.00 KB
- 文档页数:2

第四章多组分系统热力学选择题1. 在373.15K和101325Pa•下水的化学势与水蒸气化学位的关系为(A) μ(水)=μ(汽) (B) μ(水)<μ(汽)(C) μ(水)>μ(汽) (D) 无法确定答案:A。
两相平衡,化学势相等。
2.下列哪种现象不属于稀溶液的依数性(A) 凝固点降低(B)沸点升高(C) 渗透压(D)蒸气压升高答案:D。
稀溶液的依数性之一为蒸气压下降。
3.98K时,A、B两种气体在水中的亨利常数分别为 k1和 k2,且k1> k2,则当P1=P2时,A、B在水中的溶解量C1 和 C2 的关系为(A) C1> C2 (B) C1< C2 (C) C1= C2 (D) 不能确定答案:B4.将非挥发性溶质溶于溶剂中形成稀溶液时,将引起(A) 沸点升高 (B) 熔点升高 (C) 蒸气压升高 (D) 都不对答案:A。
稀溶液的依数性包括沸点升高、凝固点下降、蒸气压下降和渗透压。
5. 涉及纯物质标准状态的下列说法中不正确的是(A) 纯理想气体的标准状态就是标准压力P(100KPa)下的状态(B) 纯液体物质的标准状态就是标准压力P(100KPa)下的纯液体(C) 纯固体物质的标准状态就是标准压力P(100KPa)下的纯固体(D) 不同的物质在相同温度下都处于标准状态时,它们的同一热力学函数值都应相同答案:D6. 稀溶液的依数性包括蒸汽压下降、沸点升高、凝固点降低和渗透压,下面的陈述都与它们有关,其中正确的是(A) 只有溶质不挥发的稀溶液才有这些依数性(B) 所有依数性都与溶液中溶质的浓度成正比(C) 所有依数性都与溶剂的性质无关(D) 所有依数性都与溶质的性质有关答案:B7. 关于亨利系数, 下面的说法中正确的是(A) 其值与温度、浓度和压力有关(B) 其值只与温度、溶质性质和浓度标度有关(C) 其值与溶剂性质、温度和浓度大小有关(D) 其值与温度、溶剂和溶质的性质及浓度标度等因素都有关答案:D8. 定义偏摩尔量时规定的条件是(A) 等温等压 (B) 等熵等压(C) 等温, 溶液浓度不变 (D) 等温等压, 溶液浓度不变答案:D9. 关于偏摩尔量, 下面的说法中正确的是(A) 偏摩尔量的绝对值都可求算(B) 系统的容量性质才有偏摩尔量(C) 同一系统的各个偏摩尔量之间彼此无关(D) 没有热力学过程就没有偏摩尔量答案:B10. 关于偏摩尔量, 下面的叙述中不正确的是(A) 偏摩尔量是状态函数, 其值与物质的数量无关(B) 系统的强度性质无偏摩尔量(C) 纯物质的偏摩尔量等于它的摩尔量(D) 偏摩尔量的数值只能为整数或零答案:D11. 影响沸点升高常数和凝固点降低常数值的主要因素是(A) 溶剂本性 (B) 温度和压力 (C )溶质本性(D) 温度和溶剂本性答案:A 。
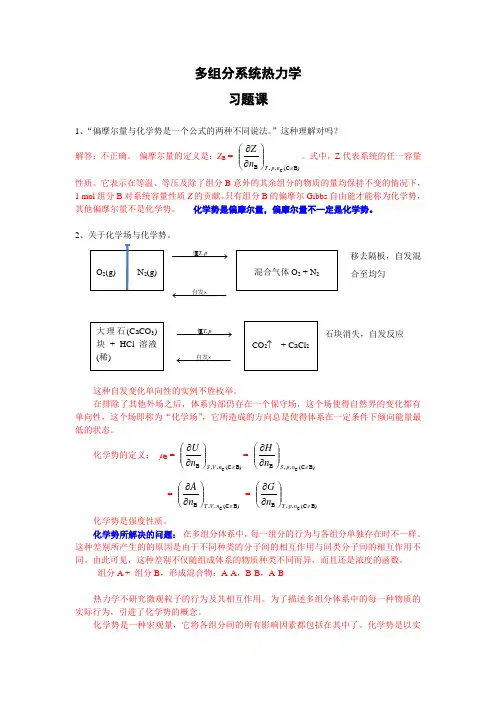
多组分系统热力学习题课1、“偏摩尔量与化学势是一个公式的两种不同说法。
”这种理解对吗? 解答:不正确。
偏摩尔量的定义是:Z B = B)(C ,,B C ≠⎪⎪⎭⎫⎝⎛∂∂np T n Z 。
式中,Z 代表系统的任一容量性质。
它表示在等温、等压及除了组分B 意外的其余组分的物质的量均保持不变的情况下,1 mol 组分B 对系统容量性质Z 的贡献。
只有组分B 的偏摩尔Gibbs 自由能才能称为化学势,其他偏摩尔量不是化学势。
化学势是偏摩尔量,偏摩尔量不一定是化学势。
2、关于化学场与化学势。
−−−−→−pT,恒 移去隔板,自发混合至均匀−−−−−←⨯自发−−−−→−pT,恒 石块消失,自发反应 −−−−−←⨯自发这种自发变化单向性的实例不胜枚举。
在排除了其他外场之后,体系内部仍存在一个保守场,这个场使得自然界的变化都有单向性,这个场即称为“化学场”,它所造成的方向总是使得体系在一定条件下倾向能量最低的状态。
化学势的定义: μB = B)(C ,,B C ≠⎪⎪⎭⎫⎝⎛∂∂nV S n U = B)(C ,,B C ≠⎪⎪⎭⎫⎝⎛∂∂np S n H= B)(C ,,B C ≠⎪⎪⎭⎫⎝⎛∂∂nV T n A = B)(C ,,B C ≠⎪⎪⎭⎫⎝⎛∂∂np T n G化学势是强度性质。
化学势所解决的问题: 在多组分体系中,每一组分的行为与各组分单独存在时不一样。
这种差别所产生的的原因是由于不同种类的分子间的相互作用与同类分子间的相互作用不同。
由此可见,这种差别不仅随组成体系的物质种类不同而异,而且还是浓度的函数。
组分A + 组分B ,形成混合物:A-A ,B-B ,A-B热力学不研究微观粒子的行为及其相互作用。
为了描述多组分体系中的每一种物质的实际行为,引进了化学势的概念。
化学势是一种宏观量,它将各组分间的所有影响因素都包括在其中了。
化学势是以实际应用为背景引入的一个概念,有很强的实践性。
化学势的物理意义:μB = B)(C ,,B C ≠⎪⎪⎭⎫⎝⎛∂∂np T n G = 偏摩尔Gibbs 自由能G B它表示在T 、p 和其他组分的含量不变的条件下,增加1 mol 组分B 对于体系总Gibbs自由能的贡献。

第四章多组分系统热力学测试第四章多组分系统热力学测试一、单项选择题(每题2分,共20题)1、已知在318K时纯丙酮的蒸汽压为43.063kPa,今测得氯仿的摩尔分数为0.30的丙酮-氯仿二元体系中丙酮的蒸汽压为26.771kPa , 则此体系()A、属于理想液态化合物B、对丙酮为负偏差C、对丙酮为正偏差D、无法识别其特点2、下列对于偏摩尔量的理解中,错误的是:()。
A、等温等压条件下,向一个含有物质的量无限大的系统中可逆地增加1mol某一组分B时,所引起的系统吉布斯函数的增加;B、等温等压条件下,向一个含有一定量物质的系统中加入1mol 某一组分B所引起的系统吉布斯函数的增加;C、等温等压条件下,向一个含有一定量物质的系统中可逆地加入dnB组分B所引起的系统吉布斯函数的微量增加。
3、在298 K时,A和B两种气体单独在某一溶剂中溶解,遵守亨利定律,亨利常数分别为k x,A和k x,B,且知k x,A>k x,B,则当A和B压力的平衡值相同时,在一定的该溶剂中所溶解的物质的量是:()。
A、A的物质的量大于B的物质的量;B、A的物质的量小于B的物质的量;C、A的物质的量等于B的物质的量;D、A的物质的量与B的物质的量无法比较。
4、在101.325 kPa下,有0.002 mol的气体溶解在1000 g水中。
当在相同温度下压力增加至202.65 kPa时,就有0.004 mol该气体溶于1000 g水中,描述这一实验规律的定律是:()。
A、理想气体定律;B、拉乌尔定律;C、道尔顿分压定律;D、亨利定律。
5、在拉乌尔定律表达式 p B=p B*x B中,p B*:()。
A、只是温度的函数,与溶质、溶剂的性质无关;B、与溶质、溶剂的性质有关,但与温度无关;C、与温度、溶剂的性质有关,与溶质性质无关;D、与温度、溶质的性质有关,与溶剂性质无关。
6、溶剂服从拉乌尔定律,溶质服从亨利定律的二组分溶液是:()。

物理化学课件及考试习题试卷答案第4章多组分系统热⼒学习题及答案.(DOC)第三章多组分系统热⼒学⼀、填空题1、只有系统的____性质才具有偏摩尔量。
⽽偏摩尔量⾃⾝是系统的____性质。
偏摩尔量的值与系统中各组分的浓度____。
混合适物系统中各组分的同⼀偏摩尔量间具有两个重要的性质,分别是____与____。
2、如同温度是热传导的推动⼒⼀样,化学势是____传递的推动⼒。
在恒温恒压下多相平衡的条件是________________。
以焓表⽰的组分i的化学势可写成µi=____。
3、混合理想⽓体中任⼀组分B的化学势________;理想溶液中任⼀组分B的化学势________;稀溶液中溶剂A的化学势________。
4、由纯组分在恒温恒压下组成理想混合物时,△mix S=__0;△mix G__0;△mix H__0;△ix V__0。
5、理想溶液混合时,?mix V ,?mix S ,?mix G ,?mix H 。
6、⽐较⽔的化学势的⼤⼩(此处p=101.325kPa):(填>、< 或=)①µ(l,100℃,p)____µ(g,100℃,p)②µ(l,100℃,p)____µ(l,100℃,2p)③µ(g,100℃,p)____µ(g,100℃,2p)④µ(l,100℃,2p)____µ(g,100℃,2p)⑤µ(l,101℃,p)____µ(g,101℃,p)7、⾮理想溶液溶质的化学势表⽰式____,其标准态为____。
8、在⼀定的温度及压⼒下,某物质液汽两相达平衡,则两相的化学势µB(l)与µB(g)_____若维持压⼒不变,升⾼温度,则µB(l)和µB(g)都______;但µB(l)⽐µB(g)______。

第4章 多组分系统热力学思考题:1. 理想液态混合物和理想气体的微观模型有何不同?2. 理想稀溶液要“稀”到什么程度才算理想稀溶液?3. 在相同的温度和压力下,相同质量摩尔浓理想液态混合物和理想气体的微观模型有何不同?度的葡萄糖和食盐水溶液的渗透压是否相同?4. 在一完全密闭的透明恒温箱中放有两个体积相同的杯子。
往A ,B 杯中分别倒入1/3体积的纯水和蔗糖水溶液,并置于该恒温箱中。
假设恒温箱很小,有少量水蒸发即可达到饱和。
那么经足够长时间后,两杯中会发生什么现象?解释原因。
选择题:1. 下述各量中,哪些是偏摩尔量?( ) A. C n P T B n H ,,⎟⎟⎠⎞⎜⎜⎝⎛∂∂ B. C n V T B n U ,,⎟⎟⎠⎞⎜⎜⎝⎛∂∂ C. C n V T p A ,,⎟⎟⎠⎞⎜⎜⎝⎛∂∂ D. C n V p T G ,,⎟⎠⎞⎜⎝⎛∂∂ E. C n p T B n V ,,⎟⎟⎠⎞⎜⎜⎝⎛∂∂ F. Cn p S B n H ,,⎟⎟⎠⎞⎜⎜⎝⎛∂∂ 下述各量中,哪些不是化学势?( )A. *,B m G B. C n S V B n U ,,⎟⎟⎠⎞⎜⎜⎝⎛∂∂ C. C n p T B n H ,,⎟⎟⎠⎞⎜⎜⎝⎛∂∂ D. Cn p T B n G ,,⎟⎟⎠⎞⎜⎜⎝⎛∂∂ E. B μ F. Cn V T B n A ,,⎟⎟⎠⎞⎜⎜⎝⎛∂∂ 2. 单一组分过冷液体的化学势比其固体的化学势( )A. 高B. 低C. 相等D. 不可比较3. 重结晶制盐的过程中,析出的NaCl 固体的化学势比母液中NaCl 的化学势( )A. 高B. 低C. 相等D. 不可比较4.在溶剂中加入非挥发性溶质后沸点升高,说明该溶剂的化学势比未加溶质前的化学势()A. 高B. 低C. 相等D. 不可比较5.恒温恒压下,在A、B组成的均相体系中,若A的偏摩尔体积随浓度的改变而增加时,B的偏摩尔体积将()A. 增加B. 减少C. 不变D. 不一定6.0℃,2PΘ时,水的化学势比冰的化学势()A. 高B. 低C. 相等D. 不可比较7.混合理想气体中组分i的标准态与混合非理想气体中组分i的标准态相比较,其关系为()A. 相同B. 不同C. 不一定相同D. 无关系8.下列哪种方法对消灭蚂蟥更有利?()A. 用手拍B. 用刀切成几段C. 扔到岸边暴晒D. 扔到岸边向其身体撒盐9.恒温下,B溶于A中组成溶液。

[192-3] 在25℃,1 kg 水(A)中溶有醋酸(B),当醋酸的质量摩尔浓度b B 介于0.16 mol·kg -1和2.5 mol·kg -1之间时,溶液的总体积2113)]kg mol /([1394.0)]kg mol /([832.51935.1002cm /--⋅+⋅+=B B b b V求:⑴把水(A)和醋酸(B)的偏摩尔体积分别表示成b B 的函数关系; ⑵b B = 1.5 mol·kg -1时水和醋酸的偏摩尔体积。
解:An p T B B n V V ,,⎪⎪⎭⎫⎝⎛∂∂=⑴ Anp T B A b V m ,,1⎪⎪⎭⎫ ⎝⎛∂∂=()An p T B BB A b b b m ,,21394.0832.51935.10021⎥⎦⎤⎢⎣⎡∂++∂= ()13mol cm )2788.0832.51(-⋅+=B bA BB A n V n V V -=AA BA B M m V m b V -=3-210016.181)2788.0832.51(11394.0832.51935.1002⨯+⨯-++=B B B B b b b b132m o l cm )0025114.0-0689.18(-⋅=B b⑵将b B = 1.5 mol·kg -1代入上式,得)mol cm (2502.525.12788.0832.512788.0832.5113-⋅=⨯+=+=B B b V)(1322mol cm 18.06325.10025114.0-0689.180025114.0-0689.18-⋅=⨯==B A b V √[192-4] 60℃时甲醇(A )的饱和蒸气压是 83.4 kPa ,乙醇(B )的饱和蒸气压是 47.0 kPa 。
二者可形成理想液态混合物。
若混合物中二者的质量分数各为0.5,求 60℃时此混合物的平衡蒸气组成,以摩尔分数表示。

第四章多组分系统热力学练习1 题及答案.第四章多组分系统热力学练习1题及答案.第四章多组分系统热力学练习题及答案1.20 C下HCl溶于苯中达平衡,气相中HCl的分压为101.325 kPa时,溶液中HCl的摩尔分数为0.0425。
已知20 ?C时苯的饱和蒸气压为10.0 kPa,若20?C 时HCl和苯蒸气总压为101.325 kPa,求100 g笨中溶解多少克HCl。
解:设HCl在苯中的溶解符合Henry定律2.60 ?C时甲醇的饱和蒸气压是84.4 kPa,乙醇的饱和蒸气压是47.0 kPa。
二者可形成理想液态混合物。
若混合物的组成为二者的质量分数各50 %,求60 ?C 时此混合物的平衡蒸气组成,以摩尔分数表示。
解:质量分数与摩尔分数的关系为求得甲醇的摩尔分数为根据Raoult定律3.80 ?C是纯苯的蒸气压为100 kPa,纯甲苯的蒸气压为38.7 kPa。
两液体可形成理想液态混合物。
若有苯-甲苯的气-液平衡混合物,80 ?C时气相中苯的摩尔分数,求液相的组成。
解:根据Raoult定律t时纯AB,两液体能形成理想液态混合物。
已知在温度的饱和蒸气压A4.。
的饱和蒸气压B,纯t下,于气缸中将组成为的A, B(1)在温度混合气体恒温缓慢压缩,求凝结出第一滴微小液滴时系统的总压及该液滴的组成(以摩尔分数表示)为多少?t下开始沸腾,,温度两液体混合,并使此混合物在100 kPa2)若将A, B(求该液态混合物的组成及沸腾时饱和蒸气的组成(摩尔分数)。
解:1. 由于形成理想液态混合物,每个组分均符合Raoult定律; 2. 凝结出第t一滴微小液滴时气相组成不变。
因此在温度t 100 kPa,温度下开始沸腾,要求混合物在5. 已知101.325kPa下,纯苯(A)的正常沸点和摩尔蒸发焓分别为353.3K和?1,纯甲苯(B)的正常沸点和摩尔30762J·mol蒸发焓分别为383.7K和?1。

第四章多组分系统热力学练习题及答案1.20 ︒C下HCl溶于苯中达平衡,气相中HCl的分压为101.325 kPa时,溶液中HCl的摩尔分数为0.0425。
已知20 ︒C时苯的饱和蒸气压为10.0 kPa,若20︒C 时HCl和苯蒸气总压为101.325 kPa,求100 g笨中溶解多少克HCl。
解:设HCl在苯中的溶解符合Henry定律2.60 ︒C时甲醇的饱和蒸气压是84.4 kPa,乙醇的饱和蒸气压是47.0 kPa。
二者可形成理想液态混合物。
若混合物的组成为二者的质量分数各50 %,求60 ︒C 时此混合物的平衡蒸气组成,以摩尔分数表示。
解:质量分数与摩尔分数的关系为求得甲醇的摩尔分数为根据Raoult定律3.80 ︒C是纯苯的蒸气压为100 kPa,纯甲苯的蒸气压为38.7 kPa。
两液体可形成理想液态混合物。
若有苯-甲苯的气-液平衡混合物,80 ︒C时气相中苯的摩尔分数,求液相的组成。
解:根据Raoult定律4. A,B两液体能形成理想液态混合物。
已知在温度t时纯A的饱和蒸气压,纯B的饱和蒸气压。
(1)在温度t下,于气缸中将组成为的A, B混合气体恒温缓慢压缩,求凝结出第一滴微小液滴时系统的总压及该液滴的组成(以摩尔分数表示)为多少?(2)若将A, B两液体混合,并使此混合物在100 kPa,温度t下开始沸腾,求该液态混合物的组成及沸腾时饱和蒸气的组成(摩尔分数)。
解:1. 由于形成理想液态混合物,每个组分均符合Raoult定律; 2. 凝结出第一滴微小液滴时气相组成不变。
因此在温度t混合物在100 kPa,温度t下开始沸腾,要求5. 已知101.325kPa下,纯苯(A)的正常沸点和摩尔蒸发焓分别为353.3K和30762J·mol-1,纯甲苯(B)的正常沸点和摩尔蒸发焓分别为383.7K和31999J·mol-1。
苯和甲苯形成理想液态混合物,若有该种液态混合物在101.325kPa,373.1K沸腾,计算混合物的液相组成。

第4章 多组分系统自测题1. 在一定外压下,易挥发溶剂A 中加入不挥发溶质B ,形成稀溶液。
在此稀溶液浓度范围内A 与B 可形成固溶体。
此稀溶液的凝固点随着b B 的增加而( D ),它的沸点随着b B 的增加而( A ). A 升高;B 降低;C 不发生变化;D 无法判断。
2. 在某一定温度T 下,由纯液态的A 与B 形成理想液态混合物。
已知**A Bp p <,当气-液两相达到平衡时,气相组成y B总是( A )液相组成x B 。
A >;B <;C =;D 正比于。
3. 在T =300K , p =102.0 kPa 的外压下,质量摩尔浓度b =0.002 mol ⋅kg -1的蔗糖水溶液的渗透压为1∏。
b =0⋅002 mol ⋅kg -1 KCl 水溶液的渗透压为2∏,则必存在2∏( A )1∏的关系。
A >;B <;C =;D 无法判断。
4. 在101.325 kPa 的大气压力下,将蔗糖在水中的稀溶液缓慢地降温,首先析出的为纯冰。
相对于纯水而言,加人蔗糖将会出现:蒸气压( B );沸点( A );凝固点( B )。
A 升高;B 降低;C 不变;D 无一定变化规律。
5. 在恒温、恒压下,理想液态混合物混合过程的①mix m V ∆( B );②mix m H ∆( B );③ mix m S ∆( A );④mix m G ∆( C );⑤mix m U ∆( B );⑥mix m A ∆( C )。
A >0;B =0:C <0;D 不能确定。
6. 在T ,p 及组成一定的真实溶液中,溶质的化学势可表示为:B μ=B μ+B ln RT a ,采用不同的标准态(x B =1, b B =b ,c B =c ,…)时,上式中的B μ ( A );a B ( A ), B μ( B )。
(a)变;(b)不变;(c)变大;(d)变小。
7. 在一定压力下,在A ,B 二组分溶液的温度-组成图的最高(或最低)恒沸点处,气-液两相组成的关系为:气相摩尔分数y B ( C )液相摩尔分数x B 。

1、在恒温抽空的玻璃罩中封入两杯液面相同的糖水(A) 和纯水(B)。
经历若干时间后,两杯液面的高度将是:( )(A) A 杯高于B 杯(B) A 杯等于B 杯(C) A 杯低于B 杯(D) 视温度而定2、在温度T时,纯液体A 的饱和蒸气压为p A*,化学势为μA*,并且已知在p∃压力下的凝固点为T f*,当A 中溶入少量与A 不形成固态溶液的溶质而形成为稀溶液时,上述三物理量分别为p A,μ A,T f ,则( )(A) p A*< p A,μA*<μA,T f* < T f(B) p A*> p A,μA*<μA,T f* < T f(C) p A*< p A,μA*<μA,T f* > T f(D) p A*> p A,μA*>μA,T f* > T f3、已知373.15 K 时,液体A 的饱和蒸气压为133.32 kPa,另一液体B 可与A 构成理想液体混合物。
当 A 在溶液中的物质的量分数为1/2 时,A 在气相中的物质量分数为2/3 时,则在373.15 K时,液体B 的饱和蒸气压应为:( )(A) 66.66 kPa (B) 88.88 kPa (C) 133.32 kPa (D) 266.64 kPa4、关于亨利系数,下列说法中正确的是: ( )(A)其值与温度、浓度和压力有关(B)其值与温度、溶质性质和浓度有关(C)其值与温度、溶剂性质和浓度有关(D)其值与温度、溶质和溶剂性质及浓度的标度有关5、关于亨利定律,下面的表述中不正确的是:( )(A)若溶液中溶剂在某浓度区间遵从拉乌尔定律,则在该浓度区间组分B必遵从亨利定律(B)温度越高、压力越低,亨利定律越正确(C)因为亨利定律是稀溶液定律,所以任何溶质在稀溶液范围内都遵守亨利定律(D)温度一定时,在一定体积的溶液中溶解的气体体积与该气体的分压力无关6、298 K时,HCl(g,M r=36.5)溶解在甲苯中的亨利常数为245 kPa⋅kg⋅mol-1,当HCl(g)在甲苯溶液中的浓度达2%时,HCl(g)的平衡压力为:( )(A) 138 kPa (B) 11.99 kPa (C) 4.9 kPa (D) 49 kPa7、下述诸说法正确的是:( )(1) 溶液的化学势等于溶液中各组分的化学势之和(2) 对于纯组分,则化学势等于其Gibbs自由能(3) 理想溶液各组分在其全部浓度范围内服从Henry定律(4) 理想溶液各组分在其全部浓度范围内服从Raoult定律(A) (1),(2) (B) (2),(3) (C) (2),(4) (D) (3),(4)8、设N2和O2皆为理想气体。

第四章多组分系统热力学及其在溶液中的应用一、选择题1.恒温时,在A-B双液系中,若增加A组分使其分压p A上升,则B 组分在气相中的分压p B将()。
(a)上升(b)下降(c)不变(d)不确定2.已知373K时液体A的饱和蒸气压为105Pa,液体B的饱和蒸气压为105Pa。
设A和B构成理想溶液,则当A在溶液中的摩尔分数为时,在气相中A的摩尔分数为()。
(a)1 (b)1/2 (c)2/3 (d)1/33.,101325Pa下,1dm3水中能溶解49mol氧或氮,在标准情况下,1dm3水中能溶解的空气的量为()。
(a) (b) (c)96mol (d)4.一封闭钟罩中放一杯纯水A和一杯糖水B,静置足够长时间后发现()。
(a)A杯水减少,B杯水满后不再变化(b)A杯水减少至空杯,B杯水满后溢出(c) B杯水减少,A杯水满后不再变化(d) B杯水减少至空杯,A杯水满后溢出5.保持压力不变,在稀溶液中溶剂的化学势随温度降低而()。
(a)降低(b)不变(c)增大(d)不确定6.温度为273K,压力为1106Pa下液态水和固态水的化学势(l)和(s)之间的关系为()。
(a)(l)>(s)(b)(l)=(s)(c)(l)<(s)(d)无确定关系7.在等温、等压下,溶剂A和溶质B形成一定浓度的稀溶液,采用不同浓度表示的话,则()。
(a)溶液中A和B的活度不变(b)溶液中A和B的标准化学势不变(c)溶液中A和B的活度因子不变(d)溶液中A和B的化学势值不变8.有一稀溶液质量摩尔浓度为m,沸点升高值为T b,凝固点降低值为T f,则()。
(a)T f >T b(b)T f =T b(c)T f <T b(d)无确定关系9.有四杯含不同溶质相同质量摩尔浓度(m=1molkg-1)的水溶液,分别测定其沸点,沸点升高最多的是()。
(a)Al2(SO4)3(b) MgSO4(c) K2SO4(d) C6H5SO3H10.烧杯A中装有,273K的水,烧杯B中装有,273K的冰水混合物(其中水和冰),用滴管向两烧杯中分别滴入数滴浓H2SO4,则两烧杯中水的温度变化将是()。
第三章多组分系统热力学一、填空题1、只有系统的____性质才具有偏摩尔量。
而偏摩尔量自身是系统的____性质。
偏摩尔量的值与系统中各组分的浓度____。
混合适物系统中各组分的同一偏摩尔量间具有两个重要的性质,分别是____与____。
2、如同温度是热传导的推动力一样,化学势是____传递的推动力.在恒温恒压下多相平衡的条件是________________.以焓表示的组分i的化学势可写成µi=____.3、混合理想气体中任一组分B的化学势________;理想溶液中任一组分B的化学势________;稀溶液中溶剂A的化学势________。
4、由纯组分在恒温恒压下组成理想混合物时,△mix S=__0;△mix G__0;△mix H__0;△ix V__0。
5、理想溶液混合时,∆mix V ,∆mix S ,∆mix G ,∆mix H 。
6、比较水的化学势的大小(此处p=101.325kPa):(填〉、〈或=)①μ(l,100℃,p)____μ(g,100℃,p)②μ(l,100℃,p)____μ(l,100℃,2p)③μ(g,100℃,p)____μ(g,100℃,2p)④μ(l,100℃,2p)____μ(g,100℃,2p)⑤μ(l,101℃,p)____μ(g,101℃,p)7、非理想溶液溶质的化学势表示式____,其标准态为____。
8、在一定的温度及压力下,某物质液汽两相达平衡,则两相的化学势μB(l)与μB(g)_____若维持压力不变,升高温度,则μB(l)和μB(g)都______;但μB(l)比μB(g)______。
9、理想溶液中任意组分B的化学势:μB=_______________。
10、298K、101。
325kPa,有两瓶萘的苯溶液,第一瓶为2升,溶有0。
5mol萘,第二瓶为1升,溶有0.25mol 萘,若以μ1和μ2表示两瓶中萘的化学势,则它们的关系为__________. 11、糖可以顺利溶解在水中,说明固体糖的化学势较糖水中的糖的化学势____。
第四章多组分体系统热力学一.选择题1. 当某溶质溶于某溶剂形成一定的溶液时,若采用不同的浓标,则下列描述溶质的各说法中正确的是()A. 浓度数据相同B. 活度数据相同C. 活度因子相同D. 化学势相同2. 恒温时在A和B的二元液系中,若增加A组分使其分压p A上升,则B组分在气相中的分压p B将( )A. 上升B. 不变C. 下降D. 不确定3. 沸点升高,说明在溶剂中加入非挥发性溶质后,该溶剂的化学势与加入前比较将()A. 升高B. 不变C. 降低D. 无法确定4. 在α,β相中均含有A和B两种物质,达到相平衡时,下列各式正确的是()A. B. C. D.5. 在298.15K时0.01m ol.dm-3葡萄糖水溶液的渗透压π1,0.01m ol.dm-3硫酸钾水溶液的渗透压π2 ,下列各项正确的是( )A. B. C. D. 不能确定6. 组分B从a相扩散入β相中,则以下说法正确的有()A. 总是从浓度高的相扩散入浓度低的相B. 总是从浓度低的相扩散到浓度高的相C. 平衡时两相浓度相等D. 总是从高化学势移向底化学势7. 在363,15K,101.325kP a时水和水蒸气构成两相平衡,两相化学势的关系为()A. B. C. D. 不能确定8. 在298.15K,A和B两种气体在某种溶剂中的亨利系数分别为k A和k B并有k A>k B当A和B具有相同的分压力时,二者的浓度关系是( )A. B. C. D. 不能确定9. 对非理想液体中的溶质,当选假想的,符合亨利定律的,的状态为标准态时,下列结果正确的是( )时,时,时,时,,10. A和B形成理想溶液,已知373K时纯A的蒸气压为133.3kP a,纯 B的蒸气压为166.66kP a,与此二元溶液成平衡的气相中的摩尔分数为2/3时,溶液中A的摩尔分数为( )A.1B.2/3C. 1/2D.1/411.在298.15K,P a时某溶液中溶剂A的蒸气压为p A,化学势为u A,凝固点为T A,上述三者与纯溶剂的相比,有()12.下列活度与标准态的关系表述正确的是( )A. 活度等于1的状态必为标准态B. 活度等于1的状态与标准态的化学势相等C. 标准态的活度并不一定等于1D. 活度与标准态的选择无关13.下列关于亨利系数讨论中,不正确的是( )A. 其值因溶液组成表示方法不同而异B. 其值与温度有关C. 其值与溶剂的性质均有关D. 其值与溶质的活度有关14..对A,B二组分理想液态混合物系统中,下列说法不正确的是()A. A,B 在全部组成范围内均服从拉乌尔定律B. 该系统的沸点-组成图,液相线为直线C. 任一组分的化学势表示为D. 对任一组分均有15.在讨论稀溶液的蒸气压下降的规律时,溶质必须是()A. 挥发性溶质B.气体物质C.非挥发性溶质D. 电解质16.溶剂服从拉乌尔定律同时溶质服从亨利定律的二元溶液()A.理想稀溶液B.理想溶液C.实际溶液D.共轭溶液17..由水(1)和甲醇(2)组成的二元溶液,下列各式不是甲醇在此溶液中化学势的是()A B C18.下列关于稀溶液依数性的讨论中,不正确的是( )A. 在依数性中最灵敏的性质是渗透压B. 在依数性公式的推导中,都应用了拉乌尔定律C. 依数性都可以用来测知溶剂的不纯性D. 在依数性公式的热力学推倒中没有任何近似假定,是十分严格的19.对于二元溶液,其组分的平衡分压与组成的关系为杜亥姆- 马居尔公式:,其适用的条件为( )A. 温度和总压恒定B. 温度恒定,气相为理想气体C. 恒温D. 温度和总压恒定,并且气相为理想气体20.在298.15K时,纯丙酮的蒸气压为43kP a,在氯仿的摩尔分数为0.30的丙酮- 氯仿二元溶液上丙酮的蒸气压为26.77k P a,则此溶液( )A.为理想溶液B.对丙酮为正偏差C.对丙酮为负偏差D.以上都不对21. 1 mol A与n mol B组成的溶液,体积为0.65dm3,当x B = 0.8时,A的偏摩尔体积V A = 0.090dm3·mol-1,那么B的偏摩尔V B 为:(A) 0.140 dm3·mol-1;(B) 0.072 dm3·mol-1;(C) 0.028 dm3·mol-1;(D) 0.010 dm3·mol-1。
第四章 多组分 (自测题1)1. 在恒温、恒压下,往无限大量的A 、B 混合物中加入1mol 纯组分B ,充分混合后,系统熵的增量等于( ):(A ) *m, B S (B ),m BS(C ) 两者都不是2. C 10o-、101.325kPa 的过冷水的化学势l μ( )同温同压下冰的化学势s μ。
(A )大于 (B )小于 (C )等于 (D )不能确定3. 在恒温、恒压下,理想液态混合物混合过程的G mix ∆( ) (A )< 0 (B )> 0 (C )= 0 (D )不能确定4. 下列几个偏导数式中,何者为化学势( )(A )c ,,B ()B S V n n U n '≠∂∂ (B ) c B,,B ()T p n n A n '≠∂∂(C ) c B ,,B ()S P n n Hn '≠∂∂ (D) B,,B ()ET P n n G n '≠∂∂5. C 30o 时,组成为A 0.40x =的A 、B 液态混合物中组分A 的蒸气压*A A 0.42p p =(其中*A p 为C 30o 时纯组分A 的饱和蒸气压)。
此液态混合物中组分A 的活度系数=γ( )(A )0.95 (B )1.24 (C )1.05 (D )0.576. T 、p 及组成一定的某二元液态混合物,系统的Gibbs 函数为( )(A )**A m,A B m,B n G n G + (B )A A B B n n μμ+ (C )不能确定7. 物理化学中有关标准态的理解正确的是( )(A ) 标准态就是273.15K,101.325kPa 下的状态; (B ) 标准态就是不能实现的假想状态;(C ) 标准态就是活度等于1的状态; (D ) 标准态就是人为规定的某些特定状态。
8. 将蔗糖溶于纯水中形成稀溶液,与纯水比较,其沸点( )(A )降低 (B )升高 (C )不能确定9. 理想液态混合物中组分B 的化学势表达式,*BB B ln RT x μμ=+其中*B μ对应的状态为( B )(A )纯气态B 组分 (B )纯液态B 组分 (C )标准压力下的纯液态B 组分10. 恒T 、p 下A 、B 组成的二组分系统,若A 的偏摩尔熵增大,则B 的偏摩尔熵( )(A )增加 (B )减小 (C )可能增大,也可能减小第四章 多组分 (自测题2)11. 在恒温、恒压下,往有限量的A 、B 混合物中加入1mol 纯组分B ,充分混合后,系统Gibbs 的增量等于( ):(A ) *m, B G (B ),m BG(C ) 两者都不是12. 在过饱和溶液中,溶质的化学势( )同温同压下纯溶质的化学势。
第4章 多组分系统自测题1. 在一定外压下,易挥发溶剂A 中加入不挥发溶质B ,形成稀溶液。
在此稀溶液浓度范围内A 与B 可形成固溶体。
此稀溶液的凝固点随着b B 的增加而( D ),它的沸点随着b B 的增加而( A ). A 升高;B 降低;C 不发生变化;D 无法判断。
2. 在某一定温度T 下,由纯液态的A 与B 形成理想液态混合物。
已知**A Bp p <,当气-液两相达到平衡时,气相组成y B总是( A )液相组成x B 。
A >;B <;C =;D 正比于。
3. 在T =300K , p =102.0 kPa 的外压下,质量摩尔浓度b =0.002 mol ⋅kg -1的蔗糖水溶液的渗透压为1∏。
b =0⋅002 mol ⋅kg -1 KCl 水溶液的渗透压为2∏,则必存在2∏( A )1∏的关系。
A >;B <;C =;D 无法判断。
4. 在101.325 kPa 的大气压力下,将蔗糖在水中的稀溶液缓慢地降温,首先析出的为纯冰。
相对于纯水而言,加人蔗糖将会出现:蒸气压( B );沸点( A );凝固点( B )。
A 升高;B 降低;C 不变;D 无一定变化规律。
5. 在恒温、恒压下,理想液态混合物混合过程的①mix m V ∆( B );②mix m H ∆( B );③ mix m S ∆( A );④mix m G ∆( C );⑤mix m U ∆( B );⑥mix m A ∆( C )。
A >0;B =0:C <0;D 不能确定。
6. 在T ,p 及组成一定的真实溶液中,溶质的化学势可表示为:B μ=B μ+B ln RT a ,采用不同的标准态(x B =1, b B =b ,c B =c ,…)时,上式中的B μ ( A );a B ( A ), B μ( B )。
(a)变;(b)不变;(c)变大;(d)变小。
7. 在一定压力下,在A ,B 二组分溶液的温度-组成图的最高(或最低)恒沸点处,气-液两相组成的关系为:气相摩尔分数y B ( C )液相摩尔分数x B 。
第四章和第五章习题及答案第四章多组分系统热力学选择题1. 在373.15K和101325Pa•下,水的化学势与水蒸气化学位的关系为A(A) μ(水)=μ(汽) (B) μ(水)<μ(汽)(C) μ(水)>μ(汽) (D) 无法确定2.下列哪种现象不属于稀溶液的依数性 D(A) 凝固点降低(B)沸点升高 (C) 渗透压(D)蒸气压升高3.98K时,A、B两种气体在水中的亨利常数分别为k1和k2,且k1>k2,则当P1=P2时,A、B在水中的溶解量c1和 c2的关系为 B(A) C1> C2 (B) C1< C2 (C) C1= C2 (D) 不能确定4.将非挥发性溶质溶于溶剂中形成稀溶液时,将引起 A(A) 沸点升高 (B) 熔点升高 (C) 蒸气压升高 (D) 都不对5. 定义偏摩尔量时规定的条件是 D(A) 等温等压 (B) 等熵等压(C) 等温, 溶液浓度不变 (D) 等温等压, 溶液浓度不变6. 关于偏摩尔量, 下面的说法中正确的是 B(A) 偏摩尔量的绝对值都可求算(B) 系统的容量性质才有偏摩尔量(C) 同一系统的各个偏摩尔量之间彼此无关(D) 没有热力学过程就没有偏摩尔量7. 影响沸点升高常数和凝固点降低常数值的主要因素是A(A) 溶剂本性 (B) 温度和压力(C)溶质本性 (D) 温度和溶剂本性8. 已知373K时液体A的饱和蒸气压为133.24kPa,液体B的饱和蒸气压为66.62kPa。
设A和B形成理想溶液,当溶液中A的物质的量分数为0.5时,在气相中A的物质的量分数为:C(A)1 (B) 1/2 (C) 2/3 (D) 1/3因为y A=p A/p A+p B=133.24/(133.24+66.62)=2/39. 两只各装有1kg水的烧杯,一只溶有0.01mol蔗糖,另一只溶有0.01molNaCl,按同样速度降温冷却,则: A(A) 溶有蔗糖的杯子先结冰 (B) 两杯同时结冰(C) 溶有NaCl 的杯子先结冰(D) 视外压而定10.下列各式叫化学势的是:BA. )B C (,,B c ≠⎪⎪⎭⎫ ⎝⎛∂∂n V S n GB. )B C (,,B c ≠⎪⎪⎭⎫ ⎝⎛∂∂n p T n G C. )B C (≠⎪⎭⎫ ⎝⎛∂∂V T G D. (C B)S U T ≠∂⎛⎫ ⎪∂⎝⎭ 11.冬季建筑施工中,为了保证施工质量,常在浇注混凝土时加入盐类,其主要作用是 CA.增加混凝土强度B.防止建筑物被腐蚀C.降低混凝土的固化温度D.吸收混凝土中的水分判断题1.理想混合气体中任意组分B 的化学势表达式为:μB =μB (g,T) +RTln(p B /p )。
物化习题第四章多组分系统热力学一判断题1、在101.3Kpa下,往纯水中加入少量NaCl,与纯水比较,此稀溶液沸点升高。
()2、偏摩尔量集合公式Z=∑nBzB,m适用条件是恒温过程。
()恒温恒压过程3、Henry系数Kx,B只与溶剂溶质性质有关,而与温度无关。
()温度不同,亨利系数不同。
温度升高,系数升高。
4、沸点升高系数Kb的数值与溶剂、溶质的性质有关,且与温度有关。
()Kb的量仅与溶剂的性质有关5.、若A分子和B分子之间的相互作用力,与A,B各自处于纯态时分子之间的相处作用力相同,混合后,则有⊿Hmin=0.( )6、标准就态是认为规定的某些特定状态。
()7、理想溶液中,各种微粒间的相互作用力可忽略不计。
()处于凝聚态的分子,其分子间的距离很小,分子间的相互作用力和分子的体积均不能忽略。
8、一切纯物质的凝固点都随外压的增大而上升。
()9、稀溶液的非典一定比纯溶剂的沸点高。
()在同一外压条件下10、在相同温度和压力下,相同质量摩尔浓度的葡萄糖和食盐水的渗透压不相同。
()Ⅱ=CbRT,溶液的渗透压的大小只由溶液中的溶质的浓度决定,而与溶质的本性无关。
11、摩尔分数和质量摩尔浓度与温度无关,而物质的量浓度与温度有关()12、在相平衡中,若各相中均有组分B,则组分B在个相中的化学势一定相等。
()系统处于相平衡,由于系统任一组分B在其存在的每个相中的化学势相等。
13、溶剂中融入挥发性溶质,肯定会引起溶液的蒸汽压升高。
()14、二组分理想液态混合物的总蒸汽压大于任一组分的蒸汽压。
()处于中间态。
15、只有广度性质才有偏摩尔量。
( )16、凡是自由能降低的过程一定都是自发过程。
()17、拉乌尔定律和亨利定律既适合于理想溶液,也适合于稀溶液。
()18、偏摩尔量因为与浓度有关,因此它不是一个强度性质。
()19、某一体系达平衡时,熵最大,自由能最小。
()20、在一个多组分溶液中,只有溶质才有偏摩尔量。
()21、封闭系统中,由状态1经定温、定压过程变化到状态2,非体积功W′>△G和△G﹤0,则此过程一定能发生。
第4章 多组分系统自测题
1. 在一定外压下,易挥发溶剂A 中加入不挥发溶质B ,形成稀溶液。
在此稀溶液浓度范围内A 与B 可形成固溶体。
此稀溶液的凝固点随着b B 的增加而( ),它的沸点随着b B 的增加而( ).
A 升高;
B 降低;
C 不发生变化;
D 无法判断。
2. 在某一定温度T 下,由纯液态的A 与B 形成理想液态混合物。
已知**
A B p p <,当气-液两相达到平衡时,气相组成y B总是( )液相组成x B 。
A >;
B <;
C =;
D 正比于。
3. 在T =300K , p =102.0 kPa 的外压下,质量摩尔浓度b =0.002 mol ⋅kg -1的蔗糖水溶液的渗透压为1∏。
b =0⋅002 mol ⋅kg -1 KCl 水溶液的渗透压为2∏,则必存在2∏( )1∏的关系。
A >;
B <;
C =;
D 无法判断。
4. 在101.325 kPa 的大气压力下,将蔗糖在水中的稀溶液缓慢地降温,首先析出的为纯冰。
相对于纯水而言,加人蔗糖将会出现:蒸气压( );沸点( );凝固点( )。
A 升高;
B 降低;
C 不变;
D 无一定变化规律。
5. 在恒温、恒压下,理想液态混合物混合过程的①mix m V ∆( );②m ix m H ∆( );③ m ix m S ∆( );④mix m G ∆( );⑤m ix m U ∆( );⑥m ix m A ∆( )。
A >0;
B =0:
C <0;
D 不能确定。
6. 在T ,p 及组成一定的真实溶液中,溶质的化学势可表示为:B μ=B μ
+B ln RT a ,采用不同的标准态(x B =1, b B =b ,c B =c ,…)时,上式中的B μ ( );a B ( ), B μ( )。
(a)变;(b)不变;(c)变大;(d)变小。
7. 在一定压力下,在A ,B 二组分溶液的温度-组成图的最高(或最低)恒沸点处,气-液两相组成的关系为:气相摩尔分数y B ( )液相摩尔分数x B 。
A >;
B <;
C =;
D >>(远远大于)。
8. 在一定压力下,若在A ,B 两组分系统的温度-组成图(即T -x B 图)中出现最高恒沸点,则其蒸气总压对拉乌尔定律必产生( )偏差。
A 一般正;
B 一般负;
C 最大正;
D 最大负。
9. 在温度为T 时,纯液体A 的饱和蒸气压为*A p ,化学位为*A μ,在p 下凝固点为*
f T ,当在A 中溶入少量与A 不形成固溶液的溶质B 而形成稀溶液时,述三物理量分别为A p ,A μ,f T ,则( ) A *A p <A p ,*A μ<A μ,*f T <f T ; B *A p >A p ,*A μ<A μ,*
f T <f T ; C *A p >A p ,*A μ<A μ,*f T >f T ; D *A p >A p ,*A μ>A μ,*f T >f T 。
10. 集合公式∑==
k i i
i n z z 1的成立须满足什么条件?
A 恒容恒熵
B 恒温恒容
C 恒熵恒压
D 恒温恒压
E 不需要任何条件
11. 糖可以顺利溶解在水中,这说明固体糖的化学势与糖水中糖的化学势比较,高低如何?
A 高
B 低
C 相等
D 不可比较
12. 重结晶制取纯盐的过程中,析出的NaCl 固体的化学势与母液中NaCl 的化学势比较,高低如何?
A 高
B 低
C 相等
D 不可比较
13. 过饱和溶液中溶质的化学势与纯溶质的化学势比较,高低如何?
A高 B 低 C 相等 D 不可比较
14. 过饱和溶液中溶剂的化学与纯溶剂的化学势比较,高低如何?
A高 B 低 C 相等 D 不可比较
15. 溶液中组分A的化学势与纯组分B的化学势比较,高低如何?
A高 B 低 C 相等 D 不可比较
16. 反应3NO2(g)+H2O(l)===2HNO3(l)+NO(g)在标准状态下进行,体系的压力应为多少?
A 1.01⨯102kPa
B 2.02⨯102kPa
C 3.03⨯102kPa
D 4.04⨯102kPa
17. 混合理想气体中组分i的标准态与混合非理想气体中组分i的标准态相比较,其关系如何?
A相同 B 不同 C 不一定相同 D 无关系
18. 盐碱地的农作物长势不良,甚至枯萎,其主要原因是什么?
A天气太热 B 很少下雨 C 肥料不足 D 水分倒流
19. 为马拉松运动员沿途准备的饮料应该是哪一种?
A白开水 B 兴奋剂 C 含适量维生素的等渗饮料
20. 下述各方法中,哪一种对于消灭蚂蝗比较有效?
A用手拍 B 用刀切成几段 C 扔到岩边晾晒 D 扔到岸上向其身体撒盐
21. 海水不能直接饮用的主要原因是什么?
A不卫生 B 含致癌物 C 有苦味 D 含盐最高
22. 沸点升高,说明在溶剂中加入非挥发性溶质后,该溶剂的化学势比未加溶质前如何变化?
A升高 B 降低 C 相等 D 不一定
23. 上题所述过程中,溶质的化学势如何变化?
A升高 B 降低 C 相等 D 不一定
24. 25℃时,0.01m糖水的渗透压为π1,0.01m食盐水的渗透压为π2,则π1和π2有何关系?
Aπ1>π2 B π1<π2 C π1=π2 D 无确定关系
25. 恒压下,将分子量为50的二元电解质5g溶于250g水中,测得凝固点为-0.744℃。
问该
电解质在水中的解离度为多少?(水的冰点降低常数K f=1.86)
A100% B 76% C 27% D 0
26. 下述说法中哪一个正确?在未平衡的多相体系中,组分i若在各相中的摩尔分数都相等,则
A其在各相中的化学势相等 B 其在各相中的标准化学势相等
C 其在各相中的活度相等
D 都不一定
27. 当某溶质溶于某溶剂中形成浓度一定的溶液时,若采用不同的浓标,则下列各廉洁中哪一个正确?
A溶质的浓度数据相同 B 溶质的活度数据相同
C 溶质的活度系数相同
D 溶质的化学势数据相同
E 溶质的各标准态化学势数据相同
28. 在可逆途径中,体系的化学势将如何变化?
A升高 B 降低 C 不变 D 不一定
答案:1.D,A; 2.A; 3.A; 4.B,A,B; 5.B,B,A,C,B,C; 6.A,A,B; 7.C; 8.D; 9.D; 10.D; 11.A; 12.C;
13.A; 14.B; 15.D; 16.B; 17.A; 18.D; 19.C; 20.D; 21.D; 22.B; 23.B; 24.B; 25.D; 26.D; 27.D; 28.D。