第2章 配合物的立体化学
- 格式:ppt
- 大小:4.16 MB
- 文档页数:42
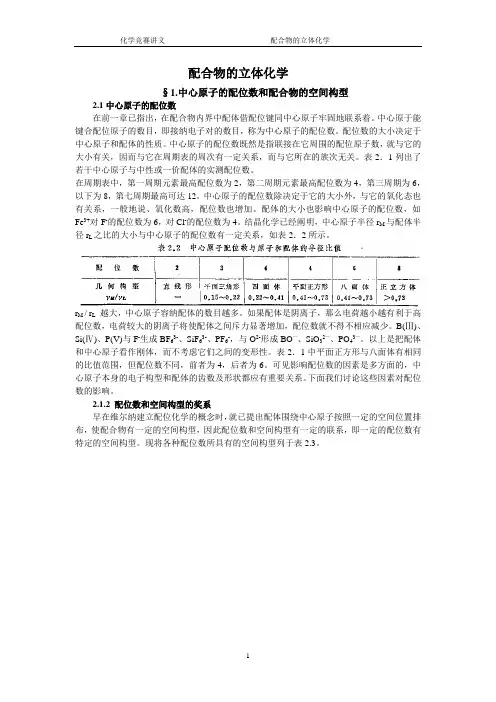
配合物的立体化学§1.中心原子的配位数和配合物的空间构型2.1中心原子的配位数在前一章已指出,在配合物内界中配体借配位键同中心原子牢固地联系着。
中心原于能键合配位原子的数目,即接纳电子对的数目,称为中心原子的配位数。
配位数的大小决定于中心原子和配体的性质。
中心原子的配位数既然是指联接在它周围的配位原子数,就与它的大小有关,因而与它在周期表的周次有一定关系,而与它所在的族次无关。
表2.1列出了若干中心原子与中性或一价配体的实测配位数。
在周期表中,第一周期元素最高配位数为2,第二周期元素最高配位数为4,第三周期为6,以下为8,第七周期最高可达12。
中心原子的配位数除决定于它的大小外,与它的氧化态也有关系,一般地说、氧化数高,配位数也增加。
配体的大小也影响中心原子的配位数,如Fe3+对F-的配位数为6,对Cl-的配位数为4。
结晶化学已经阐明,中心原子半径r M与配体半径r L之比的大小与中心原子的配位数有一定关系,如表2.2所示。
r M / r L越大,中心原子容纳配体的数目越多。
如果配体是阴离子,那么电荷越小越有利于高配位数,电荷较大的阴离子将使配体之间斥力显著增加,配位数就不得不相应减少。
B(Ⅲ)、Si(Ⅳ)、P(V)与F-生成BF63-、SiF63-、PF6-,与O2-形成BO—、SiO32—、PO43—。
以上是把配体和中心原子看作刚体,而不考虑它们之间的变形性。
表2.1中平面正方形与八面体有相同的比值范围,但配位数不同,前者为4,后者为6。
可见影响配位数的因素是多方面的,中心原子本身的电子构型和配体的齿数及形状都应有重要关系。
下面我们讨论这些因素对配位数的影响。
2.1.2 配位数和空间构型的奖系早在维尔纳建立配位化学的概念时,就已提出配体围绕中心原子按照一定的空间位置排布,使配合物有一定的空间构型,因此配位数和空间构型有一定的联系,即一定的配位数有特定的空间构型。
现将各种配位数所具有的空间构型列于表2.3。







第二章 配合物的立体化学(习题)1、影响中心原子配位数大小的因素2、为什么d 8的Pt 2+大部分配合物为平面正方形结构3、配位数为5的配合物,其空间构型主要有哪几种?多齿配体往往按照其结构要求稳定配合物的某一种构型。
配体((CH 3)2NCH 2CH 2)3N (简写为Me 6tren )主要形成什么构型的配合物?若将Me 6tren 换成N (CH 2CH 2CH 2NR 2)3,将会形成什么构型配合物?为什么?4、配位数为8的配合物,其常见空间构型有哪几种?对于配位数为8或8以上的配合物一般要满足哪些条件?5、写出八面体配合物分子中的所有对称操作及相应的对称元素。
6、指出下列配合物哪些互为异构体,并写出各类异构体的名称及特点 (1) [Co (NH 3)6][Co (NO 2)6] (2)[Co (NH 3)3 (NO 2)3] (3) [Pt (NH 3)3 (ONO)2]Cl (4)[PtCl 4(en)]·2py(5) [Pt(NH 3)3(NO 3)]Cl (6) [PtCl 2(en) (py)2]Cl 2(7) [Pt(NH 3)3Cl]NO 3 (8)[Co(NH 3)4 (NO 2)2] [Co(NH 3)2(NO 2)4] (9) (10)CoO O H HCoCl Cl (H 3N)3(NH 3)32+CoO O H HCoCl 2(H 3N)2(NH 3)42+7、给下列配合物命名(1) (2) (3) (4)NH 3BrPt H 3NNO 233O 22Br 2注: 表示en8、写出下列配合物的分子结构(1)经-三氯·三氨合钴(Ⅲ) (2)面-三硝基·三水合钴(Ⅲ)9、Ni(Ⅱ)的配合物[NiCl 2(PPh 3)2]是顺磁性,相应Pd(Ⅱ)的配合物为反磁性,试预测这两种配合物的几何构型和异构体数目10、写出配合物Ma 2b 2cd 所有异构体(包括对映异构体)11、写出[Cu(AB)2(H 2O)2]所有异构体(包括对映异构体),AB 为非对称双齿配体12、说明下列配合物中各符号的意义(1)(+)589[Co(en)3]Cl3(2)Λ(+)589[Co{(+)pn}2{(-)pn}δδλ]Cl313、组合Co3+, NH3, NO2 - 和K+可得出七种配合物,其中一种是[Co(NH3)6](NO2)3,试写出(1)其它六种的化学式,(2)每一个化合物的名称,(3)配合物的空间结构。