高二化学 3.2.1 乙醛的结构和性质
- 格式:ppt
- 大小:13.97 MB
- 文档页数:34

《乙醛》讲义一、乙醛的基本信息乙醛,化学式为 C₂H₄O,结构简式为 CH₃CHO,是一种醛类有机化合物。
它在常温常压下是一种无色、易挥发、具有刺激性气味的液体。
乙醛能与水、乙醇、乙醚等多种有机溶剂混溶。
二、乙醛的物理性质1、外观与气味乙醛为无色透明液体,具有强烈的刺激性气味。
这股气味类似于水果熟透或者发酵的味道。
2、沸点和熔点乙醛的沸点约为 208℃,熔点约为-1235℃。
由于其沸点较低,所以在常温下容易挥发。
3、密度相对密度为 07834(水= 1),这意味着它比水的密度小。
4、溶解性乙醛能与水、乙醇、乙醚等有机溶剂以任意比例互溶。
三、乙醛的化学性质1、加成反应乙醛分子中的碳氧双键可以发生加成反应。
例如,在催化剂的作用下,乙醛可以与氢气发生加成反应,生成乙醇。
CH₃CHO + H₂ → CH₃CH₂OH2、氧化反应(1)乙醛可以被氧气氧化为乙酸。
2CH₃CHO + O₂ → 2CH₃COOH(2)乙醛也能被一些弱氧化剂氧化,比如银氨溶液和新制的氢氧化铜悬浊液。
与银氨溶液反应,会产生银镜现象,化学方程式为:CH₃CHO + 2Ag(NH₃)₂OH → CH₃COONH₄+2Ag↓ + 3NH₃+ H₂O与新制的氢氧化铜悬浊液反应,会产生砖红色沉淀,化学方程式为:CH₃CHO + 2Cu(OH)₂+NaOH → CH₃COONa + Cu₂O↓ +3H₂O3、缩合反应乙醛在一定条件下可以发生自身缩合反应,生成β羟基丁醛。
2CH₃CHO → CH₃CH(OH)CH₂CHO四、乙醛的制备方法1、乙醇氧化法乙醇在催化剂(如铜或银)的作用下,加热可以被氧化为乙醛。
这是工业上制备乙醛的常用方法之一。
2CH₃CH₂OH + O₂ → 2CH₃CHO + 2H₂O2、乙烯氧化法乙烯在催化剂(如钯盐)和氧气的作用下,可以被氧化为乙醛。
CH₂=CH₂+ 1/2 O₂ → CH₃CHO五、乙醛的用途1、化工原料乙醛是合成乙酸、乙酸酐、季戊四醇、丁醇、三氯乙醛等多种有机化工产品的重要原料。

乙醛的结构与化学性质乙醛(化学式:CH3CHO)是一种有机化合物,也被称为乙酰醛。
它是最简单的醛之一,由一个甲基基团和一个氢氧基团以羰基(碳氧双键)连接而成。
乙醛是一种无色有刺激性气味的液体,在自然界中可以由一些水果、咖啡和面包中发现。
乙醛的分子式为C2H4O,相对分子质量为44.05 g/mol。
它可以溶于水,与许多有机化合物发生反应,如醇、胺、酸和芳香化合物。
乙醛是一种极性分子,由于氧原子的电负性较高,使氧原子部分带负电荷,而碳原子部分带正电荷。
这导致乙醛具有一些独特的化学性质。
首先,乙醛是一种容易挥发的液体,具有强烈的刺激性气味。
这也是为什么我们能够在一些水果和其他食物中闻到它的原因。
其次,乙醛是一种弱酸,可以与一些强碱(如氢氧化钠)反应,生成对应的乙酸盐。
这种反应通常被称为酸碱中和反应。
另外,乙醛与一些氧化剂反应,可以发生氧化反应,生成乙酸。
这种反应常常被用于鉴定醛类化合物的存在。
乙醛还可以发生加成反应,与一些亲电试剂反应生成加成产物。
例如,乙醛可以和氢氰酸反应生成氰羟甲酸。
此外,乙醛还可以通过还原反应转化为乙醇。
在还原反应中,氢气和催化剂(如铂催化剂)可以加到乙醛的碳氧双键上,使其还原为醇。
这种还原反应在工业上经常用于生产乙醇。
乙醛还有一些其他的化学性质,例如可以通过羟甲基化反应生成甲醇,可以通过烷基化反应生成烷基醇,还可以通过选择性氧化反应生成乙酸,等等。
总之,乙醛是一种重要的有机化合物,具有独特的结构和化学性质。
它在工业上广泛应用于生产醇、酸、酯等有机化合物。
此外,乙醛在生物体内也扮演着重要的角色,参与许多生物化学反应。
对乙醛的研究不仅有助于深入理解有机化学的基本原理,还对工业和生物科学具有重要的应用价值。



乙醛的化学式和结构式-概述说明以及解释1.引言1.1 概述乙醛是一种重要的有机化合物,它在化工、医药、食品等领域都有着广泛的应用。
乙醛具有独特的化学性质和结构特征,其化学式为CH3CHO,结构式为CH3-CHO。
乙醛在化学反应中扮演着重要角色,其重要性不可忽视。
本文将深入探讨乙醛的定义、性质、化学式和结构式,以及乙醛在化学领域的应用和未来发展方向。
通过对乙醛的全面了解,可以更好地认识和利用这种重要的有机化合物。
文章结构部分的内容应包括对整篇文章的组织和安排进行说明。
在这篇关于乙醛的化学式和结构式的文章中,我们将按照以下结构展开讨论:1. 引言部分:1.1 概述:简要介绍乙醛的基本信息和重要性。
1.2 文章结构:介绍本文的组织结构和讨论内容。
1.3 目的:明确本文撰写的目的和意义。
2. 正文部分:2.1 乙醛的定义和性质:详细介绍乙醛的定义、性质和特点。
2.2 乙醛的化学式:分析乙醛的化学式及其组成元素。
2.3 乙醛的结构式:探讨乙醛的分子结构和构造特点。
3. 结论部分:3.1 总结乙醛的重要性:概括乙醛在化学领域的重要作用。
3.2 乙醛在化学领域的应用:列举乙醛在实际应用中的具体场景和用途。
3.3 展望乙醛的未来发展:展望乙醛在未来的应用前景和发展趋势。
通过以上结构安排,我们将全面深入地探讨乙醛的化学式和结构式,展示其重要性和潜在应用价值,为读者提供详尽的信息和知识内容。
1.3 目的本文的目的在于深入探讨乙醛这一化合物的化学式和结构式,并分析其定义、性质以及在化学领域的应用。
通过对乙醛的研究,我们可以更加全面地了解这一化合物的特点和重要性,为化学领域的研究提供更为深入的参考和理解。
同时,通过展望乙醛的未来发展,可以为相关研究的方向和发展趋势提供一定的参考和借鉴,促进乙醛在化学领域的更广泛应用和推广。
通过本文的研究,旨在为读者提供关于乙醛的详尽信息,增强对该化合物的理解和认识。
2.正文2.1 乙醛的定义和性质乙醛,化学式为CH3CHO,又称乙醛醛,是一种有机化合物,属于醛类化合物。

第二节醛【教学目标】1.使学生掌握乙醛的结构式,主要性质和用途2.使学生掌握醛基和醛类的概念【教学重点】乙醛的性质和用途【教学过程】一、乙醛1.乙醛的分子组成与结构乙醛的分子式是OHC42,结构式是,简写为CHOCH3。
注意对乙醛的结构简式,醛基要写为—CHO而不能写成—COH。
2.乙醛的物理性质乙醛是无色、具有刺激性气味的液体,密度小于水,沸点为C 8.20。
乙醛易挥发,易燃烧,能与水、乙醇、氯仿等互溶。
注意因为乙醛易挥发,易燃烧,故在使用纯净的乙醛或高浓度的乙醛溶液时要注意防火。
3.乙醛的化学性质从结构上乙醛可以看成是甲基与醛基()相连而构成的化合物。
由于醛基比较活泼,乙醛的化学性质主要由醛基决定。
例如,乙醛的加成反应和氧化反应,都发生在醛基上。
(1)乙醛的加成反应乙醛分子中的碳氧双键能够发生加成反应。
例如,使乙醛蒸气和氢气的混合气体通过热的镍催化剂,乙醛与氢气发生加成反应:说明:①在有机化学反应中,常把有机物分子中加入氢原子或失去氧原子的反应叫做还原反应。
乙醛与氢气的加成反应就属于还原反应。
②从乙醛与氢气的加成反应也属于还原反应的实例可知,还原反应的概念的外延应当扩大了。
注:此处可借助flash 帮助学生理解乙醛的加成反应(2)乙醛的氧化反应在有机化学反应中,通常把有机物分子中加入氧原子或失去氢原子的反应叫氧化反应。
乙醛易被氧化,如在一定温度和催化剂存在的条件下,乙醛能被空气中 的氧气氧化成乙酸:注意 ①工业上就是利用这个反应制取乙酸。
②在点燃的条件下,乙醛能在空气或氧气中燃烧。
乙醛完全燃烧的化学方程式为:O H CO O CHO CH 22234452+−−→−+点燃乙醛不仅能被2O 氧化,还能被弱氧化剂氧化。
【实验3-5】在洁净的试管里加入1 mL 2%的3AgNO 溶液,然后一边摇动试管,一边逐滴滴入2%的稀氨水,至最初产生的沉淀恰好溶解为止(此时得到的溶液叫做银氨溶液)。
再滴入3滴乙醛,振荡后把试管放在热水中温热。
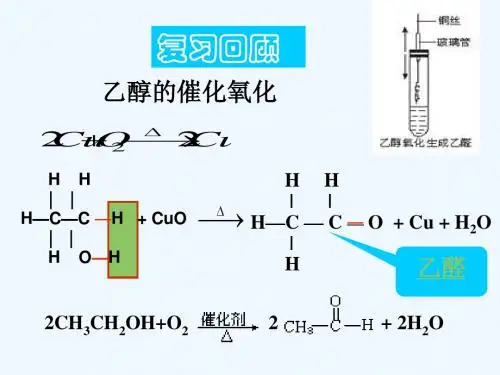

高二化学乙醛、醛类【本讲主要内容】乙醛、醛类乙醛的结构、物理性质、化学性质、制法和用途;醛类的结构、通性和检验方法;对照醛的内容简要了解其同分异构体酮的知识。
【知识掌握】 【知识点精析】 一. 乙醛1. 分子式结构式结构简式官能团 C 2H 4OC H HHCHOH 3C C H O或CH 3CHO醛基2. 物理性质 乙醛是无色、具有刺激性气味的液体,密度比水小,沸点很低(20.8℃,比乙醇低得多),易挥发,易燃烧,能跟水、乙醇、氯仿等互溶。
3. 化学性质 (1)加成反应NiOH CH 3-C+H 2CH 3CH 2OH注:① 该反应实质为加氢还原反应。
有机化学反应中,通常把有机物分子中加入氢原子或失去氧原子的反应叫做还原反应,而加氧去氢的反应称为氧化反应。
如乙醇的催化氧化。
② 醛基与H 2的加成是在分子中引入—OH 的一种方法。
但工业上并不用此法合成乙醇。
③ C =O 键和C =C 键不同,只能与H 2加成,但不能与溴水加成。
(2)氧化反应① 剧烈氧化——燃烧2CH 3CHO+5O 2点燃4CO 2+4H 2O② 催化氧化2CH 3CHO+O 2催化剂2CH 3COOH③ 被弱氧化剂氧化 a. 银镜反应 Ag ++NH 3·H 2O =AgOH ↓+NH 4+AgOH+2NH 3·H 2O =[23)(NH Ag ]++OH -+2H 2O CH 3CHO+223)(NH Ag ]++2OH-水浴2Ag ↓+CH 3COO -+NH 4++3NH 3+H 2O这个反应叫银镜反应。
银镜反应常被用于检验醛基的存在。
也常用于测定有机物中醛基的数目。
b. 与新制2)(OH Cu 悬浊液反应CuSO 4+2NaOH =2)(OH Cu ↓+Na 2SO 4 22)(OH Cu +CH 3CHOCu 2O ↓+CH 3COOH+2H 2O乙醛与新制2)(OH Cu 悬浊液的反应也可用于检验醛基的存在。

时遁市安宁阳光实验学校乙醛的结构和性质1.下列物质中既能使溴水和酸性KMnO4溶液褪色,又能发生银镜反应的是( ) A.CH3—CH=CH2 B.CH2=CH—CH2OHC.CH3CH2CH2OH D.CH2=CH—CHO【答案】D【解析】能发生银镜反应,则分子中必定含醛基(—CHO)。
2.关于丙烯醛(CH2=CH﹣CHO)的下列叙述中,正确的是()A.在丙烯醛分子中,仅含有一种官能团B.丙烯醛能使溴水褪色,但不能使酸性高锰酸钾溶液褪色C .丙烯醛能发生加聚反应,生成高聚物D.等物质的量的丙烯醛和丙醛完全燃烧,消耗等物质的量的O2【答案】C【解析】A.该有机物中含有醛基和碳碳双键两种官能团,故A错误;B.碳碳双键能与溴发生加成反应、能被酸性高锰酸钾溶液氧化还,醛基能被溴、酸性高锰酸钾溶液氧化,所以丙烯醛能使溴水、酸性高锰酸钾溶液褪色,故B错误;C.丙烯醛碳碳双键能发生加聚反应生成高分子化合物,生成高聚物,故C正确;D.1molCH2=CH﹣CHO消耗氧气为1mol×(3+﹣)=3.5mol,1molC3H6O消耗氧气为1mol×(3+)=4mol,则等物质的量的丙烯醛和丙醛完全燃烧,消耗氧气的物质的量不等,故D错误;答案为C。
3.甲醛、乙酸和葡萄糖组成的混合液中,碳元素的质量分数是( )A.27% B.52% C.40% D.无法计算【答案】C【解析】甲醛(CH2O)、乙酸(C2H4O2)、葡萄糖(C6H12O6)的最简式均为CH2O,故混合物中C、H、O元素质量之比为12:2:16=6:1:8,则混合物中碳元素质量分数为×100%=40%,故选C。
4.欲除漆包铜线表面的油漆,可将铜线放在酒精灯火焰上灼烧,再将其放入某种试剂中即可除净,该试剂最好是()A.醋酸 B.乙醇 C.硝酸 D.FeCl3溶液【答案】B【解析】将铜线放在酒精灯火焰上灼烧后,使漆熔化,油漆属于油脂类,放进乙醇中,乙醇可作为有机溶剂,将油漆溶解而除去,醋酸、硝酸、氯化铁溶液均不能将油漆溶解;故选B。


乙醛知识点总结高中
一、乙醛的物理性质:
1. 外观:乙醛是一种具有刺激性气味的无色液体。
2. 沸点和结构:乙醛的沸点为21.1℃,这是由于乙醛分子内部包含了极性键和氢键,使得其分子间的相互作用特别强烈。
二、乙醛的化学性质:
1. 氧化还原反应:乙醛能够发生氧化还原反应,在氢气氛围中,乙醛能被还原为乙醇;而在氧气氛围中,乙醛则能够被氧氧化为乙酸。
2. 加成反应:乙醛具有α,β-不饱和醛的特性,因此可以发生加成反应。
3. 羟基化反应:乙醛也能够发生羟基化反应,使得其产生羟基化合物。
4. 缩合反应:乙醛能够发生缩合反应,生成醛缩合物。
三、乙醛的制备方法:
1. 从酒精氧化:乙醛可以通过酒精氧化制备,这是一种比较常见的制备方法。
2. 从乙烷氧化:乙醛也可以通过对乙烷的氧化得到。
3. 从醋酸分解:乙醛还可以通过醋酸在高温下分解得到。
四、乙醛的用途:
1. 工业上:乙醛在工业生产中常被用作有机合成原料和防腐剂。
2. 医药上:乙醛在医药领域也有一定的应用,可以用于合成一些药物。
3. 实验室中:乙醛还可以作为实验室中一些有机合成的试剂。
五、乙醛的危害性:
1. 毒性:乙醛具有一定的毒性,长期接触会对人体造成损害。
2. 刺激性:乙醛有刺激性气味,长时间吸入可能对呼吸系统和眼睛造成刺激。
3. 爆炸性:乙醛是一种易燃物质,遇到明火或高温会发生爆炸。
总之,乙醛是一种重要的有机化合物,在工业生产、医药和实验室中都有着广泛的应用。
然而,由于其具有一定的毒性和危险性,需要在使用和储存时做好相应的安全措施,以减少意外损害的发生。
高中化学学习材料唐玲出品高二化学(选修)醛的结构和性质一、乙醛(1)乙醛的结构和物理性质乙醛的分子式:,结构简式:。
是一种无色、具有刺激性气味的液体,密度比水,易,能跟水、乙醇、乙醚、氯仿互溶。
(2)乙醛的化学性质①加成反应:,②氧化反应:a.银镜反应,此反应可用于检验醛基的存在。
[注意]:(1)银氨溶液配制中试剂滴加顺序和溶液的浓度和溶剂的相对用量;(2)有关化学反应的离子方程式:(3)有关现象:(4)反应条件:溶液应为_______性,须在____________中加热;(5)醛基(-CHO)生成物(Ag)有何量的关系?b.与新制的Cu(OH)2反应,此反应也可用于检验醛基的存在。
[注意]: (1)新制Cu(OH)2的配制中试剂滴加顺序,溶液的浓度和试剂相对用量;(2)反应条件:溶液应为___________性,须加热到沸腾(3)有关现象:二、醛类1、饱和一元醛的通式为,重要的醛有甲醛。
2、甲醛:分子式_______结构简式_______相当于有______个醛基常温下为态,易溶于水,俗称福尔马林,具有具有杀毒、防腐能力。
①加成反应:,②氧化反应:a.银镜反应b.与新制的Cu(OH)2反应 ____________三、醛基的氧化性和还原性的比较醛基的氧化性醛基的还原性组成变化加氢加氧结构变化—CHO→—CH2OH —CHO→—COOH反应类型醇、醛、酸相互转化关系:醇醛酸四、练习1、下列物质中,分子里的所有原子肯定不可能在同一平面上的是:( )A、乙炔B、苯甲醛C、异戊二烯D、丙烯醛(CH2=CH-CHO)2、为使区别乙醛、苯和溴苯的方法最简便,试剂最易获得,应选用的试剂是:( )A、新制C u(O H)2悬浊液B、水C、酸性KMnO4溶液D、AgNO3溶液3、某有机物的化学式为C5H10O,它能发生银镜反应和加成反应。
若将它与H2加成,所得产物结构简式可能是:( )A、(CH3)3CCH2OHB、(CH3CH2)2CHOHC、CH3(CH2)3CH2OHD、CH3CH2C(CH3)2OH4、已知柠檬醛的结构简式为:CH3-C(CH3)=CH CH2CH2C(CH3)=CH-CHO,根据已有知识判断下列说法不正确的是:( )A、可使KMnO4溶液褪色B、可与银氨溶液反应生成银镜C、可使溴水褪色D、被催化加氢的最后产物的结构简式为C10H20O5、醛类因易被氧化为羧酸,而易使酸性高锰酸钾溶液或溴水褪色,已知柠檬醛结构(见上题) 试用简便方法,检验柠檬醛分子中含碳碳双键。
高中乙醛的知识点总结一、乙醛的基本概念1. 乙醛的结构和化学式乙醛的分子式为C2H4O,结构式为CH3CHO。
它是最简单的醛类化合物,由一个乙基基团和一个醛基团组成。
2. 乙醛的性质(1)物理性质乙醛是一种无色的挥发性液体,有刺激性的气味,密度为0.8103g/cm3。
熔点为-123℃,沸点为20.2℃,在室温下易挥发,能与水混溶。
(2)化学性质乙醛具有典型的醛类化合物的化学性质,如可发生醛基的氧化、还原反应,也可与氨、羟胺等发生加成反应,形成相应的缩醛或缩醛反应。
3. 乙醛的制备(1)从乙烯氧化得到乙醛乙烯与氧气在催化剂存在下发生部分氧化反应,生成乙醛。
C2H4 + 1/2O2 → CH3CHO(2)从乙醇氧化得到乙醛乙醇在氧气存在下,经催化剂作用下发生氧化反应,生成乙醛。
CH3CH2OH + O → CH3CHO + H2O4. 乙醛的用途乙醛是一种重要的有机化工中间体,广泛用于制备醋酸、氨基甲酸甲酯、羧甲酰胺等化合物。
此外,乙醛还可作为有机合成试剂使用,用于合成多种有机物。
二、乙醛的化学性质1. 氧化反应乙醛容易受氧化剂氧气或氯氧化剂等的氧化作用,生成乙酸。
2CH3CHO + O2 → 2CH3COOH2. 还原反应乙醛具有可被还原的醛基,可以与还原剂发生反应,生成乙醇或其他还原产物。
CH3CHO + 2H → CH3CH2OH3. 加成反应乙醛与氨、羟胺等亲核试剂发生加成反应,生成对应的缩醛或缩醛产物。
CH3CHO + NH3 → CH3CH(NH2)CHO三、乙醛在生活中的应用1. 乙醛作为食品添加剂乙醛可用于食品加工中,作为食品香精、增香剂等添加剂,改善食品口感与气味。
2. 乙醛作为工业原料乙醛作为一种重要的有机合成原料,广泛用于醇类、酸类、酯类等有机化合物的制备。
3. 乙醛的其他应用乙醛还可用于医药、染料、药剂等领域,具有广泛的用途。
四、乙醛的危害性及防护措施1. 乙醛的危害性乙醛对人体具有刺激性,长期接触可对呼吸系统、皮肤等造成损害,甚至引发肺部疾病、白血病等疾病。