初三化学二氧化碳的性质
- 格式:docx
- 大小:9.28 KB
- 文档页数:2

二氧化碳的化学性质研究二氧化碳(CO2)是一种无色、无臭、无味的气体,分子式为CO2,是一种重要的化学物质。
它在大气中具有重要的作用,同时也是地球温室效应的主要因素之一。
因为CO2的化学性质独特,在热力学、物理学、化学等领域都有广泛应用。
CO2的物理性质CO2是一种稳定的、无色无味的气体,比空气重约1.5倍,密度为1.98千克/立方米。
它不易溶于水,但在低温和高压下,可以溶于其他液体。
CO2在常温下是一种易于压缩的气体,系不可燃性,但能支持燃烧。
CO2的热力学性质CO2是一种热力学上稳定的气体,在高温高压下反应性较弱,而在低温低压下则不稳定,容易与其他物质发生反应。
CO2的焓和熵的值均随着温度的升高而增加,而压力的升高则会使焓和熵的值降低。
CO2的化学性质CO2是一种不活泼的气体,它不与水反应,而是会在水中溶解,形成碳酸。
CO2也能和金属发生反应,形成金属碳酸盐。
在高温高压下,CO2非常活泼,可以干扰研究者的实验结果,因此通常需要加以控制。
CO2在生产和工业中的应用CO2在生产和工业中具有广泛的应用。
它可以被用作一种清洗剂,用来清洗机器和化学设备,也可用于消毒和杀菌。
CO2还可被用作食物加工工业中冷却、保鲜和干燥的工艺,例如用CO2进行果蔬的冷冻、奶制品、啤酒、软饮料的碳酸化、微波炉食品的热处理等。
此外,CO2还可以用于工业制冷和消防灭火中。
CO2在环境治理领域的应用CO2在环境治理领域的应用主要有两个方面。
一方面,由于CO2是温室气体,在全球气候变化的背景下,各国政府都非常关注措施。
目前,许多国家和地区都提出了减少或限制CO2排放的措施。
另一方面,CO2的化学性质使其能被用于治理土壤与水体的污染。
通过注入CO2,可改变土壤的pH值,从而减少重金属的毒性影响、提高土壤肥力、促进生态平衡等。
结语总之,二氧化碳作为一种重要的化学物质,具有独特的化学性质及广泛应用。
但是,其作为温室气体对于地球环境的影响也是不可忽视的。

初三上学期化学知识点总结第1篇二氧化碳的性质1.二氧化碳的物理性质:可溶于水,密度比空气的大。
加压降温易变为固体“干冰用途:灭火,温室里作肥料,干冰用于致冷和人工降雨,化工原料2.二氧化碳的化学性质①跟水反应:二氧化碳通入水中生成碳酸CO2+H2O=H2CO3二氧化碳通入紫色xxx试液,xxx试液变红色;加热又变为紫色②跟碱反应生成盐和水:(用澄清的石灰水鉴定CO2)二氧化碳通入澄清的石灰水CO2+Ca(OH)2=CaCO3↓+H2O现象:有白色沉淀生成(或:澄清的石灰水变浑浊)二氧化碳跟氢氧化钠反应:CO2+2NaOH=Na2CO3+H2O(无明显现象)③通常情况下,CO2不支持燃烧,也不能燃烧。
初三上学期化学知识点总结第2篇化学知识中一些复杂抽象和难以理解的知识内容比较枯燥无味,如果一味要求学生死记硬背,不仅记不住,而且忘得快。
兴趣是增强记忆力的窍门,为了提高学生兴趣,把无趣变成有趣,把无味变成有味,在教学中把这些枯燥无味的知识编成顺口溜或谱成歌曲或谐音,读起来朗朗上口,便于学生记忆。
如对H2和CO还原CuO实验操作,可概括为“气体早出晚归,酒精灯迟到早退。
前者颠倒要爆炸,后者颠倒要氧化。
”又如盐在水中溶解性可概括为:“钾、钠、铵、盐都可溶,硝酸盐见水永无踪,盐酸盐不溶银亚汞,硫酸盐不溶铅和钡”。
另外,对化学反应类型:“多变一”是化合反应,“一变多”是分解反应。
对化学方程式书写:“左边反应物,右边生成物,写好化学式,选数来配平,中间连等号初中化学,条件须注有,冒气生沉淀,箭头来表明”。
可举的例子还有很多,这样既增强记忆效果又不易忘记。
初三上学期化学知识点总结第3篇纯净物和混合物1、纯净物:由一种物质组成的,“纯净”是相对的,绝对纯净的物质是没有的,只要杂质含量低,不至于对生产和科学研究产生影响的物质就是纯净物。
2、混合物:两种或多种物质组成的,这些物质相互间没有发生化学反应,各物质都保持各自的性质。


初中化学co和co2的性质
二氧化碳是空气中常见的化合物,其分子式为CO??,常温
下是一种无色无味气体,密度比空气略大,能溶于水,并生成碳酸。
固态二氧化碳俗称干冰。
二氧化碳认为是造成温室效应的主要来源。
由于碳酸很不稳定,容易分解: H2CO3====
H2O+CO2↑ 所以2HCl + CaCO3==== CaCl2+ H2O +
CO2↑ 二氧化碳能溶于水,形成碳酸: CO2+ H2O ====
H2CO3 向澄清的石灰水加入二氧化碳,会形成白色的碳酸钙:CO2+ Ca(OH)2==== CaCO3↓ + H2O 如果二氧化碳过量会有: CaCO3+ CO2+ H2O ==== Ca(HCO3)2 二氧化碳会使烧碱变质:
2NaOH + CO2==== Na2CO3+ H2O 如果二氧化碳过量: NaOH + CO2==== NaHCO3 二氧化碳和金属镁反应: 2Mg+ CO2(过量) ==点燃== 2MgO + C Mg+ CO2 (少量) ==点燃== MgO + CO 工业制法:高温煅烧石灰石: CaCO3 ==高温== CaO + CO2↑ 实验室制法: CaCO3+2HCI=CaCl2+ H2O + CO2↑ 二氧化碳的固定 CO2+C5→(酶) 2C3 在光合作用中的暗反应阶段,一分子的CO2和一分子的五碳化合物反应,生成两分子的三碳化合物。

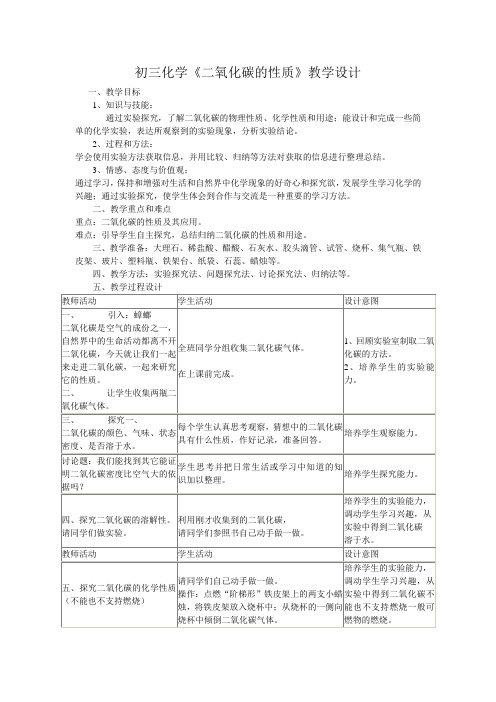
初三化学《二氧化碳的性质》教学设计一、教学目标1、知识与技能:通过实验探究,了解二氧化碳的物理性质、化学性质和用途;能设计和完成一些简单的化学实验,表达所观察到的实验现象,分析实验结论。
2、过程和方法:学会使用实验方法获取信息,并用比较、归纳等方法对获取的信息进行整理总结。
3、情感、态度与价值观:通过学习,保持和增强对生活和自然界中化学现象的好奇心和探究欲,发展学生学习化学的兴趣;通过实验探究,使学生体会到合作与交流是一种重要的学习方法。
二、教学重点和难点重点:二氧化碳的性质及其应用。
难点:引导学生自主探究,总结归纳二氧化碳的性质和用途。
三、教学准备:大理石、稀盐酸、醋酸、石灰水、胶头滴管、试管、烧杯、集气瓶、铁皮架、玻片、塑料瓶、铁架台、纸袋、石蕊、蜡烛等。
四、教学方法:实验探究法、问题探究法、讨论探究法、归纳法等。
五、教学过程设计板书设计课题3 二氧化碳和一氧化碳一、二氧化碳的性质1、物理性质(1)通常状况下是无色无味的气体,干冰易升华;(2)密度比空气的大(同温同压下)(3)能溶于水2、化学性质(1)一般二氧化碳既不能燃烧,也不支持燃烧;(2)二氧化碳不供给呼吸;(3)二氧化碳与水反应:(4)二氧化碳与石灰水的反应《二氧化碳的化学性质》教学反思一、教学设计上的反思:本节课是在新课程理念的指导下设计的,主要有以下特点:1、注重情景设置。
在本节课中有利用实物来创设情景,如课的开始,首先让学生见识了我们生活里常见的昆虫-蟑螂,蟑螂的生命里很强,摘了头还可以活九天,但是把它放入充满二氧化碳的瓶子里,十几秒钟就死亡了。
事情就发生在眼前,学生在熟悉、有趣的情景中探索化学知识,兴趣盎然,求知欲望强烈,以轻松愉快的心情很快就融入了课堂的学习当中。
2、精心设计实验,增强了学生的参与度。
二氧化碳在空气里也有,这是学生都非常熟悉的。
但是二氧化碳看不见,摸不着,闻不到,怎样才能将这种我们用肉眼看不到的气体的性质,通过现象给它呈现出来呢?学生进入思考并猜想了它的性质,最后以小侦探的身份去“破解”并通过实验的方式去取证,来证明自己的猜想。
一氧化碳和二氧化碳的化学性质
一氧化碳(CO)是一种有毒的气体,具有以下性质:
1、一氧化碳是一种不易溶于水的无色、无味、比空气重的无定形气体,在常温常压下溶解度很低,在饱和状态下能达到0.29g/l。
2、一氧化碳主要是由汽油或柴油燃烧时产生的,它也会随着大气污染物一起挥发,具有催化剂作用。
3、一氧化碳还可以用于医用液体界面反应,以生成例如H2CO3氢碳酸酯,并发挥一定的抗菌作用。
二氧化碳(CO2)是一种通用的自然现象,具有以下性质:
1、二氧化碳是一种无色无味的气体,比空气重,在常温常压下,二氧化碳的溶解度大约为38%,在饱和状态下可以达到0.98g/l。
2、二氧化碳主要是由燃烧煤炭、天然气或石油而来,也是主要的环境污染物,但也是一种重要的植物生长所必需的物质,对气候变化也有非常重要的影响。
3、二氧化碳可用于碳酸饮料中的发泡剂,或者是广泛应用于着色剂、布料颜色
等的制作。
从化学性质上来看,二氧化碳比一氧化碳更容易溶于水,更容易挥发,但一氧化碳因其易挥发性而存在于大气中,可持续作用在环境中一段时间,而二氧化碳则很快挥发,所以一氧化碳在环境中的作用更为持久。
初中化学二氧化碳知识点二氧化碳是空气中常见的化合物,碳与氧反应生成其化学式为CO2,接下来为你整理了初中化学二氧化碳学问点,一起来看看吧。
初中化学二氧化碳学问点:二氧化碳的性质1、物理性质:无色,无味的气体,密度比空气大,能溶于水,高压低温下可得固体----干冰2、化学性质:(1)一般状况下不能燃烧,也不支持燃烧,不能供给呼吸(2)与水反应生成碳酸:CO2+H2O==H2CO3 生成的碳酸能使紫色的石蕊试液变红,H2CO3 == H2O+ CO2 碳酸不稳定,易分解(3)能使澄清的石灰水变浑浊:CO2+C(OH)2==CCO3+H2O 本反应可用于检验二氧化碳!(4)与灼热的碳反应:C+CO2高温2CO(吸热反应,既是化合反应又是氧化还原反应,CO2是氧化剂,C是还原剂)3、用处:灭火(灭火器原理:N2CO3+2HCl==2NCl+H2O+CO2)既利用其物理性质,又利用其化学性质干冰用于人工降雨、制冷剂温室肥料4、二氧化碳多环境的影响:过多排放引起温室效应。
初中化学二氧化碳学问点:二氧化碳的制法1、试验室制取气体的思路:(原理、装置、检验)(1)发生装置:由反应物状态及反应条件确定:反应物是固体,需加热,制气体时则用高锰酸钾制O2的发生装置。
反应物是固体与液体,不需要加热,制气体时则用制H2的发生装置。
(2)收集方法:气体的密度及溶解性确定:难溶于水用排水法收集CO只能用排水法密度比空气大用向上排空气法CO2只能用向上排空气法密度比空气小用向下排空气法2、二氧化碳的试验室制法(1)原理:用石灰石和稀盐酸反应:CCO3+2HCl==CCl2+H2O+CO2(2)选用和制氢气相同的发生装置(3)气体收集方法:向上排空气法(4)验证方法:将制得的气体通入澄清的石灰水,如能浑浊,则是二氧化碳。
验满方法:用点燃的木条,放在集气瓶口,木条熄灭。
证明已集满二氧化碳气体。
3、二氧化碳的工业制法:煅烧石灰石:CCO3高温CO+CO2生石灰和水反应可得熟石灰:CO+H2O=C(OH)2初中化学二氧化碳加工方法目前最普遍的干洗技术是接受烃类(石油类)、氯代烃(如四氯乙烯)作为溶剂。
第六章 碳和碳的化合物课题3 二氧化碳的性质教学目的:1、通过实验及分析,掌握二氧化碳的化学性质、物理性质和用途2、联系自然界的生命活动,认识二氧化碳的重要性,了解石灰石的用途 教学重点:二氧化碳的化学性质 教学难点:二氧化碳的检验方法及相应的化学方程式。
教学过程: [复习提问]:碳单质的化学性质及其相应的化学方程式。
CO 2占空气体积的多少? [板书]:一、二氧化碳的物理性质 [演示实验]:实验6—3 6—4 6—5 [讲解]:6—4说明:物理性质:密度比空气大 化学性质:不能燃烧,不能支持燃烧[板书]:二、二氧化碳的化学性质 [板书]:1、二氧化碳无可燃性,无助燃性,不供给呼吸。
[演示实验]:实验6-6 补充右图实验 [讲解]:紫色石蕊试液遇酸变红,遇中性的二氧化碳、水不变色,当CO 2通入含紫色石蕊试液的水后,溶液变红,这说明二氧化碳通入水后有酸生成。
这个酸就是碳酸。
而碳酸不稳定,加热后碳酸又变成二氧化碳从溶液中逸出。
[板书]:2、二氧化碳与水反应[设问]:[板书]:3、与石灰水反应CO 2 + Ca ()OH 2= CaCO 2O[设问]:二氧化碳可以说是让人欢喜让人忧。
同学们是否还记得为什么这样说? [讲解]:“温室效应”:冰山融化,海平面升高,造成洪水泛滥。
[措施]:减少矿物燃料的燃烧,使用清洁能源;植树造林,严禁乱砍滥伐 [板书]:四、石灰石的用途(石灰石、大理石、白垩的主要成份是碳酸钙)1、 加工琢磨、做建筑材料和装饰品 2、 白垩做白色涂料CO 2 + H O = H 2CO 3使紫色石蕊试液变红碳酸不稳定CO 2O H 2CO 33、石灰石做建筑用石料和水泥4、石灰石高温锻烧制生石灰和CO2高温======================。
初三化学二氧化碳的性质
溶液组成的表示方法
盐加的越多,溶液越咸,此时浓度越大。
溶液的浓与稀是指溶质含量的相对多少,它不能准确的表明一定量的溶液中所含溶质的多少。
怎样确切的表示一定量的溶液中含多少溶质呢?
一、溶质的质量分数
定义式:
定义:溶质的质量与溶液的质量之比。
想一想:
上述实验配制的溶液中氯化钠的质量分数是多少?
二、溶液中溶质的质量分数计算
例1:从一瓶氯化钾溶液中取出20 克溶液,蒸干后得到2.8 克氯化钾固体。
试确定这瓶溶液中溶质的质量分数。
这瓶溶液中溶质的质量分数为:
答:这瓶溶液中氯化钾的质量分数为14%。
例2:把50g98%的硫酸稀释成20%的硫酸,需要水多少克?
解:溶液稀释前后,溶质的质量不变。
稀释前、后溶质的质量为:
50g× 98%=49g
例3:配制500mL20%的硫酸需要98%的硫酸多少毫升?
解:查硫酸密度和溶质质量分数对照表得出:20%的硫酸的密度为
1.14g/cm3,98%的硫酸的密度为1.84g/cm3。