皮质醇校准品产品技术要求mairui
- 格式:docx
- 大小:16.31 KB
- 文档页数:2

2性能指标
2.1外观和性状
2.1.1颜色性状
质控品(低值)复溶前应为浅黄色冻干粉末,复溶后应为清澈浅黄色液体;质控品(高值)复溶前应为黄色冻干粉末,复溶后应为清澈黄色液体;均无沉淀、悬浮物和絮状物。
2.1.2包装
分装瓶应为无色硬质玻璃瓶,盖有橡胶瓶内塞和铝盖;盒贴、瓶贴、标签标识应完整、清晰。
橡胶瓶内塞与玻璃配合后应无泄漏;外盖应无明显划痕、崩缺。
2.2装量
质控品质量(含瓶重)均应不少于 6 g。
2.3均一性
2.3.1瓶内均一性
质控品瓶内均一性应不大于表 2 的要求(SD 和CV 值满足其一即可)。
表 2 质控品瓶内均一性要求
2.3.2瓶间均一性
质控品瓶间均一性应不大于表3 的要求(SD 和CV 值满足其一即可)。
表3 质控品瓶间均一性要求
2.4参考值及参考范围
每批质控品均应提供本批产品的参考值表。
经迈瑞校准品校准的BS 系列生化分析仪及配套试剂对质控品进行测定,测定结果应在给定的参考范围内。
1。

皮质醇(Cortisol)测定试剂盒(磁微粒化学发光免疫分析法) 适用范围:用于体外定量测定人血清中皮质醇(Cortisol)的含量。
1.1型号/包装规格
规格A:100人份/盒
规格B:100人份/盒
1.2主要组成成分
定标液和质控品的浓度具有批差异性,详见标签。
2.1 外观
试剂盒中的组分应澄清,应无沉淀和絮状物。
磁分离试剂摇匀后,应为均匀悬浊液,无明显凝集。
2.2 空白限
应不大于1ng/ml。
2.3 准确度
使用纯品作回收实验,其回收率应在(85%~115%)范围内。
2.4 线性
在[1,60]ng/ml测量范围内,剂量-反应曲线线性相关系数R≥0.9900。
2.5 重复性
用不同浓度的两个样本进行检测,各重复检测10次,其变异系数CV应不大于10%。
2.6 批间差
用三个批号试剂盒检测同一份样本,则三批试剂盒之间的批间变异系数CV 应不大于15%。
2.7 特异性
用测定试剂盒测定相应浓度的交叉反应物质,应满足下表要求:
2.8溯源性
根据GB/T 21415-2008及有关规定提供校准品的来源、赋值过程及测量不确定度等内容,溯源至企业内部工作校准品,并与已上市产品比对赋值。
2.9 稳定性
试剂盒在规定的2℃~8℃下保存,有效期为12个月。
取到效期后的产品进行检测,结果应符合2.1、2.2、2.3、2.4、2.5、2.7项的要求。

2性能指标
2.1外观和性状
2.1.1颜色性状
质控品复融前外观应呈现粉末块状固体,不起泡,不塌陷,复融后应为清澈透明液体,无沉淀、无悬浮物、无絮状物。
2.1.2包装
分装瓶应为棕色玻璃瓶,应盖有塑料外盖;盒贴、瓶贴、标签标识、说明书、参考值表应完整、清晰牢固。
塑料瓶盖与玻璃瓶身配合后应无泄漏;塑料外盖应无明显划痕、崩缺。
2.2测量准确度
2.2.1质控参考值表
质控品应可提供一份参考值表,包含适用型号的迈瑞化学发光免疫分析系统
的检测项目参考值及参考范围。
2.2.2赋值准确性
经校准的迈瑞全自动化学发光免疫分析仪检测质控品所包含的检测项目,结果应在参考范围内(不同批次的质控品参考范围参见参考值表)。
2.3均一性
2.3.1瓶内均一性
质控品瓶内均一性应满足变异系数CV≤8.0%。
2.3.2瓶间均一性
质控品瓶间均一性应满足变异系数CV≤5.0%。
2.4生物安全性
使用国家权威管理机构认可的、且不低于我国法定用于血源筛查体外诊断试剂灵敏度的检测试剂,对质控品中乙型肝炎病毒表面抗原、人类免疫缺陷病毒抗体
(HIV-I型和HIV-II型)、丙型肝炎病毒抗体、梅毒螺旋体抗体的检测应为阴性。
1。
![脂蛋白(a)[Lp(a)]校准品产品技术要求mairui](https://uimg.taocdn.com/c56f1693482fb4daa58d4be0.webp)
2、性能指标
2.1外观和性状
2.1.1颜色性状
校准品复溶前应为白色至淡黄色冻干粉末,复溶后应为无色至淡黄色液体,无沉淀。
2.1.2包装
试剂瓶应无泄漏;盒贴、瓶贴、标签标识应完整、清晰。
2.2水分含量
校准品水分含量均应不大于 5.0%。
2.3量值溯源
校准品应溯源至IFCC 参考物质SRM2B。
2.4赋值结果及不确定度的表示方式
校准品应使用规范的表示方式:赋值结果,扩展不确定度。
2.5正确度
测量有证参考物质或者企业参考品,量值传递的正确度应符合|En|≤1。
2.6均匀性
校准品瓶内均匀性和瓶间均匀性应不大于表 2 的要求。
表 2 校准品瓶内均匀性和瓶间均匀性的指标要求
2.7生物安全性
校准品的HBsAg、HIV 抗体、HCV 抗体、梅毒抗体检测应为阴性。

EK8100-01Cortisol Competitive ELISA Kit检测试剂盒(酶联免疫吸附法)Catalog NumberEK8100-48EK8100-96定量检测血清、血浆和细胞培养上清中的皮质醇(Cortisol)浓度。
本产品仅用于科学研究,非诊断试剂,不能用于临床诊断。
一、产品介绍1.背景介绍皮质醇,也称为醋酸氢化可的松或化合物F,是糖皮质激素中的一种类固醇激素。
在人类中,它由肾上腺中的肾上腺皮质束状带产生,在压力和低血糖时释放,可作为压力的一个生物标志物。
皮质醇的产量与ACTH依赖的昼夜节律相关,在早晨达到峰值,随后逐渐降低。
皮质醇在很多基质中可被检测到,如血液、粪便、尿液和唾液。
血清中90-95%的皮质醇与蛋白结合,包括皮质类固醇结合球蛋白和血清白蛋白。
皮质醇主要参与代谢和免疫。
在代谢方面,它可促进糖异生、肝糖原沉积和降低葡萄糖利用率。
在免疫方面,作为重要的抗炎因子,在过敏、免疫抑制和疾病抵抗中发挥重要作用。
异常的皮质醇水平与许多状况有关,包括前列腺癌、抑郁症和精神分裂症。
身体组织中皮质醇过高是库欣综合征的诱因。
2.检测原理本试剂盒采用固相竞争酶联免疫吸附检测技术。
兔抗小鼠抗体预包被在高亲和力的酶标板上。
皮质醇特异性的单克隆抗体加入至孔中,经过孵育,与固相抗体结合。
洗涤后,加入辣根过氧化物酶标记的皮质醇和未标记的皮质醇或样本,竞争结合单克隆抗体上有限的结合位点。
在洗涤去除未结合的物质后,加入显色底物,颜色反应的深浅与皮质醇的浓度成反比。
加入终止液终止反应,在450nm波长(参考波长570-630nm)测定吸光度值。
本试剂盒已验证人、小鼠和大鼠血清样本,但其它物种的皮质醇预计也可被检测。
3.试剂盒检测的局限1)请在本试剂盒标示的有效期内使用。
2)试剂盒的试剂不能与其他批号的试剂或其他来源的试剂混合使用。
3)任何标准品稀释、操作人员、移液技术、洗涤技术、孵育温度、试剂盒保存时间的改变,都将影响结合反应。
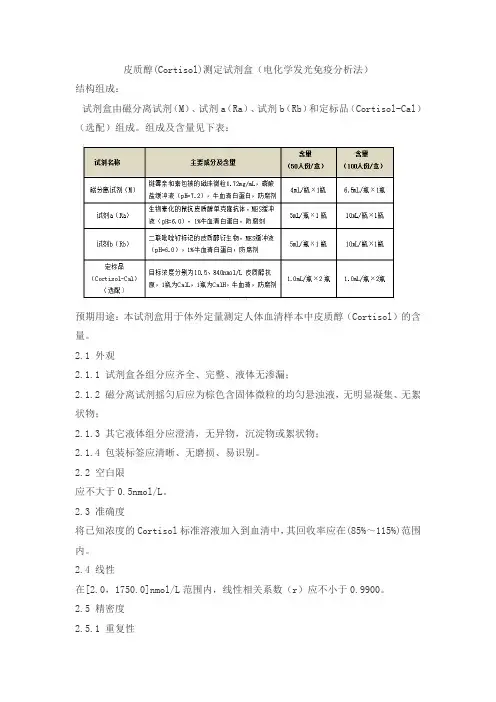
皮质醇(Cortisol)测定试剂盒(电化学发光免疫分析法)结构组成:试剂盒由磁分离试剂(M)、试剂a(Ra)、试剂b(Rb)和定标品(Cortisol-Cal)(选配)组成。
组成及含量见下表:预期用途:本试剂盒用于体外定量测定人体血清样本中皮质醇(Cortisol)的含量。
2.1 外观2.1.1 试剂盒各组分应齐全、完整、液体无渗漏;2.1.2 磁分离试剂摇匀后应为棕色含固体微粒的均匀悬浊液,无明显凝集、无絮状物;2.1.3 其它液体组分应澄清,无异物,沉淀物或絮状物;2.1.4 包装标签应清晰、无磨损、易识别。
2.2 空白限应不大于0.5nmol/L。
2.3 准确度将已知浓度的Cortisol标准溶液加入到血清中,其回收率应在(85%~115%)范围内。
2.4 线性在[2.0,1750.0]nmol/L范围内,线性相关系数(r)应不小于0.9900。
2.5 精密度2.5.1 重复性在试剂盒的线性范围内,检测高、低两个水平的样品,检测结果的变异系数(CV)应不大于8%。
2.5.2 批间差在试剂盒的线性范围内,用3个批号试剂盒分别检测高、低两个水平的样品,检测结果的变异系数(CV)应不大于15%。
2.6 效期末稳定性本产品效期为15个月,试剂盒在2~8℃下保存至有效期末进行检测,检测结果应符合2.1、2.2、2.3、2.4、2.5.1的要求。
2.7 溯源性依据GB/T 21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》的要求提供皮质醇(Cortisol)定标品的来源、赋值过程以及测量不确定度等内容,定标品溯源至企业工作校准品。
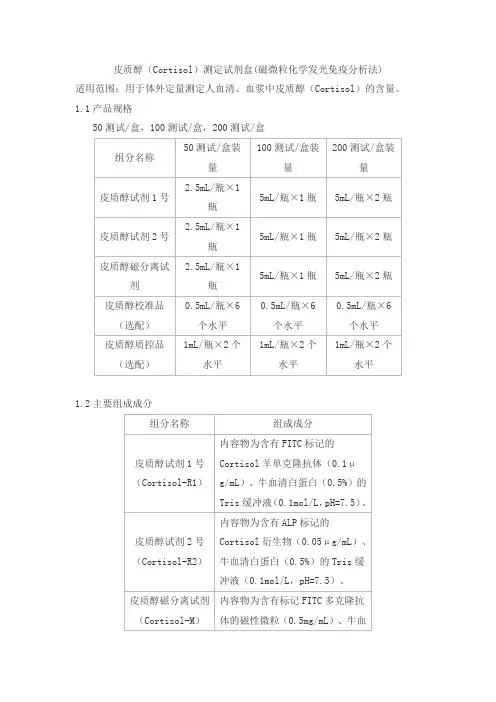
皮质醇(Cortisol)测定试剂盒(磁微粒化学发光免疫分析法)
适用范围:用于体外定量测定人血清、血浆中皮质醇(Cortisol)的含量。
1.1产品规格
50测试/盒,100测试/盒,200测试/盒
1.2主要组成成分
2.1外观
2.1.1试剂盒各组分应齐全、完整、液体无渗漏;
2.1.2磁分离试剂摇匀后为均匀悬浊液,无明显凝集;
2.1.3液体组分应澄清,无沉淀或絮状物;
2.1.4包装标签应清晰,易识别。
2.2溯源性
应根据GB/T21415-2008及有关规定提供校准的来源、溯源的赋值和相应指标、以及不确定度等内容。
本试剂盒校准品可溯源至国际标准物质(编号SRM 921)。
2.3准确度
用国际标准物质(编号:SRM 921)进行检测,其测量结果的相对偏差应在±10%范围内。
2.4 空白限
应不大于0.4µg/dL。
2.5线性
在[1,60]µg/dL的测量范围内,相关系数r应≥0.9900。
2.6重复性
变异系数(CV)应不大于8%。
2.7质控品的赋值有效性
质控品的测量值应在质控范围内。
2.8批间差
变异系数(CV)应不大于15.0%。
2.9稳定性
试剂盒在2~8℃贮存,有效期为12个月,取到效期后的试剂盒样品进行检测,检测结果应符合2.3、2.4、2.5、2.6和2.7的要求。

性能指标
2.1外观和性状
2.1.1颜色性状
质控品应为清澈透明液体,无沉淀、无悬浮物、无絮状物。
2.1.2包装
分装瓶应为透明塑料管,应盖有塑料外盖;盒贴、瓶贴、标签标识、说明书、参考值表应完整、清晰牢固。
塑料外盖与塑料管身配合后应无渗漏;塑料外盖应无明显划痕、崩缺。
2.2装量
每瓶质控品容量应不少于2.0 mL。
2.3测量准确度
2.3.1质控参考值表
质控品应可提供一份参考值表,包含适用型号的迈瑞化学发光免疫分析系统
的检测项目参考值及参考范围。
2.3.2赋值准确性
经校准的迈瑞全自动化学发光免疫分析仪检测质控品所包含的检测项目,结果应在参考范围内(不同批次的质控品参考范围参见参考值表)。
2.4均一性
2.4.1瓶内均一性
质控品瓶内均一性应满足变异系数CV≤8.0%。
2.4.2瓶间均一性
质控品瓶间均一性应满足变异系数CV≤5.0%。
2.5生物安全性
使用国家权威管理机构认可的、且不低于我国法定用于血源筛查体外诊断试剂
灵敏度的检测试剂,对质控品中乙型肝炎病毒表面抗原、人类免疫缺陷病毒抗体(HIV-I型和HIV-II型)、丙型肝炎病毒抗体、梅毒螺旋体抗体的检测应为阴性。
1。

化学发光法24小时尿液皮质醇说明书一、产品名称化学发光法 24 小时尿液皮质醇检测试剂盒二、产品概述化学发光法 24 小时尿液皮质醇检测是一种用于定量测定人体 24 小时尿液中皮质醇含量的检测方法。
皮质醇是一种由肾上腺皮质分泌的重要激素,其水平的变化对于评估肾上腺皮质功能、诊断相关疾病具有重要意义。
三、检测原理本检测方法基于化学发光免疫分析技术。
试剂盒中的抗体与尿液中的皮质醇特异性结合,形成免疫复合物。
通过一系列化学反应,产生发光信号,发光强度与尿液中皮质醇的浓度成正比。
检测仪器根据发光强度,计算出尿液中皮质醇的含量。
四、适用范围1、辅助诊断肾上腺皮质功能亢进或减退症,如库欣综合征、艾迪生病等。
2、监测下丘脑垂体肾上腺轴(HPA 轴)的功能状态。
3、评估某些药物(如糖皮质激素)对肾上腺皮质功能的影响。
五、样本采集与处理1、样本采集患者需收集 24 小时内的全部尿液。
可以在早晨起床后的第一次排尿时开始收集,直至第二天早晨起床后的第一次排尿结束。
收集尿液时,使用干净、无防腐剂的容器,并将尿液保存在 2 8℃的环境中。
2、样本处理充分混匀收集的 24 小时尿液。
准确测量尿液的总体积,并记录下来。
取适量的尿液样本进行离心处理,以去除杂质。
六、检测步骤1、准备工作检查试剂盒是否在有效期内,试剂是否齐全。
按照仪器操作说明书,对检测仪器进行预热和校准。
2、加样将处理好的尿液样本和标准品、质控品分别加入相应的反应孔中。
3、孵育将加样后的反应板放入孵育箱中,在规定的温度和时间内进行孵育。
4、洗涤孵育结束后,用洗涤液对反应板进行多次洗涤,以去除未结合的物质。
5、加发光试剂向反应孔中加入发光试剂,轻轻混匀。
6、检测将反应板放入检测仪器中,进行发光强度的检测。
7、结果计算检测仪器根据标准品的浓度和发光强度,绘制标准曲线。
通过标准曲线,计算出尿液样本中皮质醇的浓度。
七、结果解读1、正常参考值不同实验室可能会有略微不同的参考值范围。

1 性能指标2.1外观和性状试剂盒各组分应齐全、完整、液体无渗漏;包装标签应清晰,准确、牢固;Ra 组分应为棕色含固体微粒的液体,无板结、无絮状物。
Rb 组分应为清澈透明的液体,无沉淀、无悬浮物、无絮状物;校准品应为清澈透明液体,无沉淀、无悬浮物、无絮状物。
分装瓶应为透明塑料管,盖有塑料外盖。
2.2装量应不少于试剂的标示装量值。
2.3准确度2.3.1将hGH 国家标准品配成两个浓度水平的样品,用待检试剂盒进行检测,其检测结果与标定靶值的相对偏差在±10%范围内。
2.3.2对具有溯源性的两个浓度水平的正确度控制品进行检测,检测结果与标定浓度的相对偏差在±10%范围内。
2.4最低检测限应不大于0.02 ng/mL。
2.5线性试剂盒在0.03 ng/mL~50 ng/mL 区间内,其相关系数(r)应不低于0.9900。
2.6重复性变异系数CV 应≤ 5%。
2.7批间差变异系数CV 应≤ 10%。
2.8校准品均一性2.8.1校准品瓶内均一性C0的标准差(SD)应不大于0.024ng/mL,C1和C2的变异系数(CV)应不大于8.0%。
2.8.2校准品瓶间均一性C0 的标准差(SD)应不大于0.02 ng/mL,C1 和C2 的变异系数(CV)应不大于5.0%。
2.9生物安全性使用国家权威管理机构认可的、且不低于我国法定用于血源筛查体外诊断试剂灵敏度的检测试剂,对校准品中乙型肝炎病毒表面抗原、人类免疫缺陷病毒抗体(HIV-I 型和HIV-II1型)、丙型肝炎病毒抗体、梅毒螺旋体抗体的检测应为阴性。
2.10稳定性2~8℃避光保存,试剂盒有效期为365 天。
到有效期后90 天内的试剂盒应符合2.1、2.3、2.4、2.5、2.6、2.8 的要求。
2。

2性能指标
2.1外观和性状
2.1.1颜色性状
校准品复溶前为淡黄色冻干粉末;复溶后为清澈淡黄色液体,无沉淀、无悬浮物和絮状物。
2.1.2包装
分装瓶为棕色硬质玻璃瓶,盖有橡胶瓶内塞和塑料外盖;盒贴、瓶贴、标签标识、说明书应完整、清晰。
橡胶瓶内塞与玻璃配合后应无泄漏;塑料外盖应无明显划痕、崩缺。
2.2装量
每瓶脂类校准品重量(含瓶重)应不少于6g。
2.3溯源性
2.3.1参考值表
校准品应可提供所包含检测项目的参考值表。
2.3.2赋值准确性
经脂类校准品校准的迈瑞BS 系列检测由高一级测量程序定值的参考血清,结果的偏倚应满足表2 要求。
表 1 校准品赋值准确性的允许偏倚范围
2.3.3参考方法及测量不确定度
应提供对校准品进行赋值时采用的方法及对应的测量不确定度计算方法。
2.4均一性
2.4.1瓶内均一性
校准品瓶内均一性应不大于表3 的要求(SD 和CV 值满足其一即可)。
表 2 校准品瓶内均一性的指标要求
2.4.2瓶间均一性
校准品瓶间均一性应不大于表4 的要求(SD 和CV 值满足其一即可)。
表 3 校准品瓶间均一性的指标要求
2.5生物安全性
使用国家权威管理机构认可的、且不低于我国法定用于血源筛查体外诊断试剂灵敏度的检测试剂对HBsAg、HIV 抗体、HCV 抗体、梅毒螺旋体TP 抗体检测应为阴性。
医疗器械产品技术要求编号:皮质醇测定试剂盒(均相酶免疫法)1.产品型号/规格及其划分说明注:校准品、质控品靶值批特异,详见靶值单。
2.1外观试剂1为无色至黄色澄清液体,目测不得有任何沉淀及絮状悬浮物;试剂2为无色至黄色澄清液体,目测不得有任何沉淀及絮状悬浮物;校准品为无色至黄色澄清液体,目测不得有任何沉淀及絮状悬浮物。
质控品为无色至黄色澄清液体,目测不得有任何沉淀及絮状悬浮物。
试剂盒标签标识清晰,外包装完整无损。
2.2净含量试剂的净含量应不少于标称量。
2.3试剂空白2.3.1试剂空白吸光度A340nm下测定空白吸光度应≤1.8000。
2.3.2试剂空白吸光度变化率A340nm下测定试剂空白吸光度变化率(ΔA/min)应在0.08~0.24范围内。
2.4准确度使用试剂盒对国际标准物质ERM-DA193进行测试,准确性偏差应不超过±15%。
2.5分析灵敏度样本浓度为200ng/mL时,其吸光度变化应不小于0.0200。
2.6线性在[20,750]ng/mL区间内,线性相关系数r≥0.990,在[20,150]ng/mL区间内测定的绝对偏差应不超过±15ng/mL,在(150,750]ng/mL区间内测定的相对偏差应不超过±10.0%。
2.7测量精密度2.7.1重复性使用高、低不同浓度的样本重复测定20次,其测定值的变异系数(CV%)应不大于10.0%。
2.7.2批间差随机抽取三批试剂盒的批间相对极差(R)应不大于10.0%。
2.8质控品赋值有效性使用质控品进行测定,所得结果应在质控范围内。
2.9稳定性试剂盒在2℃~8℃密封避光保存,有效期为12个月。
在试剂盒有效期满后一个月以内进行检测,应符合2.1、2.3、2.4、2.5、2.6、2.7.1、2.8的要求。
2.10溯源性按照GB/T21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》的要求,提供所用产品校准品的来源、赋值过程以及测量不确定度,试剂盒校准品溯源至国际标准物质ERM-DA193。
1性能指标
1.1外观
试剂应为乳白色悬浊液,无异物和凝集物。
1.2装量
试剂的净含量应不少于标示值。
1.3试剂空白
1.3.1试剂空白吸光度
试剂以水为空白在37 ℃±1 ℃,850 nm波长条件下,吸光度应小于2.0 A。
1.3.2试剂空白吸光度变化率
试剂以水为空白在37 ℃±1 ℃,850 nm波长条件下,吸光度变化率应小于
0.0030A/min 。
1.4分析灵敏度
当样本浓度为 4mg/L 时,吸光度变化率应不小于0.0070 A/min。
1.5线性范围
试剂盒在(0.2~320)mg/L范围内:
a)线性相关系数r应不小于0.990;
b)当样本浓度不大于10 mg/L时,线性绝对偏差应不大于±1.0mg/L;当样
本浓度大于10 mg/L时,线性相对偏差应不大于±15.0%。
1.6测量精密度
1.6.1重复性
当样本浓度不大于10 mg/L时,标准偏差:s应不大于0.5mg/L;
当样本浓度大于10mg/L,变异系数:CV应不大于4.0%;
1.6.2批间差
相对偏差:R应不大于10.0%。
1.7准确度
测定校准品,测定结果与靶值的相对偏差应满足下述要求:
相对偏差应在±10%内;
1.8分析特异性
抗坏血酸浓度在150 mg/dL内、内源性酯浓度在1000 mg/dL内、胆红素浓度在100 mg/dL内,对试剂检测结果的偏差影响应在±10.0%以内。
1性能指标
1.1外观
质控品为浅黄色液体,清澈透明,无沉淀、无悬浮物和絮状物。
1.2包装
分装瓶为棕色硬质玻璃瓶,盖有橡胶瓶内塞和塑料外盖;盒贴、瓶贴、标签标识应完整、清晰。
橡胶瓶内塞与玻璃配合后应无泄漏;塑料外盖应无明显划痕、崩缺。
1.3装量
液体质控品装量应不少于标示值。
1.4均一性
1.4.1瓶内均一性
质控品瓶内均一性应不大于表2的要求(SD和CV值满足其一即可)
表 2 质控品瓶内均一性的指标要求
1.4.2瓶间均一性
质控品瓶间均一性应不大于表3的要求(SD和CV值满足其一即可)。
表 3 质控品瓶间均一性的指标要求
1.5参考值及参考范围
每批质控品均应提供本批产品的参考值和参考范围表。
经迈瑞校准品校准的血液细胞分析仪及配套试剂对质控品进行测定,测定结果应在给定的参考范围内。
1.5生物安全性
使用国家权威管理机构认可的、且不低于我国法定用于血源筛查体外诊断试剂灵敏度的检测试剂对质控品中HBsAg、HIV抗体、HCV抗体、梅毒螺旋体TP抗体检测应为阴性。
1 性能指标
2.1外观和性状
2.1.1颜色性状
校准品应为清澈透明液体,无沉淀、无悬浮物、无絮状物。
2.1.2包装
分装瓶应为塑料管,盖有塑料外盖;盒贴、瓶贴、标签标识、说明书、校准卡应完整、清晰牢固。
塑料外盖与塑料管身配合后应无渗漏;塑料外盖应无明显划痕、崩缺。
2.2装量
校准品C0、C1 和C2 容量应不少于 1.0 mL。
2.3溯源性
2.3.1校准信息卡
校准品应可提供一份校准卡,包含校准品有效期和校准品各浓度水平的信息。
2.3.2赋值准确性
经校准品校准的迈瑞全自动化学发光免疫分析仪检测具有溯源性的两个浓度水平的正确度控制品,结果的偏倚应在±10.0% 范围内。
2.4均一性
2.4.1瓶内均一性
校准品瓶内均一性C0以标准偏差SD为指标,满足SD≤14.5pg/mL;C1和C2以变异系数CV为指标,满足CV≤10.0%。
2.4.2瓶间均一性
校准品瓶间均一性C0以标准偏差SD为指标,满足SD≤14.5pg/mL;C1和C2以变异系数CV为指标,满足CV≤10.0%。
2.5生物安全性
使用国家权威管理机构认可的、且不低于我国法定用于血源筛查体外诊断试剂灵敏度的检测试剂对校准品中乙型肝炎病毒表面抗原、人类免疫缺陷病毒抗体(HIV-I 型和HIV-II
型)、丙型肝炎病毒抗体、梅毒螺旋体抗体的检测应为阴性。
皮质醇lcms的检测标准皮质醇(Cortisol)是一种重要的激素,对于维持机体稳态和应对压力具有重要意义。
LC-MS(液相色谱-质谱法)是检测皮质醇的常用方法,具有高灵敏度、高准确性和高分辨率等特点。
关于皮质醇LC-MS的检测标准,以下几点值得关注:1. 样本处理:皮质醇LC-MS检测的样本通常为生物体液(如血清、尿液等)。
在检测前,需要对样本进行适当的处理,如离心、过滤、萃取等,以去除杂质和干扰物质。
2. 色谱条件:为了获得较好的分离效果和检测灵敏度,需要优化液相色谱条件,如色谱柱、流动相、梯度洗脱等。
不同类型的色谱柱和流动相组合可能对皮质醇的检测效果产生较大影响。
3. 质谱条件:质谱条件的优化对于皮质醇的检测灵敏度和准确性至关重要。
常用的质谱检测方式有负离子电喷雾质谱(ESI-MS)和多反应监测(MRM)等。
优化质谱条件包括选择合适的离子源、气体流量、碰撞能量等。
4. 标准品:选择合适的标准品对于建立和验证LC-MS检测方法至关重要。
皮质醇的标准品可以是纯品或已知含量的商业制品。
在使用标准品时,应注意其保质期、储存条件等因素。
5. 方法验证:为确保LC-MS检测方法的准确性和可靠性,需要进行方法验证。
方法验证通常包括线性范围、检测限、精密度、回收率等指标的评估。
6. 数据处理和分析:LC-MS检测产生的数据需要进行处理和分析,以获得准确的皮质醇浓度。
常用的数据处理方法包括基线校正、峰识别、定量分析等。
在我国,皮质醇LC-MS的检测标准主要参照GB(国家标准)和WS(卫生行业标准)等体系。
此外,还可以参考国际标准,如世界卫生组织(WHO)和美国临床实验室标准化协会(CLSI)等制定的相关标准。
在实际检测过程中,应根据具体应用场景和需求,参照相关标准进行方法建立和优化。
同时,关注制造商的技术支持和质量控制,确保皮质醇LC-MS检测的准确性和可靠性。
2性能指标
2.1外观和性状
2.1.1颜色性状
校准品应为清澈透明液体,无沉淀、无悬浮物、无絮状物。
2.1.2包装
分装瓶应为白色塑料瓶,盖有塑料外盖;盒贴、瓶贴、标签标识、说明书、校准卡应完整、清晰牢固。
塑料外盖与塑料瓶身配合后应无泄漏;塑料外盖应无明显划痕、崩缺。
2.2装量
每瓶校准品容量应不少于 2.0 mL。
2.3溯源性
2.3.1校准信息卡
校准品应可提供一份校准卡,包含校准品有效期和校准品各浓度水平的信息。
2.3.2赋值准确性
经校准品校准的迈瑞全自动化学发光免疫分析仪检测由较高溯源级别测量程序赋值的两个浓度水平的正确度控制品,结果的偏倚应在±10.0% 范围内。
2.4均一性
2.4.1瓶内均一性
校准品瓶内均一性C0以标准偏差SD为指标,满足SD≤0.40 μg/dL;C1和C2以变异系数CV为指标,满足CV≤8.0%。
2.4.2瓶间均一性
校准品瓶间均一性C0以标准偏差SD为指标,满足SD≤0.25 μg/dL;C1和C2以变异系数CV为指标,满足CV≤5.0%。
2.5生物安全性
使用国家权威管理机构认可的、且不低于我国法定用于血源筛查体外诊断试剂灵敏度的检测试剂,对校准品中乙型肝炎病毒表面抗原、人类免疫缺陷病毒抗体(HIV-I型和HIV-II型)、丙型肝炎病毒抗体、梅毒螺旋体抗体的检测应为阴性。