生化复合校准品产品技术要求雷诺华
- 格式:docx
- 大小:19.96 KB
- 文档页数:3

生化分析用校准物、质控物产品技术审评规范(2017版)发布时间:2021年06月04日分享:本规范旨在指导注册申请人对校准物、质控物产品注册申报资料的准备及撰写,同时也为技术审评部门对注册申报资料的技术审评提供参考。
本规范是对校准物、质控物产品的一般要求,申请人应依据具体产品的特性对注册申报资料的内容进行充实和细化,并依据产品特性确定其中的具体内容是否适用。
本规范是对注册申请人和审查人员的指导性文件,但不包括注册审批所涉及的行政事项,亦不作为法规强制执行,如果有能够满足相关法规要求的其他方法, 也可以采用,但需要提供详细的研究资料和验证资料。
应在遵循相关法规的前提下使用本规范。
本规范是在现行法规和标准体系以及当前认知水平下制定的,随着法规和标准的不断完善,以及科学技术的不断发展,本规范相关内容也将进行适时调整。
一、适用范围本规范适用于依据《体外诊断试剂注册管理办法》(国家食品药品监督管理总局令第5号)(以下简称《办法》)管理类别为第二类的校准物和质控物。
本规范适用于在生化分析仪上使用,用于检测系统校准的校准物,不适用于生化分析仪电解质模块用校准物。
适用于在生化分析仪上使用,用于适配试剂或检测系统质量控制的定值质控物,不适用于正确度质控物。
作为独立注册单元申报的校准物和质控物应执行本规范,作为试剂盒组分与试剂合并申报的校准物和质控物可参照执行。
依据《办法》,与第一类体外诊断试剂配合使用的校准物、质控物,按第二类产品进行注册;与第二类、第三类体外诊断试剂配合使用的校准物、质控物单独申请注册时,按与试剂相同的类别进行注册;多项校准物、质控物,按其中的高类别进行注册。
二、注册申报资料要求(-)综述资料综述资料主要包括产品预期用途、产品描述、有关生物安全性的说明、研究结果的总结评价以及同类产品上市情况介绍等内容,应符合《办法》和《关于公布体外诊断试剂注册申报资料要求和批准证明文件格式的公告》(国家食品药品监督管理总局公告2014年第44号)的相关要求。

半自动生化分析仪1.性能指标1.1外观和结构1.1.1分析仪面板上的文字符号标识清晰;1.1.2分析仪紧固件连接应牢固可靠,不得有松动;1.1.3分析仪运动部件应平稳,不应卡住、突跳及显著空回,键组回跳应灵活;1.1.4RT-9700吸液键和按键颜色为橙色,RT-9400吸液键和按键颜色为灰色。
1.2性能1.2.1波长准确度和重复性分析仪波长准确度与重复性应符合表2要求。
表2波长准确度与重复性要求名称滤光片式准确度偏倚±2nm半宽度≤10nm1.2.2杂光分析仪的杂光应不大于0.5%(或吸光度不小于2.5)。
1.2.3吸光度线性分析仪的吸光度线性应符合表3的要求表3吸光度线性要求吸光度偏倚0.2<吸光度≤0.5不超过±5%0.5<吸光度≤1.0不超过±4%1.0<吸光度≤1.8不超过±2%1.2.4分析仪重复性分析仪重复性测量的变异系数CV≤1.0%。
1.2.5分析仪稳定性340nm处,20min内,蒸馏水吸光度的变化应不大于0.005。
1.2.6分析仪交叉污染率反应液总量为1mL时,其样本间的交叉污染率应不大于1%。
1.2.7温度准确性与波动温度准确性应不大于±0.5℃,温度波动应不大于0.4℃。
1.2.8临床项目批内精密度分析仪对项目浓度范围应满足表3的质控血清进行重复测量的变异系数(CV)应满足表4的要求。
表4临床项目批内精密度要求项目名称分析方法浓度范围变异系数ALT(丙氨酸氨基转移酶)动态法(60~70)U/L≤5% UREA(尿素)二点法(9.00~10.00)mmol/L≤3.5%TP(总蛋白)终点法(60.0~65.0)g/L≤2.5%1.2.9分析仪的基本功能a)应至少具有动态法、两点法、终点法等分析方法;b)应至少有一点定标、多点定标等定标方法;c)波长范围至少包含340nm~620nm(固定波长或连续波长);d)数据贮存和输出功能。
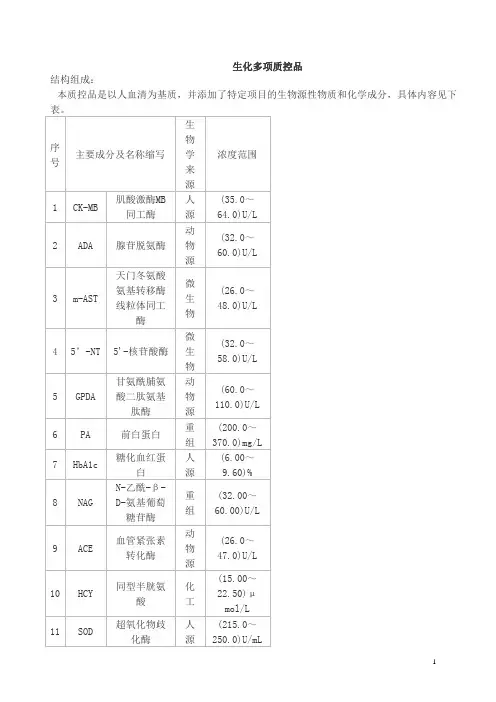
生化多项质控品
结构组成:
本质控品是以人血清为基质,并添加了特定项目的生物源性物质和化学成分,具体内容见下
预期用途:,用于以下生化项目的室内质量控制:肌酸激酶MB同工酶、腺苷脱氨酶、天门冬氨酸氨基转移酶线粒体同工酶、5'-核苷酸酶、甘氨酰脯氨酸二肽氨基肽酶、前白蛋白、糖化血红蛋白、N-乙酰-β-D-氨基葡萄糖苷酶、血管紧张素转化酶、同型半胱氨酸、超氧化物歧化酶。
2.1 外观和性状
2.1.1 外包装完整无破损;中文包装标签应清晰、准确、牢固。
2.1.2 本质控品应为红色冻干粉;复溶后应为红色液体,无浑浊,无未溶解物。
2.2 可接受区间/值
各项目在其测量系统上的测定结果应在可接受区间内。
2.3 均匀性
2.3.1 瓶内均匀性
)应不大于10%。
各项目的瓶内均匀性变异系数(CV
瓶内
2.3.2 瓶间均匀性
)应不大于10%。
各项目的瓶间均匀性变异系数(CV
瓶间
2.4 稳定性
2.4.1 复溶稳定性
复溶后的质控品密封保存于2 ℃~8 ℃、避光环境中,可稳定3天;复溶后的质控品密封保存于不高于-18℃、避光环境中,可稳定10天。
在稳定期内赋值结果的变化趋势不显著。
2.4.2 效期稳定性
质控品保存于2 ℃~8 ℃,有效期为24个月。
在有效期内赋值结果的变化趋势不显著。
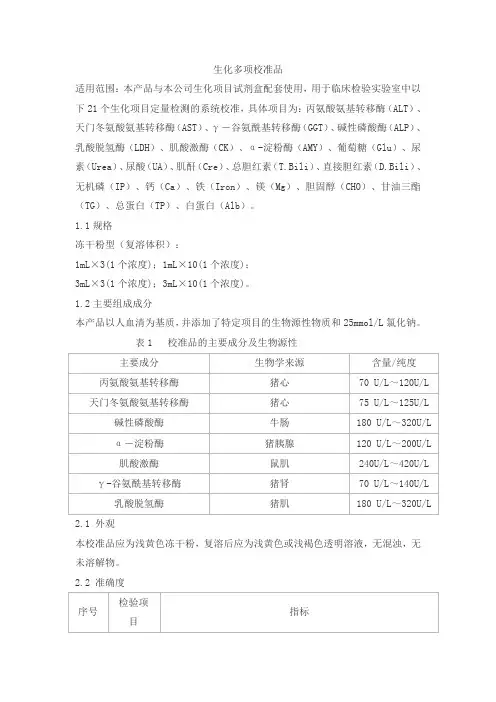
生化多项校准品适用范围:本产品与本公司生化项目试剂盒配套使用,用于临床检验实验室中以下21个生化项目定量检测的系统校准,具体项目为:丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、γ-谷氨酰基转移酶(GGT)、碱性磷酸酶(ALP)、乳酸脱氢酶(LDH)、肌酸激酶(CK)、α-淀粉酶(AMY)、葡萄糖(Glu)、尿素(Urea)、尿酸(UA)、肌酐(Cre)、总胆红素(T.Bili)、直接胆红素(D.Bili)、无机磷(IP)、钙(Ca)、铁(Iron)、镁(Mg)、胆固醇(CHO)、甘油三酯(TG)、总蛋白(TP)、白蛋白(Alb)。
1.1规格冻干粉型(复溶体积):1mL×3(1个浓度);1mL×10(1个浓度);3mL×3(1个浓度);3mL×10(1个浓度)。
1.2主要组成成分本产品以人血清为基质,并添加了特定项目的生物源性物质和25mmol/L氯化钠。
表1 校准品的主要成分及生物源性2.1 外观本校准品应为浅黄色冻干粉,复溶后应为浅黄色或浅褐色透明溶液,无混浊,无未溶解物。
2.2 准确度2.3瓶间差变异系数(CV)应≤5%。
2.4 含水量含水量应≤5%。
2.5稳定性2.5.1效期稳定性原包装校准品在2℃~8℃条件下避光贮存,有效期为18个月。
在有效期满后3个月内,校准品性能应符合2.1、2.2、2.3要求。
2.5.2复溶稳定性复溶后校准品在15℃~25℃密封避光保存,在稳定期满后2小时内,校准品性能应符合2.1、2.2、2.3要求。
复溶后校准品在2℃~8℃密封避光保存,在稳定期满后2小时内,校准品性能应符合2.1、2.2、2.3要求。
复溶后校准品在-25℃~-15℃密封避光保存,在稳定期满后8小时内,校准品性能应符合2.1、2.2、2.3要求。
2.6溯源性校准品溯源性应符合GB/T 21415-2008的要求,并提供相关溯源过程、测定值不确定度等内容,本校准品溯源情况详见附录A。
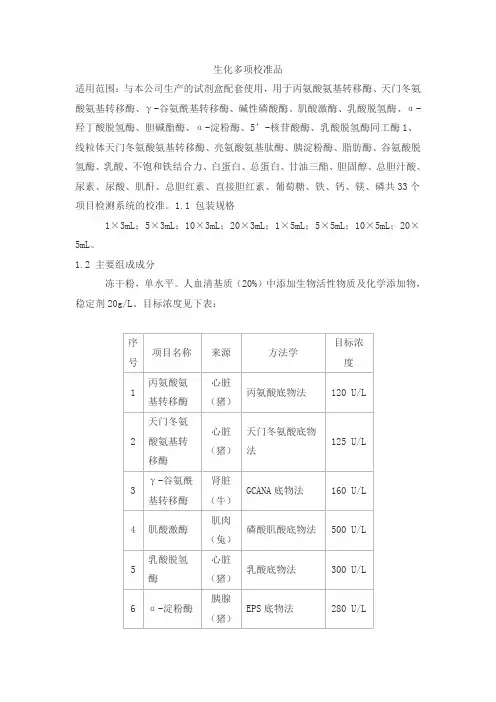
生化多项校准品适用范围:与本公司生产的试剂盒配套使用,用于丙氨酸氨基转移酶、天门冬氨酸氨基转移酶、γ-谷氨酰基转移酶、碱性磷酸酶、肌酸激酶、乳酸脱氢酶、α-羟丁酸脱氢酶、胆碱酯酶、α-淀粉酶、5’-核苷酸酶、乳酸脱氢酶同工酶1、线粒体天门冬氨酸氨基转移酶、亮氨酸氨基肽酶、胰淀粉酶、脂肪酶、谷氨酸脱氢酶、乳酸、不饱和铁结合力、白蛋白、总蛋白、甘油三酯、胆固醇、总胆汁酸、尿素、尿酸、肌酐、总胆红素、直接胆红素、葡萄糖、铁、钙、镁、磷共33个项目检测系统的校准。
1.1 包装规格1×3mL;5×3mL;10×3mL;20×3mL;1×5mL;5×5mL;10×5mL;20×5mL。
1.2 主要组成成分冻干粉,单水平。
人血清基质(20%)中添加生物活性物质及化学添加物,稳定剂20g/L。
目标浓度见下表:校准品靶值批特异,详见靶值单。
2.1 外观2.1.1 试剂为冻干粉,复溶后为无色至淡黄色液体,无可见不溶物。
2.1.2 包装外观应整洁,标签字迹清晰,不易脱落。
2.2 水分含量水分含量不超过3%。
2.3 赋值结果及不确定度的表示方式赋值结果及不确定度的表达方式应符合(赋值结果,扩展不确定度)。
2.4 量值溯源根据GB/T21415及有关规定提供校准品的来源、赋值过程及测量不确定度等内容,溯源情况见下表:2.5 正确度2.5.1 量值溯源至国家标准物质的项目使用校准品校准后测试国家标准物质,量值传递的正确度En绝对值≤1。
2.5.2 量值溯源至公司内部工作校准品的的项目测试工作校准品,量值传递的正确度En绝对值≤1。
2.6 均匀性2.6.1 瓶内均匀性赋值结果的瓶内均匀性(CV)见下表:2.6.2 瓶间均匀性赋值结果的瓶间均匀性(CV)不大于8%。
2.7 稳定性2.7.1 效期稳定性2℃~8℃避光保存可稳定12个月。
稳定期内赋值结果的变化趋势不显著。

多项生化校准品适用范围:与本公司生产的试剂盒配套使用,用于白蛋白、α-淀粉酶、丙氨酸氨基转移酶、天门冬氨酸氨基转移酶、二氧化碳、钙、氯、肌酸激酶、肌酐、γ-谷氨酰基转肽酶、葡萄糖、乳酸脱氢酶、镁、钾、总蛋白、钠、尿素、尿酸、锌、胆碱酯酶、胆固醇、甘油三酯、α-羟丁酸脱氢酶、碱性磷酸酶、总胆红素、直接胆红素、脂肪酶、总胆汁酸、乳酸、磷共30项检测系统的校准。
1.1包装规格1×5mL;3×5mL;6×5mL。
1.2主要组成成分冻干粉末,其基质由0.02mol/L Tris缓冲液、300mL/L人血清、0.05mL/L Proclin300组成,其中各项靶值浓度范围见下表1。
表1各项靶值浓度范围校准品靶值批特异,详见说明书。
2.1外观和性状2.1.1各组分应齐全、完整、无渗漏;外包装完好、无破损,标签完好、字迹清晰。
2.1.2开封前应为白色或淡黄色冻干粉。
2.1.3复溶后应为浅黄色溶液,无浑浊,无未溶解物。
2.2准确度见表2:表2准确度要求2.3重复性变异系数(CV)应不超过10%。
2.4批内瓶间差变异系数(CV)应不超过10%。
2.5量值溯源根据GB/T21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》及有关规定提供校准品的来源、赋值过程及测量不确定度等内容,溯源情况见表3:表3溯源情况2.6稳定性2.6.1复溶稳定性复溶后的校准品在2℃~8℃条件下密闭避光保存,其中:1)二氧化碳可稳定6小时;2)胆红素可稳定6小时;3)其余项目可稳定1天。
各项目检测结果应符合2.2、2.3之规定。
复溶后的校准品在-20℃条件下密闭保存,可以稳定15天,应符合2.2、2.3之规定。
2.6.2效期稳定性该产品在2℃~8℃条件下密闭贮存有效期为24个月,取效期末的产品进行检测,应符合2.2、2.3之规定。

多项生化类质控品适用范围:与本公司生产的试剂盒配合使用,用于总酸性磷酸酶、丙氨酸氨基转移酶/谷丙转氨酶、天门冬氨酸氨基转移酶/谷草转氨酶、白蛋白、碱性磷酸酶、α-淀粉酶、胰腺淀粉酶、载脂蛋白A1、载脂蛋白B、钙离子、氯离子、补体C3、补体C4、二氧化碳、肌酸磷酸激酶、肌酐、胆碱脂酶、直接胆红素、铁离子、葡萄糖、谷氨酰基转移酶、α-羟基丁酸脱氢酶、高密度脂蛋白胆固醇、免疫球蛋白A 、免疫球蛋白G 、免疫球蛋白M 、钾离子、脂肪酶、低密度脂蛋白胆固醇、乳酸脱氢酶、镁离子、钠离子、磷、前白蛋白、磷脂、尿酸、不饱和铁结合力、尿素/尿素氮、甘油三酯、总胆红素、总胆固醇、总蛋白、总胆汁酸、转铁蛋白、铜离子、乳酸、亮氨酸氨基肽酶、乳酸脱氢酶同工酶1、锌离子、血管紧张素转化酶共50个项目的室内质量控制。
1.1规格冻干品,复溶体积:1×5mL;5×5mL;10×5mL;20×5mL1.2 组成本质控品为冻干品,在人血清基质中添加表1中的物质。
表1质控品组成1 电压测量:误差不超过±10%2 时间间隔:误差不超过±5%3 时间常数:0.1s误差不超过±40%4 幅频特性:1Hz~30Hz 偏差不超过+5%~-30%5 功率谱幅度:偏差不超过±10%6 功率谱频率:误差不超过±5%7 噪声电平:不大于2μV(峰-峰值)8 共模抑制比:不小于100dB9 耐极化电压:加±300mV的直流极化电压,偏差不超过±5%10 输入阻抗:≥20MΩ。
11 信号采集:可采集记录8、16、19个通道脑电信号。
12 事件标记:在采集过程中可进行事件标记,标记数不少于20次。
13 定位检索功能可选择采集过程中所做的任一标记处开始显示和处理数据。
14蓝牙传输距离:无障碍传输距离不小于8m。
15蓝牙传输速率:每通道200字节,16通道3200字节16 压缩谱阵图绘制功能可以在屏幕上绘制任意两通道脑电信号的压缩谱阵图。

复合校准品1.校准品用途本校准品用于光电检测系统体外定量测定人血清或血浆的多种分析物的校准。
2.订货信息:货号校准品规格59100991006320×3ml5910099100646×3ml3.标准品说明:本校准品为(以人血清为基础)冻干稳定校准品。
4.标准品储存:未打开校准品必须储存在2~8℃。
5.标准品稳定性5.1未开瓶:稳定至标签上指示的失效期。
5.2开瓶:复溶后,若按下表指示温度紧盖保存,可以稳定至表中所列的期限。
-20℃*+4℃+25℃胆红素(置暗处)14天8小时4小时酸性磷酸酶(总和前列腺特异)30天2天2小时其他项目30天2天8小时*只能冰冻一次(必须注意对本产品的的完善保存和处理)。
6.标准品注意事项:用于制备本校准品的每个血液供血者,都对他们的血液使用认可的方法进行HbsAg、抗-HIV1+2和抗-HCV检测,结果均为阴性。
但是,无法肯定使用人血制备的产品内没有传染原,所以建议:在使用本校准品时,应和使用病人标本进行检测具有相同的防范措施。
7.标准品准备:本校准品为真空的冻干品,所以在打开复溶时一定要非常小心,当心有冻干粉末的丢失。
复溶时准确加入蒸馏水3.0ml。
仔细盖上盖子,静置30min,其中温和振摇几次。
不可出现泡沫!不可震摇!。
8.标准品使用方法:以该批号的校准品说明书所列的各个项目的校准值校准仪器。
9.校准值:申能公司提供的TruCalU校准品,按照确定的方案进行定值,它的各个项目校准值可以溯源至CDC参考品系列。
10.参考文献DatiF.Referencematerialsandguidelinesforstandardizationofmethodsinl aboratorymedicine.In:ThomasL,editor.Clinicallaboratorydiagnostics.1sted .Frankfurt:TH-BooksVerlagsgesellsschft;1998.p.1404-1426.MossDW,HendersonAR,.Enzymes.In:BurtisCA,AshwoodER,editors.Tietz TextbookofClinicalChemistry.2nded.Philadelphia:W.BSaundersCompany;1 994.p.735-896.3.BiosafetyinMicrobiologicalandbiomedicalLaboratories.U.S.Departme ntofHealthandhumanServices,Washington1993(HHSPublicationNo.[CDC] 93-8395).。

生化类复合质控品适用范围:本产品在临床医学上用于临床检验实验室中生化检测项目的室内质量控制,检测临床化学分析仪测定的准确度和精密度。
具体项目为:α1-酸性糖蛋白(AAG)、丙氨酸氨基转移酶(ALT)、白蛋白(ALB)、碱性磷酸酶(ALP)、α-淀粉酶(AMY)、胰淀粉酶(P-AMY)、载脂蛋白A1(APOA1)、载脂蛋白B (APOB)、抗链球菌溶血素O(ASO)、天门冬氨酸氨基转移酶(AST)、钙(Ca)、C-反应蛋白(CRP)、超敏C-反应蛋白(HS-CRP)、氯(Cl)、胆碱酯酶(CHE)、胆固醇(CHO)、补体C3(C3)、补体C4(C4)、肌酸激酶(CK)、肌酸激酶MB同工酶(CK-MB)、酶法肌酐(CreE)、苦味酸法肌酐(CreK)、重氮盐法直接胆红素(D.Bili)、钒酸盐法直接胆红素(D.Bili)、铁蛋白(Ferritin)、葡萄糖(Glu-GOD)、葡萄糖(Glu-HK)、谷氨酸脱氢酶(GLDH)、γ-谷氨酰基转移酶(GGT)、a-羟丁酸脱氢酶(HBDH)、高密度脂蛋白胆固醇(HDL-C)、结合珠蛋白(HP)、免疫球蛋白A(IgA)、免疫球蛋白G(IgG)、免疫球蛋白M (IgM)、铁(Iron)、乳酸脱氢酶(LDH)、低密度脂蛋白胆固醇(LDL-C)、锂(Li)、脂肪酶(Lip)、镁(Mg)、磷(P)、钾(K)、前白蛋白(PA)、钠(Na)、重氮盐法总胆红素(T.Bili)、钒酸盐法总胆红素(T.Bili)、总蛋白(TP)、转铁蛋白(TF)、甘油三酯(TG)、尿素(Urea)、尿酸(UA)。
1.1规格冻干粉型5mL×1(水平1);3mL×1(水平1);5mL×1(水平2);3mL×1(水平2);5mL×2(水平1,水平2);5mL×6(水平1,水平2);3mL×2(水平1,水平2);3mL×6(水平1,水平2)。

医疗器械产品技术要求编号:糖化血红蛋白分析仪2.性能指标2.1结果报告单位)以 NGSP 单位(%)和 IFCC 单位(mmol/mol)报告。
糖化血红蛋白(HbA1c2.2外观仪器外观应符合下列要求:a)仪器外观整齐、清洁、表面涂、镀层无明显剥落、擦伤、露底及污垢;b)铭牌及标志应清楚,所有紧固件不得松动,各种调节器件转动灵活,功能正常;c)显示器显示字体应清晰。
2.3准确度准确度用参考物质作为样本进行检测,分析仪测定结果的相对偏差应在±8%范围内。
2.4重复性检测样本浓度为 4.0%-6.5%的样本,检测结果的样本变异系数(CV)不大于 3.0%。
2.5线性在糖化血红蛋白 4%-15%范围内,检测结果的线性相关系数 r 值应不小于 0.9900。
2.6稳定性开机稳定后 8h 内,检测同一正常样本,检测结果的相对偏差不大于±3%。
2.7分析仪功能分析仪应具备以下基本功能:a)提供中文报告功能;b)具有异常报警功能。
2.8网络安全2.8.1接口功能1)程序下载2) lis 数据上传2.8.2传输协议<TRANSMIT><M>LD100|XXXX-XX-XX XX:XX|XXXXX</I><R>HbA1c|X.X</R></M></TRANSMIT>2.8.3权限权限为一级权限,登录权限为一级权限。
2.9环境试验仪器环境试验应符合 GB/T 14710-2009 中气候环境试验I 组,机械环境试验Ⅱ组,对电源的适应能力,以及运输试验的要求及表 1 中的规定。
2.10电气安全电气安全应符合 GB4793.1-2007、GB4793.9-2013 和 YY0648-2008 适用条款的要求。
2.11电磁兼容性电磁兼容性应符合 GB/T18268.1-2010 和 GB/T18268.26-2010 适用条款的要求。
生化类复合质控品适用范围:本产品在临床医学上用于临床检验实验室中生化检测项目的室内质量控制,检测临床化学分析仪测定的准确度和精密度。
具体项目为:α1-酸性糖蛋白(AAG)、丙氨酸氨基转移酶(ALT)、白蛋白(ALB)、碱性磷酸酶(ALP)、α-淀粉酶(AMY)、胰淀粉酶(P-AMY)、载脂蛋白A1(APOA1)、载脂蛋白B (APOB)、抗链球菌溶血素O(ASO)、天门冬氨酸氨基转移酶(AST)、钙(Ca)、C-反应蛋白(CRP)、超敏C-反应蛋白(HS-CRP)、氯(Cl)、胆碱酯酶(CHE)、胆固醇(CHO)、补体C3(C3)、补体C4(C4)、肌酸激酶(CK)、肌酸激酶MB同工酶(CK-MB)、酶法肌酐(CreE)、苦味酸法肌酐(CreK)、重氮盐法直接胆红素(D.Bili)、钒酸盐法直接胆红素(D.Bili)、铁蛋白(Ferritin)、葡萄糖(Glu-GOD)、葡萄糖(Glu-HK)、谷氨酸脱氢酶(GLDH)、γ-谷氨酰基转移酶(GGT)、a-羟丁酸脱氢酶(HBDH)、高密度脂蛋白胆固醇(HDL-C)、结合珠蛋白(HP)、免疫球蛋白A(IgA)、免疫球蛋白G(IgG)、免疫球蛋白M (IgM)、铁(Iron)、乳酸脱氢酶(LDH)、低密度脂蛋白胆固醇(LDL-C)、锂(Li)、脂肪酶(Lip)、镁(Mg)、磷(P)、钾(K)、前白蛋白(PA)、钠(Na)、重氮盐法总胆红素(T.Bili)、钒酸盐法总胆红素(T.Bili)、总蛋白(TP)、转铁蛋白(TF)、甘油三酯(TG)、尿素(Urea)、尿酸(UA)。
1.1规格冻干粉型5mL×1(水平1);3mL×1(水平1);5mL×1(水平2);3mL×1(水平2);5mL×2(水平1,水平2);5mL×6(水平1,水平2);3mL×2(水平1,水平2);3mL×6(水平1,水平2)。
生化类复合质控品适用范围:本产品在临床医学上用于临床检验实验室中生化检测项目的室内质量控制,检测临床化学分析仪测定的准确度和精密度。
具体项目为:α1-酸性糖蛋白(AAG)、丙氨酸氨基转移酶(ALT)、白蛋白(ALB)、碱性磷酸酶(ALP)、α-淀粉酶(AMY)、胰淀粉酶(P-AMY)、载脂蛋白A1(APOA1)、载脂蛋白B (APOB)、抗链球菌溶血素O(ASO)、天门冬氨酸氨基转移酶(AST)、钙(Ca)、C-反应蛋白(CRP)、超敏C-反应蛋白(HS-CRP)、氯(Cl)、胆碱酯酶(CHE)、胆固醇(CHO)、补体C3(C3)、补体C4(C4)、肌酸激酶(CK)、肌酸激酶MB同工酶(CK-MB)、酶法肌酐(CreE)、苦味酸法肌酐(CreK)、重氮盐法直接胆红素(D.Bili)、钒酸盐法直接胆红素(D.Bili)、铁蛋白(Ferritin)、葡萄糖(Glu-GOD)、葡萄糖(Glu-HK)、谷氨酸脱氢酶(GLDH)、γ-谷氨酰基转移酶(GGT)、a-羟丁酸脱氢酶(HBDH)、高密度脂蛋白胆固醇(HDL-C)、结合珠蛋白(HP)、免疫球蛋白A(IgA)、免疫球蛋白G(IgG)、免疫球蛋白M (IgM)、铁(Iron)、乳酸脱氢酶(LDH)、低密度脂蛋白胆固醇(LDL-C)、锂(Li)、脂肪酶(Lip)、镁(Mg)、磷(P)、钾(K)、前白蛋白(PA)、钠(Na)、重氮盐法总胆红素(T.Bili)、钒酸盐法总胆红素(T.Bili)、总蛋白(TP)、转铁蛋白(TF)、甘油三酯(TG)、尿素(Urea)、尿酸(UA)。
1.1规格冻干粉型5mL×1(水平1);3mL×1(水平1);5mL×1(水平2);3mL×1(水平2);5mL×2(水平1,水平2);5mL×6(水平1,水平2);3mL×2(水平1,水平2);3mL×6(水平1,水平2)。
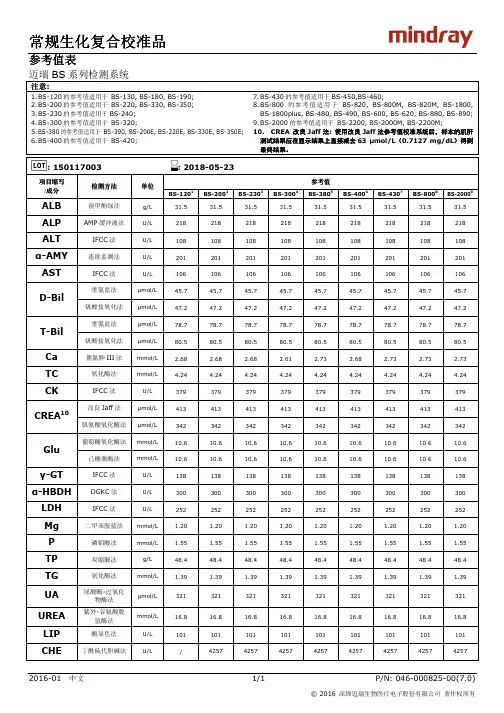
常规生化复合校准品产品技术要求mairui
2 性能指标
2.1外观和性状
2.1.1颜色性状
校准品复溶前应为浅黄色冻干粉末;复溶并混匀后应为清澈浅黄色液体,无沉淀、无悬浮物和絮状物。
2.1.2包装
分装瓶应为棕色硬质玻璃瓶,盖有橡胶瓶内塞和塑料外盖;盒贴、瓶贴、标签标识、说明书应完整、清晰。
橡胶瓶内塞与玻璃配合后应无泄漏;塑料外盖应无明显划痕、崩缺。
2.2装量
每瓶校准品质量(含瓶重)应不少于11g。
2.3溯源性
2.3.1参考值表
校准品应可提供所包含检测项目的参考值表。
2.3.2赋值准确性
经校准品校准的迈瑞BS 系列检测由高一级测量程序定值的参考血清,结果的偏倚应满足表2 要求。
表 1 校准品赋值准确性的允许偏倚范围
2.3.3参考方法及测量不确定度
应提供对校准品进行赋值时采用的参考方法及对应的测量不确定度计算方法。
2.4均一性
2.4.1瓶内均一性
校准品瓶内均一性应不大于表3 的要求(SD 和CV 值满足其一即可)。
表 3 校准品瓶内均一性的指标要求
2.4.2瓶间均一性
校准品瓶间均一性应不大于表4 的要求(SD 和CV 值满足其一即可)。
表 4 校准品瓶间均一性的指标要求
2.5生物安全性
使用国家权威管理机构认可的、且不低于我国法定用于血源筛查体外诊断试剂灵敏度的检测试剂对校准品中HBsAg、HIV 抗体、HCV 抗体、梅毒螺旋体TP 抗体检测应为阴性。
校准品的复溶及校准次数对生化测量系统校准的影响东台市人民医院林素萍臧素纲韩霜周玉贵摘要:目的探讨生化测量系统校准过程中校准品复溶方法及校准次数对校准的影响。
方法校准品的复溶采用称重复溶法、定量移液管法及普通吸管法等三种方法,校准进行单次校准和多次校准取平均值,分别对ALT、AST等十二个项目进行校准和验证试验。
结果定量移液管加样法校准的平均K值与称重加样法校准的平均K值比较接近,普通吸管加样法校准的平均K值与称重加样法校准的平均K值的偏移较大,单次校准的K值之间有明显差异,多次校准的平均K值赋予生化仪进行的验证结果更接近用于被验证的校准品相应项目的靶值。
结论定量移液管复溶法可作为实验室常规复溶方法,同时建议生化测量系统应用多次校准的平均K值进行测量。
关键词:生化测量系统;校准品;校准; 平均K值The influence of dissolving calibrator and calibration times to calibration ofbiochemical measurement systemAbstract: Objective to investigate the influence of dissolving calibrator and calibration times for the biochemical measurement system. Methods respectively dissolving calibrator by three methods with balance weighing mass, volumetric pipette and ordinary straw, calibration ways include single calibration and calculating average after repeatedly calibrating five times, respectively calibrating validation test for twelve items ,such as ALT, AST, etc. Result the average K value of volumetric pipette method is very close to the average K value of balance weighing method, there is obvious difference in the average K value between ordinary straw method and balance weighing method, the K values of calibration are obvious different each time. we give the average value of calibration to the biochemical analyzer , and proceed validation test. We find the results of validation test is more coincide to the target value of the calibrator which manufacturers provided. Conclusion volumetric pipette method can be used as the routine method for dissolving calibrator in laboratory, and we suggest to calculate the average K value of calibration and give the average value of calibration to biochemical measure system.Key words: biochemical measurement system ; calibrator ; calibration; average K value生化分析仪检测结果的准确性直接影响到临床对患者的诊治。
医疗器械产品技术要求编号:多项生化校准品1.产品型号/规格及划分说明1.1规格冻干品,复溶体积:20×5mL;10×5mL;1×5mL;10×1mL;10×2mL。
1.2组成以人血清为基质的多项校准品。
包含项目、产品适用方法以及校准品中目标浓度见表1。
表1组成及范围本产品是以人血清为基质的冻干校准品,该产品包含项目与所对应的北京利德曼生化股份有限公司生产的丙氨酸氨基转移酶(ALT)测定试剂盒(丙氨酸底物法)、白蛋白(ALB)测定试剂盒(溴甲酚绿法)、碱性磷酸酶(ALP)测定试剂盒(NPP底物-AMP缓冲液法)、淀粉酶(AMY)测定试剂盒(GNPG2底物法)、天门冬氨酸氨基转移酶(AST)测定试剂盒(天门冬氨酸底物法)、钙离子(CA)测定试剂盒(偶氮砷Ⅲ法)、肌酸激酶(CK)测定试剂盒(磷酸肌酸底物法)、肌酐(CRE)测定试剂盒(肌氨酸氧化酶法)、总铁结合力(TIBC)测定试剂盒(Ferene法)、γ-谷氨酰基转移酶(GGT)测定试剂盒(GCANA底物法)、葡萄糖(GLU)测定试剂盒(葡萄糖氧化酶法)、高密度脂蛋白胆固醇(HDL)测定试剂盒(直接法-选择抑制法)、乳酸脱氢酶(LDH)测定试剂盒(乳酸底物法)、镁离子(Mg)测定试剂盒(二甲苯胺蓝法)、磷离子(P)测定试剂盒(磷钼酸盐法)、总胆红素(TBIL)测定试剂盒(钒酸盐氧化法)、总胆固醇(TCHO)测定试剂盒(CHOD-POD法)、甘油三酯(TG)测定试剂盒(GPO-PAP法)、总蛋白(TP)测定试剂盒(双缩脲法)、尿酸(UA)测定试剂盒(尿酸酶法)、尿素(Urea)测定试剂盒(尿素酶-谷氨酸脱氢酶法)试剂盒配套使用,用于建立所含项目的工作曲线。
1.4产品储存条件及有效期(体外诊断试剂适用)在(2~8)℃避光保存,有效期为24个月。
2.性能指标2.1外观:冻干品,溶解后为浅黄色至黄色透明液体。
医疗器械产品技术要求编号:
生化复合校准品
2性能指标
2.1外观
2.1.1包装外观
试剂盒的包装应整洁;图案与文字应清晰无误;标签应粘贴端正,无污迹;封盖应紧密,无漏
液。
2.1.2试剂外观
产品校准品LEVEL 1 应为粉色透明液体,LEVEL 2 为蓝色透明液体,LEVEL 3 为无色透明液体、无沉淀和明显悬浮物、絮状物。
2.2试剂装量
试剂每瓶装量应不低于标示量。
2.3均匀性
2.3.1瓶内均匀性
瓶内均匀性应符合表1 的要求。
表 1 瓶内均匀性
2.3.2瓶间均匀性
瓶间均匀性应符合表2 的要求。
表 2 瓶间均匀性
2.4溯源性
2.4.1赋值程序
提供赋值程序文件至少一个批次的赋值记录。
2.4.2校准品的互换性
制造商需提供校准品互换性的技术文件。
2.4.3赋值的准确性
偏倚满足表3 的要求。
表 3 准确度。