脂蛋白(a)校准品产品技术要求senmeixikema
- 格式:docx
- 大小:14.01 KB
- 文档页数:2

载脂蛋白A1、B校准品
适用范围:与北京利德曼生化股份有限公司的载脂蛋白APOA1/B测定试剂盒配套使用,用于建立系统校准曲线。
1.1 规格:1×1mL(冻干品)。
1.2 组成:在血清基质中添加载脂蛋白A1,载脂蛋白B,牛血清(稳定剂)<0.1%。
定值范围:APOA1(1.8~
2.5)g/L,APOB(1.8~2.5)g/L。
2.1 外观:冻干品,溶解后为浅黄色至黄色液体,标签内容清晰。
2.2 溯源性:根据GB/T 21415及有关规定提供校准品的来源、赋值过程及测量不确定度等内容,该校准品溯源至APOA1:参考物质(BCR-393)、APOB:纯品(SunnyLab)。
2.3 准确度
APOA1:用校准品配合试剂检测参考物质(BCR-393),测值与参考物质靶值的相对偏差应在±10%范围内。
APOB:回收率应在85~115%之间。
2.4 重复性:CV<3%。
2.5 含水量:冻干物水分含量<3%。
2.6 稳定性
2.6.1 效期稳定性:按照标签所示存储条件保存,产品有效期为24个月。
在效期满后30天内其中一天检测,其外观、准确度和重复性符合2.1、2.3、2.4要求。
2.6.2 复溶稳定性:复溶后,在(2~8)℃避光密封保存,可稳定2天。
在第3天检测准确度符合2.1、2.3要求,在-20℃避光密封保存可稳定14天,在第15天检测,其外观、准确度和重复性符合2.1、2.3、2.4要求。
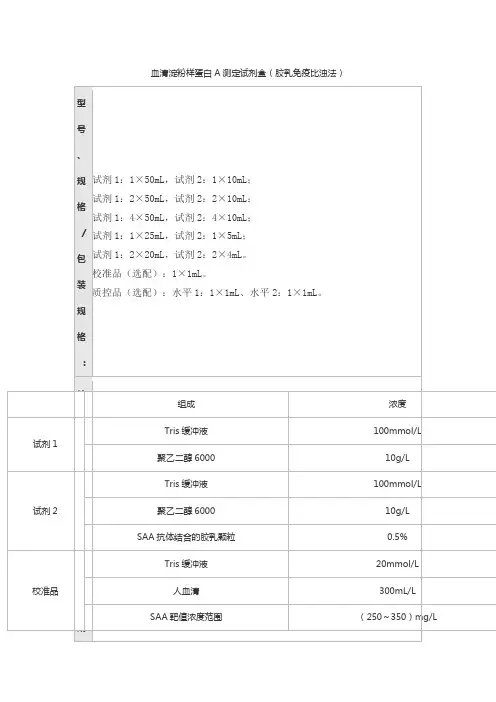

脂蛋白(a)测定试剂盒(免疫比浊法)适用范围:本试剂用于体外定量测定人血清中脂蛋白(a)的浓度。
1.1规格液体双剂型试剂1(R1):70mL×1, 试剂2(R2):10mL×1 , 校准品(4个浓度):1mL×4。
1.2规格划分说明根据净含量和复溶体积划分规格。
1.3主要组成成分试剂盒由试剂(R1)液体、试剂2(R2)液体及校准品冻干粉组成。
1.3.1 试剂1(R1)液体主要组分三羟甲基氨基甲烷(pH 7.5) 10mmol/L1.3.2 试剂2(R2)液体主要组分羊抗人脂蛋白(a)抗体浓度根据效价而定1.3.3 校准品冻干粉主要组分:人血清基质脂蛋白(a)蛋白:40mg/L~720mg/L(4个浓度呈梯度增加,每批定值)2.1 外观试剂盒中各组件的外观应满足:a) 试剂1(R1)应为无色透明溶液,无杂质、无絮状物,外包装完整无破损;b) 试剂2(R2)应为无色或浅黄色透明溶液,无杂质、无絮状物,外包装完整无破损;c)校准品为浅黄色冻干粉,复溶后应为浅黄色透明溶液,无混浊、无未溶解物,外包装完整无破损。
2.2 净含量液体试剂净含量应不少于标示值。
2.3 试剂空白吸光度在波长340nm处(光径1cm),试剂空白吸光度(A)应≤0.200。
2.4 准确度用中生试剂和已上市同类试剂分别测定40个在线性范围内不同浓度的样本,在[100,800]mg/L检测范围内,比对两组数据的相关系数(r)及测值的偏差,要求r≥0.975,相对偏差应不超过±15%。
2.5 分析灵敏度对应于浓度为200mg/L的Lp(a)所引起的其吸光度变化与空白吸光度变化的差值(△A)应在0.010~0.050范围内。
2.6 重复性重复测定高、低浓度样本,变异系数(CV)应≤5%。
2.7 批间差测定血清样本,批间差(R)应≤5%。
2.8 线性范围在[100,800]mg/L范围内,线性相关系数(r)应≥0.990,线性相对偏差应不超过±10%。

脂蛋白a标准脂蛋白 A 是一种与心血管疾病相关的生物标志物。
它是一种由肝脏合成的大型蛋白质,主要负责胆固醇的运输和代谢。
脂蛋白 A 的标准参考值通常是根据血液中脂蛋白 A 的浓度来确定的。
根据美国心脏协会的推荐,成年人的正常参考范围为80-160 mg/dL。
然而,这个范围可以根据个人的年龄、性别、体重、饮食和生活方式等因素而有所变化。
脂蛋白A 的浓度的变化可能与许多因素相关。
一些研究表明,脂蛋白 A 的高水平与心脏疾病的风险增加有关。
因此,许多医生将脂蛋白 A 水平作为判断心血管风险的重要指标。
除了测量总脂蛋白 A 的浓度之外,还可以测量脂蛋白 A 的不同亚型的浓度。
脂蛋白 A 主要分为两种主要亚型:脂蛋白 A1 和脂蛋白 A2。
脂蛋白 A1 是一种大型脂蛋白,与心血管保护相关。
脂蛋白 A2 则是一种小型脂蛋白,与心脏疾病的风险增加有关。
因此,低脂蛋白 A1 和高脂蛋白 A2 的比例可能是心血管疾病风险的一个重要指标。
研究表明,脂蛋白 A1 和脂蛋白 A2 的比例越低,心脏疾病的风险越高。
脂蛋白 A 的水平可以通过多种方法来测量。
常用的方法之一是酶联免疫吸附测定法(ELISA)。
这种方法使用特定的抗体来识别和结合脂蛋白 A,并通过测量与酶标记抗体相结合的物质的光学密度来确定脂蛋白 A 的浓度。
当然,不同的实验室可能使用不同的测量方法,因此,参考值可能有所不同。
总结而言,脂蛋白A 是一种与心血管疾病相关的生物标志物,其浓度的变化可能与心脏疾病的风险增加有关。
脂蛋白 A 的标准参考值通常是根据血液中脂蛋白 A 的浓度来确定的,一般范围为 80-160 mg/dL。
此外,测量脂蛋白 A1 和脂蛋白 A2的比例也可以作为判断心血管疾病风险的一个重要指标。
测量脂蛋白 A 的方法包括酶联免疫吸附测定法,不同实验室可能使用不同方法,导致参考值有所差异。

脂蛋白(a)测定试剂盒(胶乳免疫比浊法)适用范围:用于体外定量测定人血清中脂蛋白(a)的含量。
1.1 包装规格包装规格见表1。
表1 包装规格1.2 主要组成成分主要组成成分见表2。
表2 主要组成成分2.1 外观试剂1为无色澄清液体,目测不得有任何沉淀及絮状悬浮物;试剂2为乳白色悬浊液,目测不得有沉淀;校准品为淡黄色液体,目测不得有沉淀及絮状悬浮物;质控品为淡黄色液体,目测不得有沉淀及絮状悬浮物;试剂盒标签标识清晰,外包装完整无损。
2.2 净含量试剂的净含量应不少于标称量。
2.3 试剂空白吸光度A600nm下测定空白吸光度应≤1.5000。
2.4准确度与已上市产品进行比对试验:在[5,100] mg/dL区间内,相关系数r≥0.975;在[5,40] mg/dL区间内,测定的绝对偏差应不超过±6 mg/dL;在(40,100] mg/dL区间内测定的相对偏差应不超过±15%。
2.5 分析灵敏度样本浓度为20 mg/dL时,其吸光度变化应不小于0.02。
2.6 线性区间在[5,100]mg/dL区间内,线性相关系数r2应≥0.990,在[5,20]mg/dL区间内测定的绝对偏差应≤2mg/dL,在(20,100]mg/dl区间内测定的相对偏差应≤10%。
2.7 测量精密度2.7.1 重复性重复测试浓度在(30±5)mg/dL的血清样本或质控品,所得结果的重复性(变异系数,CV)应不大于4%。
2.7.2 批间差测试浓度在(30±5)mg/dL的血清样本或质控品,批间相对极差(R)应不大于10%。
2.8 质控品赋值有效性使用质控品进行测定,测定结果应在靶值范围内。
2.9 稳定性试剂盒在2℃~8℃密封避光保存,有效期为18个月。
在试剂盒有效期满后一个月以内,应符合2.1、2.4、2.6、2.8的要求。
2.10 校准品溯源性按照GB/T 21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》的要求,试剂盒校准品溯源至国际参考物质IFCC SRM 2B。
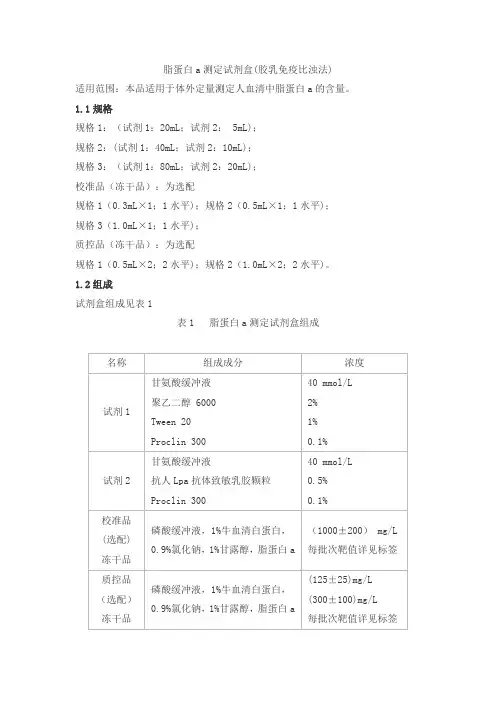
脂蛋白a测定试剂盒(胶乳免疫比浊法)适用范围:本品适用于体外定量测定人血清中脂蛋白a的含量。
1.1规格规格1:(试剂1:20mL;试剂2: 5mL);规格2:(试剂1:40mL;试剂2:10mL);规格3:(试剂1:80mL;试剂2:20mL);校准品(冻干品):为选配规格1(0.3mL×1;1水平);规格2(0.5mL×1;1水平);规格3(1.0mL×1;1水平);质控品(冻干品):为选配规格1(0.5mL×2;2水平);规格2(1.0mL×2;2水平)。
1.2组成试剂盒组成见表1表1 脂蛋白a测定试剂盒组成2.1试剂2.1.1外观试剂盒外观应整洁,文字符号标识清晰;组分齐全,液体无漏液;试剂1为无色透明液体,不得有沉淀和絮状物;试剂2为乳白色液体。
2.1.2装量每瓶不少于标示值。
2.1.3试剂空白吸光度用指定的空白样品测试试剂(盒),在光径1cm下,在A600nm处测定试剂空白吸光度应A≤1.50。
2.1.4分析灵敏度测定在200mg/L的样品,吸光度差值△A≥0.04。
2.1.5线性范围2.1.5.1在[100,1000] mg/L内,相关系数R≥0.990。
2.1.5.2在[100,200] mg/L内,线性绝对偏差不超过±20mg/L;(200,1000] mg/L 内,线性相对偏差不超过±10%。
2.1.6 重复性重复测试(300±100)mg/L样本,所得结果的变异系数(CV%)应不大于4%。
2.1.7批间差测定(300±100)mg/L样本,所得结果的批间相对极差(R)应不大于10%。
2.1.8准确度比对试验:以已上市脂蛋白a试剂盒分析系统作对比,相关系数r不小于0.95,斜率在[0.9,1.1]内,样本浓度在[100,200]mg/L时,绝对偏差不超过40mg/L, 样本浓度在(200,1000]mg/L时,相对偏差偏差不大于20%,符合上述要求的样本数量占总样本量的90%以上。

甘油三酯测定试剂盒(GPO-PAP法) 适用范围:用于体外定量检测人血清中甘油三酯的浓度。
1.1规格a) 4×60mL;b) 1×40mL;c) 4×50mL;d) 2×50mL;e) 4×45mL;f) 4×80mL;g) 5×60mL;h) 3×60mL;i) 2×100mL;j) 8×60mL;k) 12×65mL;l) 12×24mL;m) 3×400mL;n) 10×60mL;o) 2×40ml;p) 3×50ml;q) 6×24mL;r) 1×50ml。
1.2 组成试剂主要组分见表1:表1 试剂主要组分2.1 外观外包装完整无破损,标签清晰;试剂应为淡粉红色澄清液体。
2.2 净含量应不低于试剂瓶标示装量。
2.3 试剂空白在520nm处测定试剂空白吸光度,应<0.2。
2.4 分析灵敏度测定浓度为10mmol/L的样品,吸光度变化(ΔA)应不低于0.11。
2.5 线性2.5.1在[0.2,11.4]mmol/L范围内,线性回归的相关系数应不低于0.990;2.5.2测试浓度[5,11.4]mmol/L的样品,相对偏差应不超过±10%;测试浓度[0.2,5)mmol/L的样品,绝对偏差应不超过±0.5mmol/L。
2.6 重复性2.6.1 批内重复性变异系数(CV)应不超过5%。
2.6.2 批间差对同一份样品进行重复测定,相对极差(R)应不超过10%。
2.7 准确度用国家标准物质对试剂盒进行测试,测定值与标准物质标示值的相对偏差应不超过±10%。
2.8 稳定性原包装试剂在2℃~8℃条件下有效期为18个月,取到效期后6个月内的试剂盒检测,应符合本技术要求2.1、2.3、2.4、2.5、2.6.1、2.7之规定。

脂蛋白(a)测定试剂盒(胶乳免疫比浊法)适用范围:本产品与ABBOTT仪器配套使用,用于体外定量测定人血清中脂蛋白(a)的含量。
1.2 主要组成成分主要组成成分见表2。
2. 性能指标2.1 外观试剂1为无色澄清液体,目测不得有任何沉淀及絮状悬浮物;试剂2为乳白色悬浊液,目测不得有任何沉淀及絮状悬浮物;校准品为淡黄色液体,目测不得有任何沉淀及絮状悬浮物;质控品为淡黄色液体,目测不得有任何沉淀及絮状悬浮物;试剂盒标签标识清晰,外包装完整无损。
2.2 净含量试剂的净含量应不少于标称量。
2.3 试剂空白吸光度A600nm下测定空白吸光度应≤1.5000。
2.4准确度相关系数r≥0.975,在20 mg/dL(含20 mg/dL)范围内测定的偏差应不超过±6 mg/dL,在(20,100 ]mg/dL范围内测定的偏差应不超过±15%。
2.5 分析灵敏度样本浓度为10 mg/dL时,其吸光度变化在0.0100~0.0450之间。
2.6 线性区间在[5.0,100.0]mg/dL区间内,线性相关系数r2应≥0.99,在[5.0,10.0]mg/dL 区间内测定的偏差应不超过±2.0mg/dL,在(10.0,100.0]mg/dL区间内测定的偏差应不超过±10%。
2.7 测量精密度2.7.1 重复性高、低浓度的血清样本或质控品重复测定10次,其测定值的变异系数(CV%)应不大于10%。
2.7.2 批间差随机抽取三批试剂盒的批间相对极差(R)应不大于10%。
2.8 质控品赋值有效性使用质控品进行测定,测定结果应在靶值范围内。
2.9 稳定性试剂盒在2℃~8℃密封避光保存,有效期为18个月。
在试剂盒有效期满后一个月以内,应符合2.1、2.4、2.6、2.8的要求。
2.10 校准品溯源性按《GB/T 21415-2008体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》的要求,试剂盒校准品溯源至国际参考物质IFCC SRM 2B。

载脂蛋白AI(ApoAI)测定试剂盒(免疫比浊法)适用范围:本试剂盒用于体外定量测定人血清中载脂蛋白AI(ApoAI)的浓度。
1.1包装规格1.2主要组成成分试剂1主要组分:TRIS缓冲液 25mmol/l试剂2主要组分:羊抗人ApoAI血清具体浓度依据效价确定校准品冻干粉主要组分:牛血清基质ApoAI 1.50-2.80g/L,批特异,具体浓度见瓶签质控品冻干粉主要组分:牛血清基质ApoAI 水平1:0.60-1.50g/L;水平2:1.00-2.50g/L,批特异,具体浓度见瓶签2.1外观2.1.1试剂1应为无色透明液体,无混浊,无未溶解物。
2.1.2试剂2应为无至淡黄色透明液体,无混浊,无未溶解物。
2.1.3校准品应为无色至淡黄色固体。
2.1.4质控品应为无色至淡黄色固体。
2.2装量液体试剂的净含量应不少于标示值。
2.3试剂空白ApoAI试剂盒在波长(570~630)nm处测定空白样品的吸光度值,应不大于0.5000。
2.4分析灵敏度ApoAI试剂盒测试1.00g/L ApoAI时,吸光度差值(△A)应大于0.1000。
2.5准确度用本公司ApoAI试剂盒和已上市ApoAI试剂盒同时测定不少于40个临床样本,用线性回归方法计算两组结果的线性相关系数(r2)应不小于0.95;样本浓度在[0.35,0.50] g/L范围内时,绝对偏差应不大于±0.10g/L;样本浓度在(0.50,2.50] g/L范围内时,相对偏差应不大于±15%;95%检测样本应符合上述要求。
2.6精密度2.6.1重复性重复测试(1.00±0.50)g/L的样本,所得结果的变异系数CV应不大于3%;2.6.2批间差测试(1.00±0.50)g/L的样本,所得结果的批间相对极差应不大于10%。
2.7线性范围ApoAI试剂盒在(0.35,2.50)g/L范围内,线性相关系数(r)应不小于0.990;在(0.35,1.00]g/L区间内,线性绝对偏差应不超过±0.1g/L;在(1.00,2.50)g/L区间内,线性相对偏差应不超过±10%。

白蛋白测定试剂盒(溴甲酚绿法)适用范围:用于体外定量检测人血清中白蛋白的浓度。
1.1规格a)2×100ml;b)3×60ml;c)3×400ml;d)4×45ml;e)4×50ml;f)4×60ml;g)4×80ml;h)5×60ml;i)10×60ml;j)12×24ml;k)12×65ml;l)1×40ml;m)2×40ml;n)3×50ml;o)1×50ml。
1.2 组成试剂主要组分见表1:表1 试剂主要组分2.1 外观外包装完整无破损,标签清晰;试剂应为黄绿色澄清液体。
2.2 净含量应不低于试剂瓶标示装量。
2.3 试剂空白在630nm处测定试剂空白吸光度,应≤0.5。
2.4 分析灵敏度测定浓度为40g/L的样品,吸光度变化(△A)应不低于0.25。
2.5 线性2.5.1在[5,65]g/L范围内,线性回归的相关系数应不低于0.990;2.5.2测试浓度[20,65]g/L的样品,相对偏差应不超过±10%;测试浓度[5,20)g/L的样品,绝对偏差应不超过±3g/L。
2.6 重复性2.6.1 批内重复性变异系数(CV)应不超过2.0%。
2.6.2 批间差对同一份样品进行重复测定,相对极差(R)应不超过5.0%。
2.7 准确度用国家标准物质对试剂盒进行测试,测定值与标准物质标示值的相对偏差应不超过±6.0%。
2.8 稳定性原包装试剂在2℃~8℃条件下有效期为18个月,取到效期后6个月内的试剂盒检测,应符合本技术要求2.1、2.3、2.4、2.5、2.6.1、2.7之规定。

脂蛋白(a)测定试剂盒(胶乳免疫比浊法)适用范围:用于体外定量测定人血清中脂蛋白(a)的含量。
1.1 规格试剂1:60mL×2,试剂2:12mL×2;试剂1:60mL×5,试剂2:12mL×5;试剂1:60mL×5,试剂2:20mL×5试剂1:60mL×2,试剂2:20mL×2;试剂1:60mL×4,试剂2:15mL×4;试剂1:40mL×2,试剂2:10mL×2;试剂1:4L×1,试剂2:1L×1;试剂1:4L×2,试剂2:1L×2。
1.2 主要组成成分试剂1主要成分:试剂2主要成分:2.1 外观试剂1:无色透明溶液;试剂2:乳白色溶液。
外包装完好、无破损,标签完好、字迹清晰。
2.2 净含量应不低于试剂瓶标示装量。
2.3 试剂空白在600nm处测定试剂空白吸光度,应≤1.5。
2.4 空白限空白限为5mg/L。
2.5 分析灵敏度测试800mg/L的被测物时,吸光度变化(ΔA)应不低于0.05。
2.6 准确度在样品中加入一定体积的标准溶液或纯品,计算回收率,应介于90%-110%之间。
2.7 重复性用高、低两个浓度的样本重复测试,变异系数(CV)应不超过12%。
2.8 线性在[10,1000]mg/L范围内,线性回归的相关系数r应不低于0.990;[10,100]mg/L范围内绝对偏差不超过±15mg/L;(100,1000]mg/L范围内相对偏差不超过±15%。
2.9 批间差用3个不同批号试剂分别测试样本,所得结果相对极差(R)<15%。
2.10 稳定性取在2℃~8℃条件下贮存达到18个月后的试剂进行检测,应符合2.1、2.3、2.4、2.5、2.6、2.7、2.8之规定。
脂蛋白a测定试剂盒(免疫比浊法)
适用范围:本试剂盒用于体外定量测定人体血清中脂蛋白a的含量。
1.1产品型号/规格
1.2产品组成
试剂1:甘氨酸缓冲液50mmol/L。
试剂2:抗体致敏颗粒适量。
2.1 外观
试剂1为无色透明溶液;试剂2为乳白色液体;试剂盒各组分齐全、完整,液体无渗漏,包装标签文字符号清晰牢固不易脱落,外包装完整无破损。
2.2 装量
液体试剂的净含量应不少于标示值。
2.3 试剂空白吸光度
在600nm波长、1cm光径条件下,试剂空白吸光度应不大于0.80。
2.4 分析灵敏度
测定300g/L脂蛋白a时,吸光度变化在0.3578~0.6578范围内。
2.5准确度
采用比对试验,相关系数r2≥0.95,相对偏差应不超过±10%。
2.6 精密度
2.6.1 重复性
用血清样品或质控样品重复测试所得的变异系数(CV)应不大于5.0%。
2.6.2 批间差
试剂(盒)批间相对极差应不大于6.0%。
2.7线性区间
试剂线性在[10,1000]mg/L区间内:
a) 线性相关系数|r|应不小于0.990;
b) [10,100]mg/L区间内,线性绝对偏差应不超过±10U/L;(100,1000]mg/L 区间内,线性相对偏差应不超过±10%。
2.8稳定性
原包装试剂2~8℃避光保存有效期12个月,到效期末进行检验,检验结果应符合2.3、2.5、2.7的要求。
脂蛋白a[Lp(a)]测定试剂盒(胶乳免疫比浊法)1.性能指标1.1外观外观应符合表1要求。
表1 试剂盒内各组成的外观性状1.2装量液体试剂装量要求不低于标示量。
1.3空白限空白限不高于10 mg/L。
1.4试剂空白吸光度试剂空白吸光度应≤0.6。
1.5分析灵敏度测试200mg/L脂蛋白a时,吸光度变差值(△A)应不小于0.05。
1.6线性范围1.6.1 试剂盒在[30,1000] mg/L 区间内:线性相关系数r≥0.990;1.6.2 [ 30,200] mg /L 区间内,线性绝对偏差应不超过±20 mg/L;(200,1000] mg /L 区间内,线性相对偏差应不超过±10% 。
1.7精密度1.7.1重复性重复测试(300±100)mg/L 的控制物质,所得结果的变异系数(CV)应≤4%。
1.7.2批间差重复测试(300±100)mg/L 的控制物质,所得结果的批间相对极差(R)应≤10%。
1.8准确度相对偏差应不超过±10% 。
1.9分析特异性当抗坏血酸≤50 mg/dL、胆红素≤20 mg/dL、血红蛋白≤500 mg/dL、脂肪乳剂≤1%时,对试剂检测结果的偏差影响在±10% 以内。
1.10量值溯源应明确分析物的量值溯源。
1.11校准品赋值结果及其不确定度的表示方式应使用规范的表示方式,主要表示方式可选择:a)赋值结果±扩展不确定度;b)赋值结果,扩展不确定度。
1.12校准品正确度≤1。
量值传递的正确度应符合E n1.13质控品可接受区间应给出建议的可接受区间及其确定的程序,应符合下列要求:a)可接受区间宜考虑医学决定水平或测量区间内适宜的浓度点;b)可接受区间应随规定的测量系统(试剂和仪器)一并给出;c)估计可接受区间所进行的实验次数,重复次数及评估的时限;d)估计可接受区间所用的统计方法,包括包含概率;e)可接受区间估计时的平均值与标称值(目标值)之间偏差应不超过±10%;f)在声称测量系统上的测量结果应在其可接受区间内。
脂蛋白(a)的正常标准在10-140mmol/L(0-300mg/L)。
脂蛋白(a)主要在肝脏合成,主要的生理功能是阻止血管内血块溶解,病理上可促进动脉粥样硬化形成。
该指标的增高和降低均代表不同的意义。
1、脂蛋白(a)增高:可见于动脉粥样硬化性心脑血管疾病、急性心肌梗死、家族性高胆固醇血症、先天性高脂蛋白血症、糖尿病、大动脉瘤及某些癌症等。
脂蛋白(a)持续升高与心绞痛、心肌梗死、脑出血有密切关系,是脑卒中和冠状动脉粥样硬化性心脏病的独立危险因子。
2、脂蛋白(a)降低:可见于先天性脂蛋白(a)缺乏、肝脏疾病、酗酒、摄入新霉素等药物后。
医疗器械产品技术要求编号:
脂蛋白a(L p(a))测定试剂(盒)(乳胶增强比浊法)
2.性能指标
2.1外观
试剂应为乳白色的液体,无沉淀、悬浮物和絮状物。
2.2净含量
试剂装量的装量应按表 2,液体装量的最大允许负偏差应为 5%。
表 2 净含量
2.3试剂空白吸光度
试剂(盒)以纯化水为空白在 37 ℃±1℃ 、600 nm 波长、1 cm 光径条件下,试剂空白吸光度应≤0.60。
2.4分析灵敏度
试剂(盒)测试 132 mg/L 的被测物时,吸光度变化(ΔA)应在 0.200~0.400 的范围内。
2.5线性范围
试剂(盒)在(0~1000) mg/L范围内的分析性能应符合如下要求:
a)线性相关系数r≥0.990;
b)(0~50) mg/L 范围内,线性绝对偏差应在±5 mg/L以内;(50~1000) mg/L 范围内,
线性相对偏差应在±10%以内。
2.6测量精密度
2.6.1重复性
用校准品重复测试所得结果的变异系数CV≤4%。
2.6.2批间差
试剂(盒)批间相对偏差R≤6%。
2.7准确度
校准品的相对偏差 B 在±10%以内。
2.8分析特异性
血红蛋白浓度在 500 mg/dL 内、甘油三酯浓度在 500 mg/dL 内、胆红素浓度在 40 mg/dL 内,对试剂检测结果的偏差影响应在±10%以内。
医疗器械产品技术要求编号:
脂蛋白(a)[Lp(a)]测定试剂盒(胶乳增强免疫比浊法)
1.性能指标
1.1外观
1.1.1试剂盒各组分应齐全,内外包装均应完整,液体组分应无渗漏,包装标签文字符
号应清晰。
1.1.2R1应为无色澄清均一液体;R2应为乳白色浑浊均一液体。
1.2装量
各组分的液体装量应不少于标示值。
1.3试剂空白吸光度
试剂以生理盐水为空白在37℃±1℃,600 nm波长条件下,试剂空白吸光度应不大于1.200。
1.4分析灵敏度
测试浓度为200.0 mg/L的样本,吸光度差值应不小于0.040。
1.5线性区间
试剂线性区间应覆盖[5.0,1000.0] mg/L,
a)线性相关系数(r)应不小于0.990;
b)[5.0,200.0] mg/L区间内,线性的绝对偏差应不超过±20.0 mg/L;在
(200.0,1000.0] mg/L区间内,线性的相对偏差应不超过±10.0%。
1.6精密度
1.6.1重复性
重复测试(300.0±100.0)mg/L和(500.0±100.0)mg/L的血清样本,所得结果的重复性(变异系数,CV)应不大于4.0%。
1.6.2批间差
重复测试(300.0±100.0)mg/L和(500.0±100.0)mg/L的血清样本,所得结果的批间差(相对极差,R)应不大于10.0%。
1.7准确度
相对偏差应在±15.0%范围内。
脂蛋白(a)校准品
适用范围:与本公司生产的试剂盒配套使用,用于脂蛋白(a)检测系统的校准。
1.1包装规格
2×1mL。
1.2主要组成成分
本产品状态为冻干粉末,是以人血清为基质,含脂蛋白(a)。主要组分见表1:
表1主要组成成分
组成 浓度
Tris缓冲液 0.02mol/L
血清 100mL/L
Proclin300 0.05mL/L
脂蛋白(a)靶值浓度范围 800~1200mg/L
校准品靶值批特异,详见说明书。
2.1外观和性状
2.1.1各组分应齐全、完整、无渗漏;外包装完好、无破损,标签完好、字迹清
晰。
2.1.2开封前应为白色或淡黄色冻干粉。
2.1.3复溶后应为浅黄色溶液,无浑浊,无未溶解物。
2.2准确度
做样品比对,待测系统与比对系统相关系数(r)应不小于0.975;在[150,
1000]mg/L区间内,相对偏差应不超过±15%;在[10,150)mg/L区间内,绝对偏
差应不超过±22.5mg/L。
2.3重复性
变异系数(CV)应不超过10%。
2.4批内瓶间差
变异系数(CV)应不超过10%。
2.5量值溯源
根据GB/T 21415-2008《体外诊断医疗器械 生物样品中量的测量 校准品和控制
物质赋值的计量学溯源性》及有关规定提供校准品的来源、赋值过程及测量不确
定度等内容,本公司脂蛋白(a)校准品溯源至公司内部工作校准品,并与已上
市产品比对赋值。
2.6稳定性
2.6.1复溶稳定性
复溶后的校准品在2℃~8℃条件下密闭保存,可以稳定2天,应符合2.2、2.3
之规定。
复溶后的校准品在-20℃密闭保存,可以稳定15天,应符合2.2、2.3之规定。
2.6.2效期稳定性
该产品在2℃~8℃条件下密闭贮存有效期为24个月,取效期末的产品进行检测,
应符合2.2、2.3之规定。