锡和几种锡的化合物的性质
- 格式:doc
- 大小:10.50 KB
- 文档页数:1


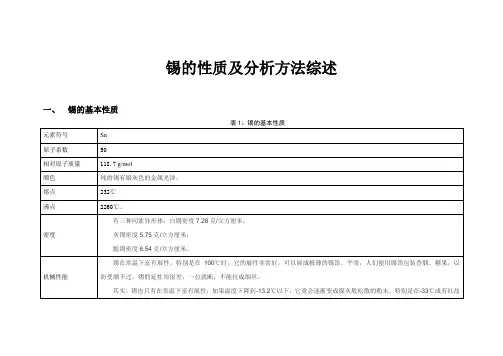
锡的介绍元素序号:50元素符号:Sn元素名称:锡元素原子量:118.7元素类型:金属发现过程:在古代,锡是人类应用于生产和生活方面最早的金属之一,是青铜合金的主要组成。
元素描述:有白锡和灰锡、脆锡三种同素异形体。
常见的是白锡。
呈银白色。
富有展性,在温度低于0℃时,可转变为粉末状的灰锡。
密度:白锡7.28克/厘米3。
灰锡5.75克/厘米3,脆锡6.52~6.56克/厘米3。
熔点:灰锡231.9861℃,白锡231.88℃,脆锡231.89℃。
沸点:灰锡2270℃,白锡2260℃,脆锡2260℃。
化合价是+2和+4。
电离能7.344电子伏特。
锡与强酸和强碱都可发生反应。
在空气中可形成一层二氧化锡的保护层。
热的和浓的卤素酸均可侵蚀它。
热硫酸,尤其是在氧化剂存在的情况下,使锡溶解。
在高温下,浓硝酸对锡的侵蚀作用大。
不与氢氧化铵和碳酸钠的稀溶液发生作用。
元素来源:主要矿物是锡石,将杂质除去,放于反射炉内,用碳还原可得粗制品,再经加热重熔净化或用电解精制。
元素用途:最重要的用途是贮存食品的镀锡钢制容器。
也用来底铁和铜。
镀锡的铁片,叫做马口铁。
锡的化学品和化合物,不论是无机的还是有机的均广泛用于电镀、陶瓷和塑料工业中。
二价锡的化合物,如二氧化锡可作还原剂。
元素辅助资料:锡的熔点比铜低。
在自然界多以锡石SnO2的矿物形式存在,古代人们在矿石中取得铜差不多时期就取得了锡。
可是,锡比铜还软,而且不结实,是不宜制作物件的。
只有把锡掺在铜里,使它们成为合金——青铜,才变的坚硬起来。
假如把锡的硬度定为5,那么铜的硬度就是30,而青铜的硬度则是100-150。
(有关青铜的详细资料参见铜的辅助材料。
)锡的拉丁名STANNUM和元素符号Sn,一说来自梵文STHAS,是坚硬的意思。
另一说来自STANNINE(黄锡矿)。
锡性质一元素符号Sn,原子序数50,相对原子质量118.69。
锡有白锡、灰锡和脆锡三种变体。
常见的白锡是银白色的金属,密度7.31g/cm3,熔点231.86℃,沸点2270℃,软而富有展性。
锡的性质及分析方法综述一、锡的基本性质锡精矿熔炼(粗炼)方法主要有两段熔炼法、还原熔炼-烟化挥发法和烟化富集-还原熔炼法三种。
具体如下:(1)两段熔炼法。
是锡冶炼的传统方法,锡精矿先在较低温度和弱还原条件下熔炼(一次熔炼),得到较纯的粗锡和含锡较高的富渣。
富渣在较高温度和强还原条件下进行二次熔炼,产出硬头和贫锡渣。
硬头为富渣中的一部分铁在强还原条件下与锡同时还原产出的锡-铁合金(成分波动较大,一般含锡约50%,含铁约40%),返回一次熔炼,以回收其中的锡。
贫锡渣通常废弃。
两段熔炼法的优点是过程简单,缺点是锡和铁在生产过程中循环。
此法仅适于处理含铁低的高品位锡精矿(图1)。
(2)还原熔炼-烟化挥发法。
为了避免铁在生产过程中循环,对含铁较高的锡精矿,一般采用富渣烟化炉硫化挥发,以代替两段熔炼中的二次熔炼。
烟化挥发产出的不是硬头而是含锡较高的挥发烟尘。
烟尘返回精矿还原熔炼。
此法适于中等品位锡精矿(图2)。
(3)烟化富集-还原熔炼法。
适于处理低品位锡精矿或锡中矿,其原则工艺流程见图3。
烟化富集能使低锡矿料中的锡和多种有价元素富集于挥发烟尘中,大量的脉石成分则造渣与主金属分离。
二、锡的试样分解方法目前,常用的锡试样分解方法是氧化镁半熔法和酸溶法。
三、锡的分离、富集方法四、锡的测定方法及干扰五、应用生产锡的主要原料是锡精矿和锡矿石。
针对锡精矿和锡矿石的测定,结合仪器设备能力,一般可按如下方法进行:1.固体样品中锡的测定:前处理:1)锡精矿: 试料以盐酸、氯酸钾分解,以氯化物形式挥发除砷。
在乙二胺四乙酸二钠存在下,以氢氧化铍作载体,用氨水使锡沉淀,与铜、钨、锑、铋、等元素分离。
灰化沉淀,以锌粉-硼砂-硼酸熔融,盐酸浸去,用铁粉和铝粒将锡还原为二价。
2)锡矿石:试料用过氧化钠熔融,水浸去,在盐酸介质中,用铝片将锡(Ⅳ)还原为锡(Ⅱ)。
测定方法:碘量法2.液体样品中锡的测定:前处理:1)直接酸化法:适合基体简单的试样,硫酸含量小于2%对ICP测定无影响。

锡及有机锡化合物
锡是一种广泛应用的金属元素,其化合物具有多种应用和性质。
有机锡化合物是含有键合锡原子的有机分子,具有广泛的应用,例如在制备橡胶、塑料、农药和医药等工业中。
此外,有机锡化合物还具有抗菌、抗真菌、杀虫和防水等性质,因此在医药和农业领域也有着广泛的应用。
然而,由于其毒性和环境影响,有机锡化合物的使用受到了限制。
因此,在研究中需要考虑它们的环境影响和生物毒性,并寻找更环保和安全的替代品。
本文将介绍锡和有机锡化合物的基本性质、应用和毒性,以及目前的研究进展和未来的研究方向。
- 1 -。

锡的主要成分
锡是一种常见的金属元素,其化学符号为Sn,原子序数为50。
锡是一种软质、延展性强的金属,常见的形态为银白色固体。
锡在自然界中以氧化物的形式存在,主要矿石有锡石和锡砂。
锡是一种重要的工业原料,具有广泛的应用。
首先,锡具有良好的耐腐蚀性能,可以用于制造化学装置、食品容器等。
其次,锡具有低熔点和良好的可焊性,因此广泛应用于焊接材料和电子器件的制造。
此外,锡还可以用于制备合金,如青铜、白铜等,这些合金具有优异的力学性能和耐磨性,常用于制造轴承、齿轮等零部件。
锡也是一种重要的冶金原料。
通过冶炼锡石或锡砂可以得到精锡,精锡是制造锡合金和电子器件的重要原料。
此外,锡还可以用于电镀、化学分析等领域。
锡的化合物也具有一定的应用价值,如四氯化锡可用于染料、催化剂等的制备。
锡在人类历史中有着重要的地位。
早在古代,人们就发现锡的特殊性质,开始使用锡制作器皿和器具。
在古代文明中,锡被广泛应用于铜器制造和青铜制作。
随着科学技术的进步和工业化的发展,锡的应用范围越来越广泛,对人类社会的进步起到了重要作用。
总的来说,锡作为一种重要的金属元素,具有广泛的应用领域和重要的经济价值。
锡的主要成分为锡石和锡砂,通过冶炼可以得到精锡,精锡被广泛用于制造锡合金和电子器件。
锡在人类历史中有着
悠久的应用历史,对人类社会的进步做出了重要贡献。

锡的性质锡是一种银白色金属,熔点231.9℃,密度为7.3克/厘米3。
锡有三种同素异形体,即灰锡(α——锡)、白锡(β——锡)和脆锡(γ——锡)。
常见的是呈银白色的金属——白锡,在13.2-161℃温度间稳定。
低于13.2℃,白锡开始转变为粉状的灰锡,其转变速度随温度的下九而加快。
当冷至-30℃时,达到最大的转变速度。
当温度高于161℃时,白锡转为脆锡,直至达到熔点(231.9℃)全部呈液态。
灰锡的密度为5.85克/厘米3,白锡密度为7.2克/厘米3,液体锡箔的密度为6.98克/厘米3。
常温下锡在空气中稳定,其原因是锡表面生成一层致密的氧化物薄膜,阻止进一步氧化。
锡的展性好而延展性差,因此能制成很薄的锡箔而不能拉成锡丝。
目前,炼锡的原料主要是锡石(SnO2)。
锡石通过还原熔炼、精炼等工艺过程,可以得到金属锡。
锡的用途锡富展性,塑性好,可以轧制成0.04毫米以下的锡箔。
纯锡与弱有机酸作用缓慢,耐蚀性好,即使被腐蚀,所生成的化合物一般无毒,故大量作热镀锡生产马口铁,用于防腐蚀或食品工业中。
锡基轴承合金(巴比特)是优良的耐磨材料,它有低的摩擦系数和良好的韧性、导热性和耐蚀性。
锡还能配制成易熔合金、焊锡、印刷合金、锡青铜和含锡黄铜等。
含锡钛基合金用于航空、造船、原子能、化工和医疗器械等工业部门。
锡铌金属间化合物可作超导体。
锡的重要化合物二氧化锡、四氯化锡及锡的有机化合物,分别用作陶瓷釉原料、印染丝织品煤染剂,也可用作杀虫剂、防污剂、木材防腐剂和火焰遏制剂等。
锡的“冻疮”冬天,天寒地冻,人们的手、脚生冻疮。
然而锡也会生“冻疮”。
锡生“冻疮”的原因是:金属锡在低温时就崩碎成粉末,象疫病一样传染漫延,使锡制品整个遭受破坏。
因此,人们把这种现象称为“锡疫”,也说锡生“冻疮”。
锡生“冻疮”,还会造成重大损失呢!七十多年前,有人乘飞机到南极探险,由于飞机的油箱是用锡焊接的,在千里冰封的南极严寒里,焊锡竞变成粉末状灰锡,使油箱里的汽油漏光,结果飞机失去燃料,不幸坠落失事。

与锡有关的化学方程式锡是一种常见的金属元素,化学符号为Sn,原子序数为50。
它位于碳和锗之间的元素周期表中的第四周期,属于p-块元素。
锡具有低熔点、良好的延展性和可塑性,因此在工业上具有广泛的应用。
在化学方程式中,锡可以与其他元素或化合物发生各种反应。
下面将介绍几个与锡有关的化学方程式,并对其进行解释。
1. 锡与氧气反应:2Sn + O2 → 2SnO这是锡与氧气发生的燃烧反应。
在高温下,锡与氧气反应生成二氧化锡。
二氧化锡是一种白色固体,常用于制造陶瓷和玻璃。
2. 锡与盐酸反应:Sn + 2HCl → SnCl2 + H2这是锡与盐酸反应的方程式。
在酸性条件下,锡与盐酸反应生成氯化亚锡和氢气。
氯化亚锡是一种无色固体,常用于制备其他锡化合物。
3. 锡与硝酸反应:3Sn + 4HNO3 → 3SnO2 + 4NO + 2H2O这是锡与硝酸反应的方程式。
在浓硝酸存在下,锡与硝酸反应生成二氧化锡、一氧化氮和水。
二氧化锡是一种白色固体,一氧化氮是一种无色气体,常用于制备氮化锡。
4. 锡与硫酸反应:Sn + H2SO4 → SnSO4 + H2这是锡与硫酸反应的方程式。
在酸性条件下,锡与硫酸反应生成硫酸亚锡和氢气。
硫酸亚锡是一种无色固体,常用于制备其他锡化合物。
5. 锡与氯气反应:Sn + Cl2 → SnCl4这是锡与氯气反应生成四氯化锡的方程式。
在高温下,锡与氯气反应生成四氯化锡。
四氯化锡是一种无色液体,常用于制备其他锡化合物。
6. 锡与硫反应:Sn + S → SnS这是锡与硫反应生成硫化锡的方程式。
在高温下,锡与硫反应生成硫化锡。
硫化锡是一种黑色固体,常用于制备锡合金和涂层材料。
除了以上几个例子,锡还可以与许多其他物质发生反应,例如与氢氧化钠反应生成氢氧化锡、与氢氧化铝反应生成氢氧化亚锡等等。
这些反应展示了锡的化学性质和与其他物质之间的相互作用。
总结起来,锡与氧气、酸类、硫、氯气等物质的反应产生了各种不同的化合物。

立志当早,存高远锡的性质和用途锡的发现和使用可以追溯到史前,对人类文明起过促进作用的“青铜”时代,就是以锡铜合金青铜的使用为标志的。
锡为银白色金属,元素符号Sn,在元素周期表中属ⅣA 族,原子序50,原子量118.69。
锡在13.2~161℃时为β锡(白锡),属四方品系。
13.2℃以下为α锡(灰锡),属等轴晶系。
161℃以上为γ锡(脆锡),属斜方晶系,赤热时,锡迅速氧化并挥发。
锡的化学价为+2 和+4。
锡的物理常数为:密度,克/厘米3:β锡7.31(20℃),α锡5.75(13.2℃);熔点231.968℃;沸点2270℃,比热,β锡221.90(25℃)焦/千克•开,α锡2135.268 焦/千克•开。
纯锡化学性质比较稳定,不易氧化,长期与空气接触形成致密氧化膜,使氧化过程不再向深部发展。
利用这一性质,锡常用于制造镀锡薄板(马口铁),可作食品包装材料。
锡延展性好,易于加工,常加工成管、箔、丝、条和各种精制的器皿。
锡几乎可与所有的金属形成合金,其中主要有焊锡、锡青铜、巴氏合金、铅锡轴承合金、印刷合金等。
此外,钛基合金、铌锡合金和锡银汞合金等在原子能工业、航空工业、超导材料和医疗方面均有各自的用途。
锡的化合物中主要的是二氧化锡(SnO3),其次为四氯化锡(SnCl4,氯化亚锡(SnCl2)和锡的有机化合物。
这些化合物分别可作瓷釉的原料、印染工业的媒染剂、塑料的热稳定剂以及杀虫剂和杀菌剂等。
据统计,目前锡的主要用途和所占比例列于下表。
世界锡的消耗比例表种类马口铁焊料巴氏合金。

【中文名称】锡酸钠【英文名称】sodium stannate 锡酸钠【结构或分子式】Na2SnO3·3H2O【分子量】266.73【CAS号】12209-98-2【性状】白色至浅褐色晶体【溶解情况】溶于水,不溶于乙醇、丙酮。
【用途】可用作纺织品的防火剂、增重剂和媒染剂,也可用于制玻璃、陶瓷,碱性镀锡和镀酮锡合金、锌锡合金等。
【制备或来源】由锡与氢氧化钠、硝酸钠灼烧共熔,或由锡与氰酸钠溶液共沸而制得。
【其他】加热至140℃时失去结晶水。
在空气中易吸收水分和二氧化碳而分解为氢氧化锡和碳酸钠,因而水溶液呈碱性。
化学性质无色六角板状结晶或白色粉末。
溶于水,不溶于醇和丙酮。
加热至140℃时失去结晶水而成无水物。
在空气中吸收二氧化碳而成碳酸钠和氢氧化锡。
熔点140°C近年来,世界上用于生产无机锡化合物的金属锡,年耗量在8000吨以上。
用途广泛,需求量逐渐增大。
据统计,1980年世界上各种无机锡化合物的年消耗量约1.355万吨,1986年增加到1.6万吨,至90年代消耗量已达2.5万吨,广泛用于锡及合金电镀、陶瓷釉及颜料、催化剂、玻璃等工业生产(详见表1-18)。
主要有锡的氧化物、锡的氯化物、锡的硫化物、锡酸盐等。
(1) 锡的氧化物1) 氧化亚锡(SnO)氧化亚锡是一种稳定的具有高度金属光泽的兰黑的结晶物。
主要用作还原剂,•还用于电镀工业、玻璃工业及某些亚锡盐的制造,一般是将它作为制造其它锡化合物的中间物料使用;在制造Au/Sn和Cu/Sn红宝石玻璃的玻璃工业中也少不了它的作用。
据统计数据表明,近年来随着国际经济的迅速发展,对SnO的需求逐步增大。
目前国内外的SnO年耗量为400吨,市场前景是乐观的。
2) 二氧化锡(SnO2)二氧化锡是一种特殊的多种用途的产品,其制造方法有火法(气化法)和湿法二种。
主要用于锡盐的制造;电子、陶瓷工业;有机聚合物的阻燃剂;大理石等磨光剂;织物媒染剂和增重剂等。


化学元素锡
锡是化学元素,原子序数为50,化学符号为Sn。
它属于碱土金属的第14族元素。
以下是关于锡的一些基本信息:
1. 物理性质:
- 锡是一种银白色的金属,在常温下呈现出柔软的特性。
- 它的熔点相对较低,约为232摄氏度(449华氏度),而沸点约为2,602摄氏度(4,716华氏度)。
- 锡具有良好的延展性和可塑性,可以被轻松地压制成薄板或拉伸成细线。
- 在空气中稳定,但会受到强酸和浓碱的影响。
2. 化学性质:
- 锡是一种相对不活泼的金属,通常以+2和+4的价态存在。
- 它可以与许多非金属形成化合物,如氧化物、硫化物和卤化物。
- 锡可以通过加热和还原反应从其矿石中提取出来,并且在工业上广泛用于制造各种合金,如青铜和钎料。
- 锡也广泛用于制造罐头、管道和电子器件等应用领域。
3. 常见化合物:
- 氧化锡(SnO)和氧化二锡(SnO2)是最常见的锡化合物,具有重要的应用。
- 锡酸盐、硫酸锡和氯化锡等也是一些常见的锡化合物。
整体而言,锡是一种重要的金属元素,在工业、科研和其他领域都扮演着重要的角色。
系列二 主族金属专题6 锡及其化合物一、锡单质(1)锡有三种同素异形体,他们之间的转化关系为灰锡(α锡),白锡(β锡)、脆锡。
锡制品是白锡的制成,但是长期处于低温会毀坏,这是β锡转变为α锡的缘故,这一现象叫做锡瘟,灰锡是粉末状,β锡在低于13.6℃转变为α锡,α锡本身就是这类反应的催化剂。
(2)锡是两性金属,与稀盐酸缓慢作用,与浓盐酸在加热条件下反应加快:Sn+2HCl(浓)=====△SnCl 2+H 2↑,与氢氧化钠反应生成亚锡酸钠和氢气:Sn+2NaOH=====Na 2SnO 2+H 2↑(3)冶炼锡时,以锡石SnO 2为原料,以焦炭为还原剂,在高温下可制得粗锡:SnO 2 + C=====高温Sn+2CO ,粗锡经电解精练可得纯锡。
二、氧化物(4)二氧化锡是锡最重要的化合物,是锡石的主要成分。
它不溶于水,也难溶于酸或碱的水溶液,但与NaOH 或Na 2CO 3和S 共熔,可转变为可溶性的盐:SnO 2 + 2NaOH=====Na 2SnO 3 (锡酸钠)+ H 2O ,SnO 2 + 2Na 2CO 3 + 4S=====Na 2SnS 3(硫代锡酸钠) + Na 2SO 4 + 2CO 2↑三、氢氧化物(5)氢氧化锡是两性氢氧化物,既可溶于酸又可溶于Sn(OH)2+2HCl=====SnCl 2 +2H 2O ,Sn(OH)2+2NaOH=====Na 2SnO 2 +2H 2O.四、锡盐(6)Sn 2+与Sn 4+均易水解:SnCl 2+H 2O=====Sn(OH)Cl(白色)+HCl ;SnCl 4+4H 2O=====Sn(OH)4↓+4HCl ;故配制SnCl 2溶液要使用盐酸,抑制Sn 2+水解;Sn 2+在空气中被氧气氧化:2Sn 2++O 2+4H +=====2Sn 4++2H 2O ,要加入单质Sn ,防止Sn 2+被氧化,这一点与Fe 2+相似。
【习题1】灰锡(以粉末状存在)和白锡是锡的两种同素异形体。
锡的还原方法一、前言锡是一种常见的金属元素,具有良好的导电性和可塑性,被广泛应用于电子、机械、化工等领域。
而锡的还原方法,是将锡化合物还原成纯净的金属锡的过程。
本文将详细介绍锡的还原方法。
二、锡化合物锡可以形成多种化合物,其中最常见的是氧化锡和氯化锡。
氧化锡分为二氧化锡(SnO2)和三氧化二锡(SnO)。
氯化锡分为四氯化锡(SnCl4)和二氯化亚锡(SnCl2)。
在还原过程中,需要根据所选用的还原剂选择相应的化合物。
三、还原剂在进行还原反应时,需要使用一定量的还原剂。
常见的还原剂有金属铝、金属钠、金属镁等。
本文以金属铝为例进行介绍。
四、反应条件进行还原反应时,需要注意以下条件:1.温度:反应温度通常在200-400℃之间。
2.压力:反应压力通常为大气压或稍高于大气压。
3.时间:反应时间通常为数小时至数十小时不等。
4.反应容器:反应容器需要具有耐高温、耐腐蚀的性质。
五、锡的还原方法1.锡化合物的选择根据所选用的还原剂选择相应的锡化合物。
如果使用金属铝作为还原剂,则选择氧化锡作为反应物。
2.反应前处理将所选用的锡化合物粉末放入干燥器中进行干燥处理,以去除其中的水分和杂质。
3.反应装置在反应容器中加入所选用的锡化合物和金属铝,并密封好反应容器。
4.加热反应将密封好的反应容器置于高温炉中,进行加热。
温度通常在200-400℃之间。
在加热过程中,金属铝逐渐被氧化成为Al2O3,并释放出大量的热量,促进了氧化锡和金属铝之间的还原反应。
5.冷却处理待反应结束后,将反应容器从高温炉中取出,并进行冷却处理。
此时已经生成了纯净的金属锡。
六、结论通过以上步骤,可以得到纯净的金属锡。
在进行实验时,需要注意反应条件的控制,以保证反应的顺利进行。
此外,在还原过程中,还需要注意安全问题,避免发生意外事故。
纯净的锡的熔点是232℃,沸点为2271℃,在600~1050℃的温度范围内锡具有较低的熔点和较高的沸点,较低的饱和蒸汽压,同时还具有较大的密度和容易还原的性质,以及锡液与玻璃液之间具有较大的浸润角(175°)几乎完全不浸润等性质,锡用来作为玻璃成形的良好载体。
氧化锡SnO2,密度6.7~7.0g/cm3,熔点2000℃,高温时的蒸汽压非常小,不溶于锡液,正常生产时在锡槽的温度条件下为固体,往往以浮渣形式出现在低温区的液面上,通常浮渣都聚集在靠近出口端。
如果氧化严重,浮渣会延伸很长,容易形成玻璃板下表面划伤。
氧化亚锡SnO,熔点为1040℃,沸点为1425℃,固体为蓝黑色粉末,能溶解于锡液中,SnO的分子一般为其聚合物(SnO)x形式。
在中性气氛中SnO只有在1040℃以上才是稳定的,1040℃以下会发生分解反应。
在锡槽的还原性气氛中SnO可以存在,它往往溶解于锡液中和以蒸汽形式存在于气氛中。
硫化亚锡SnS,密度5.27g/cm3,固体为蓝色晶体,熔点为865℃,沸点为1280℃,具有较大的蒸汽压,800℃时为81.3Pa,正常生产时,在高温区易挥发进入气氛,低温区易凝聚滴落。