高中化学专题复习-氮元素及其化合物高品质版
- 格式:ppt
- 大小:596.50 KB
- 文档页数:27


氮元素及其化合物复习要点
氮元素是化学元素周期表中的第七元素,原子序数为7,原子量为
14.007、氮元素的原子结构是1s²2s²2p³,其中有5个价电子。
氮元素在
常温下是一种无色、无味、无毒的气体,密度比空气小,不易溶于水。
氮元素的化合价主要有+3、+2、+1和-3四价态。
其中,氮元素形成
3个共价键的化合物被称为三价氮化合物,如三氯化氮(NCl₃);形成2
个共价键的化合物被称为二价氮化合物,如一氧化二氮(N₂O);形成1
个共价键的化合物被称为一价氮化合物,如氨(NH₃);形成3个孤对电
子的化合物被称为氮化物,如氮气(N₂)。
氮元素还可以形成与氢原子的化合物,如氨。
氨是一种无色气体,有
刺激性气味,可溶于水,并能与水形成氢键。
氨广泛用于制造化肥、合成
塑料和清洁剂等。
氨还可以与酸溶液反应形成盐,如氯化铵(NH₄Cl)。
氮元素还可以形成与卤素元素的化合物,如三氯化氮和三碘化氮。
三
氯化氮是一种黄色液体,具有剧毒性,可用于制造有机合成反应中的氯化剂。
三碘化氮是一种红棕色晶体,稳定性较差,放置时间较长会发生爆炸。
此外,氮元素也可以形成与金属元素的化合物,如铵盐。
铵盐是一种
含有NH₄⁺离子的化合物,常见的铵盐有硝酸铵(NH₄NO₃)和硫酸铵((NH₄)₂SO₄)。
这些化合物在农业中广泛应用为肥料,以补充土壤中的氮元素。
总之,氮元素及其化合物在生活中和工业中都有很多重要的应用。
了
解氮元素的化学性质及其化合物的特点对于理解和应用相关知识都是非常
必要的。


专题十氮及其化合物课标要求1.结合真实情境中的应用实例或通过实验探究,了解氮及其重要化合物的主要性质。
2.认识氮及其重要化合物在生产中的应用和对生态环境的影响。
3.认识氮及其化合物的多样性。
4.认识氮及其化合物的转化在促进社会文明进步、自然资源综合利用和环境保护中的重要价值。
氮及氮的氧化物结合环保问题考查氮及其化合物的性质(热点角度)2019江苏,16生活实践分析与推测氨及铵盐火箭燃料——联氨的结构与性质(热点角度)2016全国卷Ⅱ,26学习探索理解与辨析硝酸硝酸与金属反应的实验探究2015北京,12学习探索探究与创新PH3、H3PO2、PCl3等的性质及其应用(热点)2018全国卷Ⅱ,11A学习探索理解与辨析高考怎么考选择题常从宏观辨识与微观探析角度考查氮的固定、氮氧化物的回收利用,具有一定的创新性;非选择题常结合工艺流程、实验、化学反应原理考查硝酸、氨气、铵盐等物质的性质,要关注守恒法在化学计算中的应用,具有一定的综合性;磷及其化合物一般会结合物质结构等进行考查,砷及其化合物会以新材料、新技术为背景结合工艺流程、物质结构等进行考查,具有一定的应用性。
预计2022年高考对氮及其化合物的考查保持稳定,磷、砷及其化合物可能结合磷矿石等新材料进行命题,考查考生对基础知识的掌握情况和迁移应用的能力。
考点1 氮及氮的氧化物考点帮·必备知识通关考法帮·解题能力提升考法1 氮及氮的氧化物的性质和应用考点2 氨及铵盐考点帮·必备知识通关考法帮·解题能力提升考法2 氨的制备和性质探究考点3 硝酸考点帮·必备知识通关考法帮·解题能力提升考法3 金属与硝酸反应的性质探究与计算高分帮 “双一流”名校冲刺析素材·情境应用素材16 PH3、H3PO2、PCl3等的性质素材17 As及其化合物的性质及应用探模型·主题探究模型2 基于核心素养下的新情境命题模型——工艺流程题11.氮气(1)氮元素在自然界中的存在形式和氮的固定(2)氮气的性质2.氮的氧化物 [重点](1)氮的氧化物氮有多种价态的氧化物:N2O(笑气,有麻醉作用)、NO、N2O3(亚硝酸的酸酐)、NO2(主要的大气污染物)、N2O4、N2O5(硝酸的酸酐)等。

高考化学 氮族元素必备专题复习【考纲解读】1. 了解氮的单质及其氧化物、氢化物的性质。
2. 了解氮的氧化物对大气的污染及其防治;初步了解含磷洗涤剂对环境及人类健康的影响。
3. 掌握氨、铵盐的性质、掌握NH 4+的检验。
4. 掌握 NH 3 的实验室制法。
5. 掌握 HNO 3的性质。
【高考预测】1. 氮族元素性质的相似性、递变性及其应用。
2. 有关氮的氧 化物和氧气的混合气体与水反应的计算。
3.NO x 、含磷洗涤剂对环境及人类健康的危害与防治。
4.NH 3 的结构特点; NH 3、铵盐的化学性质及其应用。
5.NH 的实验室制法、工业制法的反应原理、仪器、原理、收集及检验;+的检验。
NH346.HNO 3 的强氧化性;运用电子守恒进行 HNO 3的相关计算。
一、氮气的化学性质1. 氮的固定使空气中 __________的氮转化为 __________ 的过程。
2. 氮气的性质①物理性质纯净的N 2 是一种无色无味的气体,难溶于水,在空气中约占总体积的______。
②化学性质氮气的化学性质:常温稳定、高温活泼(与N ≡ N 叁键键能有关)⑴还原性: N 2 + O 2 放电注: NO 与 O 2 进一步化合 2NO + O 2 = 2NO 2(红棕色)2NO⑵氧化性: N + 3H高温高压。
3Mg+N点燃22NH3MgN2232压催化剂例 1、( 2013·上海化学· 18)汽车剧烈碰撞时,安全气囊中发生反应 10NaN 3+2KNO 3→K 2O+5Na 2O+16N 2↑。
若氧化物比还原物多1.75mol ,则下列判断正确的是A. 生成 40.0LN 2(标准状况)B.有 0.250molKNO 3 被氧化C. 转移电子的物质的量为1.25mol D. 被氧化的 N 原子的物质的量为 3.75mol【答案】 CD二、氮的氧化物1.在氮族元素中氮和其它元素比较,有很大的特殊性,它的主要化合价有-3、+1、+2、+3、+4、+5,氮元素能以不同的价态与氧结合,可以形成多种氧化物:N 2O 、 NO 、 N 2O 3、 N 2O 4、 NO 2、 N 2O 5。


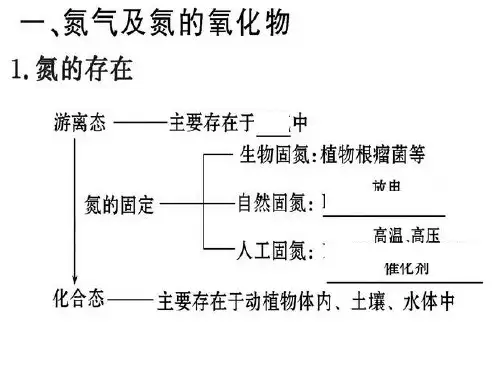
高中化学氮元素及其化合物重点知识(一)氮气1. 氮元素的存在既有游离态又有化合态。
它以双原子分子(N2)存在于大气中,约占空气总体积的78%或总质量的75%。
氮是生命物质中的重要组成元素,是构成蛋白质和核酸不可缺少的元素。
是农作物生长所必需的元素.充足的氮肥使植物枝叶茂盛.叶片增大,从而提高农作物的产量和质量。
2. 氮气的结构和性质(1)物理性质纯净的氮气是一种无色、无味、密度比空气稍小的气体,熔点为-209.86℃。
沸点为-195.8℃,难溶于水。
(思考N2的收集方法?)(2)结构:电子式为:______________ 结构式为___________,氮氮叁键的键能高达946kJ·mol-1,键能大,分子结构稳定,化学性质不活泼。
(3)化学性质常温下,N2的化学性质很不活泼,可代替稀有气体做保护气,但在高温、放电、点燃等条件下,N2能与H2、O2等发生化学反应。
①N2+3H2 2NH3(可逆反应)是工业上合成氨的反应原理。
②与O2反应:③与Mg反应:N2+3 Mg Mg3N2;Mg3N2+ 6H2O=3Mg(OH)2↓+ 2NH3↑3. 氮气的用途与工业制法(1)氮气的用途:合成氨;制硝酸;用作保护气;保护农副产品;液氮可作冷冻剂。
(2)氮气的工业制法工业上从液态空气中,利用液态氮的沸点比液态氧的沸点低加以分离而制得氮气。
4. 氮的固定将空气中游离的氮气转变为氮的化合物的方法,统称为氮的固定。
氮的固定有三种途径:(1)生物固氮:豆科作物根瘤菌将N2转化为化合态氮。
(2)自然固氮:天空中打雷闪电时,N2转化为NO。
(3)工业固氮:在一定的条件下,N2和H2人工合成氨。
(二)氮的氧化物(1)物理性质NO:无色、无味的气体,难溶于水,有毒。
NO2:红棕色、有刺激性气味的气体,有毒。
(2)化学性质NO:不与水反应,易被氧气氧化为NO2。
2NO+ O2=== 2NO2NO2:①易与水反应生成硝酸和NO,在工业上利用这一反应制取硝酸。