核酸疫苗的研究进展
- 格式:pdf
- 大小:267.40 KB
- 文档页数:7

DNA疫苗免疫佐剂的研究进展摘要: DNA疫苗是一种很有希望的免疫方法,经多途径接种质粒DNA能引起有效的免疫应答,重复给予不会产生抗载体免疫。
然而,质粒DNA疫苗在小型实验动物中诱导的免疫应答远强于在人类和其他非人灵长类动物中。
已设计多种佐剂通过直接刺激免疫系统或增强DNA表达来提高疫苗的免疫原性,这些佐剂包括细胞因子、免疫协同刺激分子、补体分子、脂质体、核酸、聚合物佐剂等。
此文对DNA疫苗佐剂的研究进展作一综述。
关键词:疫苗;DNA;佐剂;免疫;细胞因子;聚合物20世纪90年代以来,DNA疫苗的快速发展给疫苗研究带来了新的变革,已逐步显示出巨大的应用潜力。
然而,DNA疫苗也存在着明显的不足,即DNA疫苗刺激机体产生免疫应答的能力往往比常规疫苗接种引起的免疫反应弱,这就给DNA疫苗的研究提出了新的挑战。
因此,新型疫苗佐剂已成为当今倍受关注的研究热点。
免疫佐剂是指与抗原同时或预先应用,能促进、延长或增强对疫苗抗原特异性免疫应答的物质。
DNA疫苗又称基因疫苗或核酸疫苗,是将编码某种抗原蛋白的基因置于真核表达元件的控制之下,构成重组DNA质粒,当将重组DNA质粒直接导入受者体内后,宿主细胞通过自身转录翻译系统合成抗原蛋白,进而刺激机体产生特异性体液和细胞免疫应答。
DNA疫苗常见的接种途径为肌肉注射,在小动物模型中质粒DNA经静脉、腹腔、舌下、阴道和鼻内接种均能诱导抗原特异性免疫应答;口服能耐受降解的质粒DNA也可引起免疫应答;DNA 疫苗经淋巴组织内接种显示安全,且诱导的免疫应答明显强于肌肉注射。
基因枪可增强质粒DNA导人皮肤,已应用于AIDS、麻疹等多种疫苗接种系统。
与肌肉注射相比,基因枪接种诱导的免疫应答有所提高。
DNA疫苗在小型实验动物中可诱导有效的细胞免疫应答,但在人体临床试验中效却不明显[1]。
DNA疫苗的免疫原性受到接种途径的限制,因吸收差、表达效率低和降解快,质粒DNA只能诱导有限的体液和细胞免疫反应[2]。

新冠疫苗研发的进展与挑战新冠疫情自2020年初爆发以来,给全球带来了巨大的冲击,人民的生命和健康面临巨大威胁。
在这场疫情中,疫苗的研发被认为是最重要的因素之一,它能够为人们提供有效的防护,帮助控制疫情的传播。
本文将介绍新冠疫苗研发的进展和面临的挑战。
一、新冠疫苗研发的进展自新冠疫情暴发以来,全球范围内的科学家和研究机构迅速展开了疫苗研发工作。
经过数月的努力,一些疫苗已经取得了重大突破。
以下是目前为止新冠疫苗研发的主要进展:1. 疫苗类型的多样性:科学家尝试了多种不同类型的疫苗,如蛋白亚单位疫苗、灭活疫苗、载体病毒疫苗和核酸疫苗等。
这些不同类型的疫苗都在一定程度上展现了有效性,增加了疫苗研发的多样性。
2. 临床试验进展:一些新冠疫苗已经进入了临床试验阶段。
通过对志愿者进行不同阶段的试验,科学家们能够评估疫苗的安全性和有效性。
这些试验结果对疫苗的进一步研发和批准起到了重要的作用。
3. 有效性证据的出现:一些新冠疫苗已经公布了一些鼓舞人心的有效性证据。
根据早期的试验结果,这些疫苗能够显著降低感染新冠病毒的风险,并且在部分试验者中产生强大的免疫反应。
这些结果为疫苗的广泛使用提供了希望。
4. 疫苗生产和分发的准备工作:全球范围内的政府和组织已经开始着手准备疫苗的生产和分发工作。
这包括生产线的建设、运输和储存设施的建设等。
这些准备工作将为疫苗的分发和普及打下坚实的基础。
二、新冠疫苗研发面临的挑战尽管新冠疫苗的研发取得了一些重要的进展,但仍然面临着许多挑战。
以下是一些关键的挑战:1. 安全性和有效性的验证:疫苗的安全性和有效性是任何疫苗研发工作的核心问题。
尽管目前的试验结果是鼓舞人心的,但疫苗在大规模使用之前仍然需要经历更多的临床试验和验证过程。
2. 生产和分发的挑战:生产和分发大规模的疫苗是一项复杂的任务。
疫苗的生产需要大量的资源和设备,并且需要建立完善的供应链和分发网络。
在全球范围内实现疫苗的公平分发也是一项重大挑战。
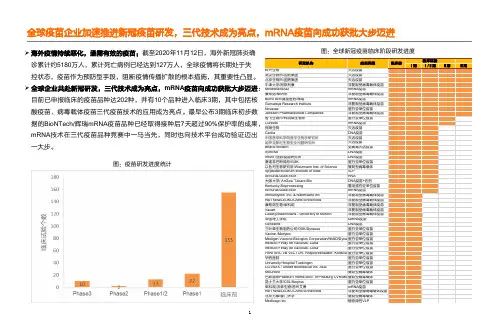
➢海外疫情持续恶化,亟需有效的疫苗:截至2020年11月12日,海外新冠肺炎确诊累计约5180万人,累计死亡病例已经达到127万人,全球疫情将长期处于失控状态,疫苗作为预防型手段,阻断疫情传播扩散的根本措施,其重要性凸显。
➢全球企业共赴新冠研发,三代技术成为亮点,mRNA疫苗向成功获批大步迈进目前已申报临床的疫苗品种达202种,并有10个品种进入临床3期,其中包括核酸疫苗、病毒载体疫苗三代疫苗技术的应用成为亮点。
最早公布3期临床初步数据的BioNTech/辉瑞mRNA疫苗品种已经取得接种后7天超过90%mRNA技术在三代疫苗品种竞赛中一马当先,同时也向技术平台成功验证迈出一大步。
图:全球新冠疫苗临床阶段研发进度图:疫苗研发进度统计全球疫苗企业加速推进新冠疫苗研发,三代技术成为亮点,mRNA疫苗向成功获批大步迈进疫苗技术不断发展,向三代疫苗迈进➢疫苗的预防属性:疫苗通过让健康人的免疫系统提前识别病原体以形成记忆,从而在真正感染时迅速形成高水平免疫应答以实现预防效果。
➢疫苗向三代疫苗迈进:疫苗的升级是抗原从完整到精准,平台从专用到通用,免疫应答从单一到全面的过程。
一代苗是使用完整的病原体作为疫苗,包括减毒疫苗和灭活疫苗。
二代疫苗将抗原精简为病原体的蛋白或多糖,可以通过基因重组技术来实现抗原设计,并在体外表达、提纯。
三代疫苗则是将抗原简化成顶层的核酸物质,接种后借用人体细胞实现一步到位的胞内抗原表达。
当前疫苗技术升级正处于二代疫苗向三代疫苗迈进的节点,新冠疫苗的研发加速了三代疫苗技术的应用与成熟。
三类疫苗平台各有特点,三代疫苗在研发速度、产业化、以及疫苗的免疫原性上优势明显,未来应用前景良好。
图:疫苗技术和关系图:三代次疫苗技术平台及特点完整病原体蛋白质/多糖RNA和DNA二代苗一代苗三代苗技术升级构成顺序适用性灭活疫苗、减毒疫苗亚单位疫苗mRNA疫苗DNA疫苗病毒载体疫苗三代疫苗更符合理想疫苗的标准➢冠状病毒通过S蛋白结合ACE2进入细胞后,在人体细胞中进行复制和释放,从人体防御机制上看,病毒会被抗原呈递细胞摄入,展现给辅助性T细胞,以激活B细胞产生抗体、细胞毒性T细胞识别并摧毁病毒的感染细胞。





核酸疫苗与寄生虫核酸疫苗的研究进展【摘要】本文探讨了核酸疫苗与寄生虫核酸疫苗的研究进展。
在介绍了当前疫情背景和疫苗研究的重要意义。
在分别讨论了核酸疫苗和寄生虫核酸疫苗的最新研究进展,并进行了比较分析。
探讨了这两种疫苗面临的挑战与机遇,并展望了未来的发展方向。
在总结了核酸疫苗与寄生虫核酸疫苗研究的重要进展,并强调了其对疫情防控和公共健康的新意义。
本文旨在为读者提供最新的科学研究动态,促进对疫苗研究领域的深入了解和探讨。
【关键词】核酸疫苗, 寄生虫核酸疫苗, 研究进展, 比较分析, 挑战与机遇, 未来展望, 疫情背景, 疫苗研究意义, 结论, 重要性与新意义1. 引言1.1 疫情背景2020年底,新型冠状病毒肆虐全球,导致全球范围内的疫情爆发。
该病毒以其高度传染性和致命性引起了全球范围内的恐慌和关注,多个国家纷纷实施封锁措施来遏制病毒传播。
疫情的持续蔓延导致全球经济受到重创,社会生活受到了严重影响。
疫情的爆发凸显了传染病控制的重要性,同时也对疫苗的研究和开发提出了更高的要求。
传统疫苗开发过程时间长、成本高,而核酸疫苗则具有研发周期短、适应性强等优势,被视为应对疫情的有力工具。
加速核酸疫苗的研究与开发成为当前疫情防控的重要一环。
疫情背景下,核酸疫苗的研究和开发具有重要意义,不仅可以有效控制疫情的蔓延,还可以为人类未来面对新的传染病提供有力支持。
通过研究核酸疫苗的进展和应用,可以为全球传染病防控工作提供宝贵经验和启示,推动医学科研的发展,为人类健康安全作出贡献。
1.2 疫苗研究意义疫苗研究的意义在于为预防和控制传染性疾病提供有效工具,保障人类健康和生命安全。
疫苗是预防传染病最经济、有效的手段之一,可以在病毒或细菌入侵人体前,通过激发免疫系统产生特异性抗体或细胞免疫应答,促使人体产生对病原体的防御能力,避免感染或减轻感染后疾病的严重程度。
随着科技的不断进步,疫苗研究已经取得了长足的进展,包括核酸疫苗和寄生虫核酸疫苗的研究也在不断推进。

新冠病毒疫苗研发策略与进展概述目前在全世界流行的新型冠状病毒肺炎(COVID-19)(以下简称新冠肺炎)给人类社会带来了巨大灾难。
新冠肺炎是由新型冠状病毒(SARS-CoV-2)(以下简称新冠病毒)感染所引发的,它是2019年新显现的一种冠状病毒。
冠状病毒是有包膜的单股正链RNA病毒,形状大多呈球形,直径约60—200 nm,其包膜上具有规则排列的棘状突起,形状类似皇冠,故名冠状病毒[1]。
冠状病毒的核酸链是目前已知的RNA病毒中最长的,其基因组除了包含相关的酶基因外,还包含各种结构蛋白的编码基因,主要有编码位于包膜上的纤突蛋白(spike protein,S蛋白)、膜蛋白(membrane protein,M蛋白)、包膜蛋白(envelope protein,E蛋白)基因和编码与病毒RNA紧密结合的核蛋白(nucleocapsid protein,N 蛋白)基因。
S蛋白含有宿主细胞受体识别位点,是介导病毒入侵和决定病毒感染种属与组织特异性的因子;E蛋白和M蛋白主要参与病毒的装配过程;N蛋白包裹基因组形成核蛋白复合体[2]。
由于目前尚未找到对新冠肺炎有确切疗效的药物,所以尽快研发出针对新冠病毒的疫苗是控制疫情传播最有效的手段。
根据技术路径不同,目前新冠疫苗研发的主要策略有灭活疫苗、减毒活疫苗、腺病毒载体疫苗、重组蛋白疫苗、核酸疫苗等。
本文介绍这5种主要的疫苗研发策略、优缺点及研究进展。
1 灭活疫苗灭活疫苗是指通过对具有感染性的完整病毒采用加热、辐射或化学药品处理(如甲醛、β-丙内酯等)等方式进行灭活,使其失去侵染能力但保留免疫原性,经纯化后制得的疫苗。
常见的灭活疫苗有狂犬疫苗、甲肝灭活疫苗、脊灰灭活疫苗等。
灭活疫苗的优点在于生产技术相对成熟,安全性比较高;其缺点是通常主要激活体液免疫,单剂次接种免疫原性弱,免疫效果会随接种时间的延长而逐渐减弱,需要增加接种剂次以维持免疫效果。
某些情况下,灭活疫苗可能会产生抗体依赖增强效应(antibody-dependent enhancement,ADE):正常情况下抗体通过与病毒表面的特异性抗原表位相结合来阻止病毒感染,但在某些情况下,抗体与病毒形成的免疫复合物却可通过与靶细胞膜上的Fc受体或补体受体相结合,帮助病毒进入靶细胞,从而造成更严重的感染。

疫苗研发的新思路与新方法疫苗是目前预防疾病的最有效手段之一。
在新冠疫情肆虐的背景下,疫苗的研发和生产变得更加紧迫。
然而,传统的疫苗研发方式,如失活疫苗、亚单位疫苗和载体疫苗等,存在生产周期长、局限性大、安全性难以保证、抗原变异性等问题,因此需要新思路和新方法。
本文将会探讨一些新兴的疫苗研发技术和方法。
一、肽疫苗技术肽疫苗是指通过合成目标疫病相关蛋白序列中的肽段,然后将它们与免疫佐剂物一同注射到接种者体内,以刺激免疫系统对这些肽段的抗体和T细胞反应。
相比传统疫苗产生的巨量抗体,肽疫苗能够刺激T细胞的反应,从而引导免疫系统产生更多的免疫细胞,以达到更为有效的防御病原体的效果。
另外,由于肽疫苗选用的肽段比蛋白抗原小很多,因此非常适合在抗原变异频繁的病毒中使用。
目前,研究人员在肽疫苗领域的努力已经取得了很多进展。
例如,美国Duke大学的研究团队成功地开发出了一种针对HIV的肽疫苗。
该疫苗采用的是一种名为“离子液体辅助分析”的技术,可以在不使用传统限制性能力核苷酸酶(CRISPR)的情况下,快速选择出针对HIV特定突变体的肽段。
二、核酸疫苗技术核酸疫苗,顾名思义,是将DNA或mRNA等核酸序列作为疫苗,引导人体自身的细胞生成抗原蛋白,从而启动免疫反应以对抗病原体。
相比传统疫苗,核酸疫苗的制备速度更快、成本更低、规模也更加灵活,同时还具有更广泛的应用前景和更高的安全性。
特别是在突发传染病的应急情况下,核酸疫苗的研发和生产速度比传统疫苗要快得多。
目前,美国Moderna公司就在市场上占据了核酸疫苗的先发优势。
他们已经与美国国立卫生研究院合作,研制出了一种新冠肺炎mRNA疫苗,取得了令人瞩目的临床试验结果。
三、病毒样颗粒病毒样颗粒是一种有效的疫苗载体,它可以在不使用完整的病毒粒子的情况下,呈现出与病毒相似的三维结构、抗原表现及免疫原性。
由于不需要使用活体的病毒,在制备和生产过程中的安全性和规模灵活性上,病毒样颗粒疫苗比传统的疫苗具有更多的优势。

新型冠状病毒灭活疫苗研究进展一、本文概述随着全球范围内新型冠状病毒(COVID-19)的爆发,疫苗研发成为了全球科研工作者的重要任务。
其中,新型冠状病毒灭活疫苗作为一种传统而有效的疫苗类型,其研究进展受到了广泛关注。
本文旨在综述新型冠状病毒灭活疫苗的研究进展,包括其制备工艺、免疫原性、临床试验等方面的最新成果和挑战。
通过深入了解和分析灭活疫苗的研发过程,本文旨在为疫苗研发领域的科研工作者和公众提供全面、准确的信息,以推动新型冠状病毒疫苗的研发和应用进程。
二、新型冠状病毒灭活疫苗的研发历程自2019年底新型冠状病毒(COVID-19)爆发以来,全球科研团队迅速投入到了疫苗的研发工作中。
新型冠状病毒灭活疫苗作为其中的一种重要疫苗类型,其研发历程充满了挑战与突破。
研发初期,科研团队首先需要对新型冠状病毒进行深入研究,了解其生物学特性、基因组结构以及感染机制等。
这是疫苗研发的基础,只有深入理解病毒,才能设计出有效的疫苗。
随后,科研团队开始了灭活疫苗的研发工作。
灭活疫苗是一种通过物理或化学方法使病毒失去活性但仍保留其抗原性的疫苗。
研发过程中,科研团队需要确定最佳的灭活方法,以保证疫苗的安全性和有效性。
经过多次试验和优化,科研团队成功制备出了新型冠状病毒灭活疫苗。
接下来,疫苗进入了临床试验阶段。
这个阶段包括了一期、二期和三期临床试验,旨在评估疫苗的安全性、免疫原性和有效性。
一期临床试验主要评估疫苗在健康人群中的安全性和免疫原性。
二期临床试验则进一步扩大受试者范围,评估疫苗在不同人群中的效果和安全性。
三期临床试验是最大规模的临床试验,旨在评估疫苗在真实世界条件下的保护效果。
经过严格的临床试验和审批流程,新型冠状病毒灭活疫苗最终获得了批准并投入使用。
疫苗的上市为全球抗击疫情提供了有力武器,为人们的健康和安全提供了保障。
新型冠状病毒灭活疫苗的研发历程是一个充满挑战和突破的过程。
科研团队的辛勤工作和无私奉献为疫苗的研发成功奠定了坚实基础。
•新型冠状病毒专题•新型冠状病毒肺炎疫苗临床研究进展靳卫平I’2申硕w1武汉生物制品研究所有限责任公司病毒性疫苗研究一室430207; 2国家联合疫苗工程技术研究中心,武汉430207通信作者:申硕,Email:shenshuol@【摘要】至2021年2月,新型冠状病毒引起的新型冠状病毒肺炎疫情全球大流行已造成1亿以上的报告病例和超过2()()万的致死病例。
随着临床治疗、病理学、流行病学和病毒分子生物学研究取得进展,疫苗研发也获得了重大突破。
目前已有多款疫苗完成初步的临床安全性和效力评估,并获得紧急使用或有条件上市批准。
此文对研究进展较快的多种类型新型冠状病毒肺炎疫苗的临床研究结果进行分析,总结疫苗安全性、免疫原性和初步保护效力的临床研究结果,对疫苗面临的挑战和应对策略进行讨论和展望,重点描述和总结新型技术平台的m R NA疫苗及灭活疫苗的技术指标和特点。
【关键词】新型冠状病毒肺炎;新型冠状病毒;严重急性呼吸综合征冠状病毒2;病毒疫苗;临床试验;保护效力基金项目:国家重点研发计划(2020YFC0842100、2020YFC0860600); 2020年中央引导地方科技发展专项(Z135050009017)【中图分类号】R392.3 DOI: 10. 3760/311962-20210219-00006The advance of COVID-19 vaccine development and clinical trialsJin W eiping1,2 , Shen Shuo1,21Research Division 1o f Viral Vaccines,Wuhan Institute o f Biological Products Co.,L td.,Wuhan 430207,China; 2National Engineering Technology Research Center o f Combined Vaccines,Wuhan 430207,ChinaCorresponding author ••Shen Shuo,Email: ***********************[Abstractl As of February 2021, the COVID-19 globe pandemic caused by 2019 novel coronavirusinfection has resulted in over 100 million reported cases and 2 million fatal cases worldwide. With theadvance in studies on clinical treatment»pathology, epidemiology, and basic molecular biology of thepathogen, vaccine development has made great breakthroughs. Several COVID-19 vaccines have beengranted emergency use or conditional license. This review analyzes the safety,immunogenicity andprimary efficacy of more advanced candidate vaccines based on their clinical study results. The challengesand strategies of different kinds of vaccines are discussed,focusing on mRNA vaccine using noveltechnology platform and traditional inactivated vaccines.【Key words】COVIEM9; 2019 novel coronavirus; Severe acute respiratory syndrome coronavirus2;Viral vaccines;Clinical trial;EfficacyFund programs:National Program on Key Research Project of China ( 2020YFC0842100、2()20YFQ)860600) ;Joined Central/Hubei Governments Science and Technology Development SpecialProject (Z135()50()09017)DOI:10. 3760/cma. j. cn311962-20210219-000062019年底,武汉出现一种新型严重肺炎病例,通过对患者采样的潜在病原体核酸序列分析和病毒 细胞培养鉴定,确诊为由新型冠状病毒(简称新冠病毒)引起的新型冠状病毒肺炎(COVII>19)W。
新型基因工程疫苗的研究 及发展趋势分析学院:动物科技学院班级:姓名:学号:日期:新型基因工程疫苗的研究及发展趋势分析 近几年来,随着分子生物学技术的发展,运用生物高新技术研究出许多新型动物疫苗,包括重组亚单位疫苗、基因缺失疫苗、重组或载体疫苗、合成肽疫苗、抗体疫苗以及核酸疫苗。
这些高科技疫苗的生产无需大量培养致病微生物,克服了传统疫苗的一系列缺点,为研制更安全、更有效的疫苗提供了新的途径。
基因工程疫苗就是用基因工程的方法或分子克隆技术分离出病原的保护性抗原基因,将其转入原核或真核系统使其表达出该病原的保护性抗原,制成疫苗;或者将病原的毒力相关基因删除,使成为不带毒力相关基因的基因缺失苗。
亚单位疫苗(subunit)利用基因工程技术,取出微生物中编码保护性抗原肽段的基因,再将此基因与质粒等载体重组,导入受体菌(细菌、酵母)或细胞,使之在受体菌或细胞内高效表达,产生大量保护性肽段,提取此保护性肽段,加佐剂后即成为亚单位苗。
目前常用于亚单位疫苗生产系统的,一是以杆状病毒为外源抗原基因的载体,在昆虫细胞中表达生产;二是利用穿梭质粒为载体,运送外源抗原基因在酵母细胞中表达生产;三是在强大的启动子控制下以动物病毒为载体在动物细胞中表达生产。
世界上最早的以基因工程技术构建生产的实验性疫苗是基因工程口蹄疫亚单位疫苗,第一个商品化的基因工程疫苗是预防仔猪腹泻的大肠菌菌毛K88亚单位疫苗)又称重组活毒疫苗。
通常以动物活载体疫苗(vectored vaccines病毒弱毒或无毒株,如痘苗病毒、疱疹病毒、腺病毒、反转录病毒等作为载体,插入外源抗原基因构建成重组活病毒载体,转染病毒细胞,使载体病毒获得表达外源基因的新的特性,此种重组体疫苗称为基因工程活载体苗。
病毒活载体苗其本质是杂交病毒,它既含有一种病毒复制所需的全部基因,又含有另一种病毒编码免疫原性蛋白质的基因片段。
用这种杂交病毒免疫家禽,既能刺激宿主产生体液免疫,又能刺激宿主产生细胞免疫。
核酸疫苗与寄生虫核酸疫苗的研究进展【摘要】核酸疫苗是一种新型疫苗,具有研究和应用潜力。
本文首先介绍了核酸疫苗的原理和优势,然后重点探讨了寄生虫核酸疫苗的研究现状以及基于核酸疫苗的寄生虫疫苗研究进展。
通过动物实验和临床试验结果的分析,可以看出核酸疫苗在寄生虫疫苗研究中具有很大的潜力。
在强调了重视核酸疫苗的开发与应用的重要性,同时指出了未来发展趋势。
核酸疫苗在研究寄生虫疫苗方面具有重要作用,有望为防控寄生虫疾病提供新的思路和方法。
【关键词】核酸疫苗、寄生虫、研究进展、原理、优势、疫苗研究现状、动物实验、临床试验、发展趋势、潜力、开发、应用。
1. 引言1.1 核酸疫苗与寄生虫核酸疫苗的研究进展核酸疫苗是一种新型疫苗,利用核酸分子作为疫苗制剂,通过转染机制激活宿主细胞产生特定抗原蛋白,从而引发免疫反应,提供保护作用。
寄生虫核酸疫苗则是针对寄生虫疾病研发的核酸疫苗,希望通过此方法有效预防和治疗寄生虫感染引起的疾病。
随着生物技术和疫苗研究的不断进步,核酸疫苗与寄生虫核酸疫苗的研究也取得了一系列重要突破。
研究人员通过不断优化核酸疫苗设计、开发新的递送系统和增强免疫效应等方式,不断提高核酸疫苗的稳定性和免疫原性,为寄生虫疫苗研究带来新的可能性。
本文将就核酸疫苗的原理与优势、寄生虫核酸疫苗的研究现状、基于核酸疫苗的寄生虫疫苗研究进展、动物实验和临床试验结果以及未来的发展趋势等方面展开讨论,探讨核酸疫苗在寄生虫疫苗研究中的潜力和重视核酸疫苗的开发与应用的重要性。
2. 正文2.1 核酸疫苗的原理与优势核酸疫苗是一种利用核酸分子(如DNA或RNA)作为疫苗的基因载体,通过注射进入人体细胞,使细胞产生特定抗原蛋白,从而诱导机体产生持久性免疫反应的疫苗。
相比传统疫苗,核酸疫苗具有以下几点优势:1. 安全性高:核酸疫苗不含活病毒或细菌,不存在复制活病原体的风险,因此安全性较高。
2. 适应性强:核酸疫苗设计灵活,可根据病原体的基因序列快速合成,因此适应性强,可以应对病原体变异带来的挑战。
核酸疫苗的研究进展任晓峰1.2, 尹杰超2, 李一经2,李广兴2李根喜1.* (1.南京大学生命科学学院,江苏,南京 210093; 2.东北农业大学动物医学院,黑龙江,哈尔滨 150030)核酸疫苗又称基因疫苗,是指将编码某种抗原蛋白的外源直接导入动物细胞,在宿主细胞中表达并合成抗原蛋白,并激起机体一系列类似于疫苗接种的免疫应答;起到预防和治疗疾病的目的。
自1990年Wolff 等人[1]意外发现核酸疫苗后,其相关的研究得到了广泛的重视,并得以迅速发展,誉为“第三次疫苗革命”。
本文就核酸疫苗的构建、特性、免疫机制、接种方式、影响因素、研究现状和前景作一综述。
关键词关键词::DNA,疫苗,免疫,综述一 核酸疫苗的构建核酸疫苗是由编码病原体抗原的基因和作为真核细胞表达载体的质粒DNA 组成。
病原体抗原的编码基因可以是一组相关基因或单一病原体免疫保护性抗原基因,也可以是编码抗原决定簇的一段DNA 序列,其表达产物应是病原体的有效成分,可以引发保护性免疫。
用于构建核酸疫苗的载体质粒多以pUC 或pBR322质粒为基本骨架,主要包括启动子、增强子和3’端多聚A 。
巨细胞病毒(CMV )启动子和ROUS 肉瘤病毒(RSV )的启动子都可在哺乳类细胞内表达。
另外也有人采用来自哺乳动物和禽类的启动子。
Fynan [2]等1993年将编码流感病毒血凝素H 或H7的cDNA 片段插入CMV 质粒的转录调控元件的下游,构建了抗流感病毒的核酸疫苗,另外,乙型肝炎病毒[3]、人免疫缺陷综合症病毒[4]、脑膜炎病毒[5]等基因均被成功地克隆到含CMV 启动子的真核表达载体上,并表现了免疫活性。
用于构建核酸疫苗的病毒载体包括流感病毒载体、腺病毒载体、腺病毒相关载体、脊髓灰质炎病毒等。
1994年Castrucci-MR [6]把可以引起保护性免疫反应的致死性淋巴细胞脉络丛脑膜炎病毒(LCMV )的表位基因片段克隆到流感病毒(H 1N 1)的基因组中制备核酸疫苗,免疫小鼠后,可使小鼠抵抗致死性淋巴细胞脉络丛脑膜炎病毒的攻击,其免疫效果可维持4个月以上。
二 核酸疫苗的特点与传统的灭活疫苗、弱毒疫苗和基因工程疫苗相比,核酸疫苗具有如下特点[7]:(1)免疫效果好,基因疫苗能在宿主细胞中产生外源性蛋白,此种蛋白比原核生物表达系统中产生的蛋白更象天然分子,其抗原识别递呈过程与自然感染十分相似,从而引起几乎等同于感染这些病原体或弱毒疫苗免疫后所产生的免疫应答,并且避免了基因重组技术在体外合成的蛋白质抗原表位丢失或改变。
(2)利用一种表达载体同时表达多种蛋白,诱导机体产生针对多种病原体的免疫应答,从而起到一次注射核酸疫苗同时预防和治疗多种疾病的效果,并可抵抗某些变异病原体的侵袭(3)核酸疫苗接种后,蛋白质抗原在宿主细胞内,可直接与MHC I 类和MHC II 类分子结合,引起广泛的细胞免疫和体液免疫,但无毒力返祖的危险(4)安全性好,由于核酸疫苗一般采用表达载体在动物细胞体内进行抗原表达,不与宿主染色体DNA 整合,但能在宿主体内表达,与病毒活疫苗相比,避免了病毒本身存在的复毒和病毒基因组整合到宿主染色体的危险(5)核酸疫苗具有共同的理化特性,可在同一载体上构建表达多种抗原,生产多价疫苗或同时注射2种以上的核酸疫苗来进行联合免疫(6)制备简单,利用成熟的基因重组技术,将克隆的目的基因DNA直接接种,避免了表达载体的构建,表达产物的提取等繁琐过程(7)由于核酸疫苗作为重组质粒,能在工程菌内快速大量增殖,且提取方法简便,可使生产成本降低,并能加工干燥,便于储藏和运输。
三核酸疫苗免疫机理对核酸疫苗免疫机理说法不一,大多数学者认为[8-9],其致病机理在于他模拟了病毒的自然感染过程。
DNA质粒在注射部位被肌细胞吸收摄取后,通过所含的启动子和增强子系统调节合成所编码的蛋白质,合成的蛋白质被细胞内蛋白酶复合体降解成含病毒抗原表位的肽段,进入内质网与合成MHCI类分子结合,然后被转运系统递呈到细胞膜表面,此复合体共同激活CD8+CTL,部分被分泌或释放入血的蛋白质,激活特异性B 细胞,从而产生保护性抗体;另外,分泌的蛋白质被巨噬细胞或树突状细胞等专职抗原递呈细胞俘获,被加工成肽段,进入溶酶体/内体区与MHC II类分子结合,激活受MHC II类分子限制的CD4+Th细胞,被激活的Th细胞分泌IFN—γ、IL-2等细胞因子,,进一步促进和强化体液免疫和细胞免疫。
另外,试验证明质粒上的氨苄青霉素抗性选择基因中的回文结构5’-AACGTT-3’能够使单核细胞产生白细胞介素-12,刺激细胞分泌干扰素,增强NK细胞的活性,称为“单链免疫刺激DNA序列”起到佐剂的作用[10]。
四核酸疫苗的接种方式核酸疫苗可以通过多种方式、途径接种到机体的适当部位,不同的接种方式或途径可影响其免疫效果。
接种途径依启动子的来源而有所区别,用动物病毒和一般哺乳动物启动子构建的DNA疫苗一般用生理盐水稀释质粒DNA肌肉注射法,如股四头肌和腓肠肌等骨骼肌因为其特殊结构如肌浆网、横向微管系统,适合于摄取和表达DNA,兼之其注射方便,因而常被选为接种组织,也可选择肌肉皮下、腹腔内、静脉内接种[8,11]。
而用来自乳腺的乳清酸蛋白(W AP)启动子构建的疫苗在乳腺和皮下脂肪接种效果更好[12];也有鼻腔内滴鼻法进行黏膜吸附免疫接种。
第二种方法是用高速度来提高疫苗DNA对组织的转染率和表达效率,一般用特殊工具-基因枪接种,基因枪能将包裹在金粒上的质粒DNA 直接注射进表皮细胞。
用基因枪接种比直接注射核酸疫苗的免疫效果好60-600倍。
用基因枪接种只需0.4-0.004µg纯化DNA,而肌肉注射需100-200µg的核酸疫苗,才能获得很明显的免疫效果。
Fynan[2]等人进行了不同方式接种流感病毒核酸疫苗免疫效力的研究证明上述二者的接种效果均高于静脉、鼻腔、真皮、皮下等其它接种方式,但不同宿主细胞所产生的免疫接种效果并不完全一致。
第三种方法是将组织预先用药物如丁哌卡因、心肌毒素和高渗蔗糖等处理,增加组织细胞对疫苗DNA的摄取和表达能力,称为“药物协助法”[13]。
另有人将疫苗DNA与粒细胞、巨噬集落刺激因子表达载体或一些细胞因子等一起或分别注射均能明显的提高疫苗免疫效率[14]。
还有用腺病毒介导或脂质体介导注射方法的报道,但存在潜在癌基因激活及缺乏细胞的导向性等缺点[15]。
五核酸疫苗免疫效果的影响因素(1)表达载体对核酸疫苗的影响表达载体对核酸疫苗的效力有很大的影响,表达载体主要以pUC和pBR322质粒为基本骨架,含DNA复制起始点、抗生素抗性基因、启动子、增强子和3’多聚A终止信号等结构,能在大肠杆菌中稳定地复制,但不能在哺乳动物细胞中复制[7]。
其中控制外源基因表达的启动子对载体的影响最大。
启动子因来源不同有组织特异性,并且在各种组织中起始mRNA合成的效能也不同。
基因疫苗中常用的来自病毒的启动子包括猴病毒40(SV40)早期启动子、巨细胞病毒(CMV)早期启动子及罗斯肉瘤病毒(RSV)启动子等,这些启动子的组织特异性较广,在许多组织细胞中能较好地表达外源基因,且在肌肉组织中的表达效率最高[11-14,16-17]。
Davis等曾将HBSAG基因分别克隆到含CMV和RSV启动子的质粒载体上,注射实验动物后,发现含CMV启动子的质粒诱导的免疫反应明显强于后者[18]。
现在大多采用CMV启动子。
也有人用来自哺乳动物和禽类的启动子如人β-肌动蛋白启动子[19]、乳清酸蛋白(W AP)启动子、绵羊金属硫蛋白启动子[20]和鸡β-肌动蛋白启动子[20-21]等构建基因疫苗。
这些启动子在肌肉内都有较好的转录活性,而W AP启动子则在乳腺和皮下脂肪表达效率最高[12]。
另外,Danko等[22]报告,共价闭环型的质粒pRSVL DNA的表达效率远高于线性质粒pRSVL DNA(2)DNA输入组织的方式:DNA输入组织可以用注射、脂质体包裹后注射、基因枪轰击、口服等。
其免疫效果因注射速度、导入速度、免疫剂量、接种部位、及宿主细胞不同而各有差异。
另外肌肉注射前用蛇毒、心肌毒素、高渗蔗糖(25%W/V,用PBS溶解)、丁哌卡因等预处理,可显著提高外源基因的表达。
(3)佐剂;Arom、QSI、细胞因子如IL-2等均可改变或提高核酸疫苗的免疫效力[15]。
(4)机体免疫反应:由于核酸疫苗导入体内加工后表达既可激活CD8+TCL细胞,引起细胞免疫,表现出外周血淋巴细胞增殖反应增强、白细胞介素2、γ干扰素分泌增加、细胞毒T淋巴细胞反应增强等表现。
又能通过分泌抗原表达,激活TH细胞或直接激活B 淋巴细胞产生抗体[13],故笔者认为机体免疫机能状态也是影响其免疫效力的主要原因之一。
六核酸疫苗的研究现状及应用前景1人类核酸疫苗研究现状自从90年核酸疫苗诞生之日起,学者们先后将一些不同病原体抗原基因的质粒DNA克隆到适宜的真核表达载体中,并接种于相应的动物体内,引发了特异性的免疫应答,对野毒株的攻击具有保护作用,以达到预防和治疗疾病的目的。
目前,许多种细菌、病毒、寄生虫的核酸疫苗得到了广泛的应用,并取得了良好的临床保护效果。
Ulmer等(1993)首先报道将流感病毒高度保守的核蛋白(NP)的cDNA克隆于质粒载体中,构建成表达NP的核酸疫苗,取适量注入小鼠的股四头肌,诱导出抗NP的特异性IgG抗体和CTL应答。
由于保护性抗原基因非常保守,故免疫小鼠即可抗同株流感病毒攻击,又可抵抗异株流感病毒攻击[23]。
爱滋病自本世纪80年代初发现以来,呈逐年成倍增长的趋势,其高度的致死性与惊人的蔓延速度令人“谈艾色变”,因此在世界范围内急需一种安全有效的HIV疫苗问世。
HIV中和抗原gp120V3区序列存在一高度同源共有序列,以此作疫苗研制的靶抗原可能会扩大疫苗的免疫保护范围。
目前有关HIV 外壳糖蛋白的基因重组疫苗、合成肽疫苗、重组病毒活载体苗正在积极研制中,但仍未取得另人满意的的结果。
1993年美国的W ANG等率先应用DNA疫苗技术将编码HIV-1包膜糖蛋白基因cDNA重组质粒pM160接种小鼠,产生了抗HIV-1包膜糖蛋白的特异性抗体,此抗体能中和HIV-1对体外培养细胞的感染,抑制HIV-1介导的体外培养细胞的合胞体的形成;并且还观察到了特异性的T细胞增殖现象;同时他们通过小鼠、猴体内进一步实验发现,若在DNA注射前对局部肌肉用药物预处理能明显提高了动物机体对HIV-1包膜糖蛋白的免疫应答能力,并检测到了特异的CTL应答[4,24-25]。
1994年Davis 等[26]分别将乙型肝炎表面抗原基因插入到了带CMV启动子的质粒构建了DNA疫苗,并肌肉注射小鼠体内,证明可在体内产生类似于病毒感染的细胞和体液免疫应答。