高中化学选修4 溶液酸碱性
- 格式:pptx
- 大小:978.04 KB
- 文档页数:28


溶液的酸碱性溶液的酸碱性是指溶液中的氢离子(H+)和羟离子(OH-)的相对浓度。
酸性溶液中,氢离子的浓度高于羟离子的浓度;碱性溶液中,羟离子的浓度高于氢离子的浓度;中性溶液中,氢离子和羟离子的浓度相等。
溶液的酸碱性对生物体的生理功能、工业生产和环境保护等领域都有着重要影响。
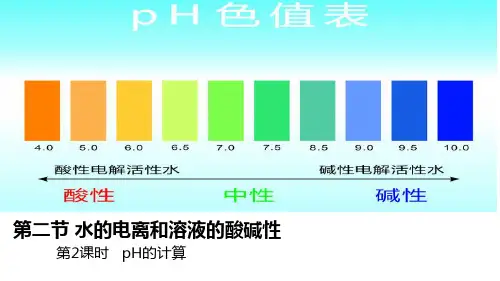
酸碱性的度量常利用pH值来表示。
pH的定义是pH=-log[H+],其中[H+]为溶液中氢离子的浓度。
pH值在0~14之间,数值越小表示酸性越强,0为最酸;数值越大表示碱性越强,14为最碱性。
中性溶液的pH值为7。
pH值的改变可能会造成化学反应、腐蚀、酶活性的改变等。
溶液酸碱性的调节与酸碱反应有关。
酸碱反应是发生在酸和碱之间的反应,其中酸和碱相互中和生成盐和水。
常见的酸碱反应有酸与碱反应、酸与金属反应、碱与金属反应等。
这些反应会导致令人感觉到的酸味、碱味和气味。
许多生物体利用酸碱反应进行生命活动。
比如,我们的胃酸能够帮助消化食物,维持胃内的酸性环境,抑制有害细菌的生长。
酸碱解离平衡是溶液酸碱性的重要因素。
酸和碱在水溶液中会发生解离,生成氢离子和羟离子。
酸的解离产生氢离子,而碱的解离产生羟离子。
强酸和弱酸的解离程度不同,会影响到溶液的酸碱性。
溶液中出现氢离子浓度的变化,会进一步影响pH值。
溶液酸碱性对生物体的影响很大。
细胞内的酸碱平衡对维持细胞的正常功能至关重要。
细胞内外的pH差异能够影响酶的活性,进而影响细胞的代谢功能。
酸碱平衡失调会导致酸中毒或碱中毒,严重时会危及生命。
在工业生产中,酸碱性也起到重要的作用。
许多化学反应需要在特定的酸碱条件下进行。
工业废水的酸碱性对环境保护也非常重要。
酸性废水对水体的生态环境会产生严重破坏,而碱性废水可能会引起水体的浑浊和大规模无菌。
为了调节溶液的酸碱性,人们常常采取一些方法。
最常用的方法是加入酸或碱物质来调节pH值。
例如,当溶液变得过酸性时,可以加入一些碱物质如氢氧化钠来中和溶液,提高pH值。

3.2《水的电离和溶液的酸碱性》学案(新人教版选修4)(第一课时)复习目标1、使学生了解水的电离和水的离子积,2、了解溶液的酸碱性与pH 的关系,3、学会计算酸碱的pH 值以及氢离子浓度和pH 值的互算,4、掌握pH 相同的强酸与弱酸的几个规律,5、了解指示剂的变色范围,学会用pH 试纸测定溶液的pH 值 一、水的电离与溶液的PH 值 1.水的电离 H 2O + H 2OH 3O + + OH —简写为:H 2OH + + OH—实验测定:25℃纯水中 C(H +)=C(OH -)=1710-⨯mol/L100℃ C(H +)=C(OH -) = 1610-⨯ mol/L2.水的离子积常数 k w = C(H +)·C(OH -常温下: k w = 3.影响Kw 大小的因素是:注意:任何物质的水溶液中,在常温时,K W = ,K W 与溶液的酸碱性无关,只与: 有关。
提问:当温度升高时,K w 如何变化?(电离过程是吸热过程)1000C 时,K w = c (H +)·c (OH —)=1×10-12影响因素:温度越高,Kw 越大,水的电离程度越大。
对于中性水,尽管Kw 、电离度增大,但仍是中性水,[H +]=[OH -].(注:温度升高时K w 增大,所以说K w 时要强调温度。
)例1:某温度下,纯水中的c (H +)=2.0×10-7mol/L ,则此时溶液中c (OH -)为 ;若温度不变,滴入稀硫酸使c (H +)=5.0×10-6mol/L ,则c (OH -)为 。
〖针对性训练〗1.某温度时,测得纯水中的C(H +)=2.4×10-7mol/L ,则C(OH -)为( )A .2.4×10-7mol/L B .0.1×10-7mol/L C .714104.2100.1--⨯⨯ mol/L D .C(OH -)无法确定2.水的电离过程为H 2O H ++OH -,不同温度下其离子积常数为k w (25℃)=1.0×10-14,k w (35℃)=2.1×10-14。

(人教版选修4)第三章《水溶液中的离子平衡》教学设计第二节水的电离和溶液的酸碱性(第二课时溶液pH的计算)【答案】 B【解析】 pH 计算方法为:酸按酸,碱按碱,酸碱混合看过量,无限稀释7为限。
稀释后A 项pH ≈7;B 项pH =9;C 项pH ≈9.7;D 项pH ≈7。
【板书】活动二、酸、碱溶液混合后pH 的计算方法【问题探究1】(1常温下,pH =2的盐酸与pH =4的盐酸,若按1∶10的体积比混合后,求混合溶液的c (H +)及pH 。
【交流】c (H +)=[1×10-2mol ·L -1+10×10-4mol ·L -1]/(1+10)L =1.0×10-3mol ·L -1,故溶液的pH =3。
【问题探究2】(2)常温下,将200 mL 5×10-3mol ·L -1NaOH 溶液与100 mL 2×10-2mol ·L-1NaOH 溶液混合后,求溶液的c (OH -)、c (H +)及pH 。
【交流】c (OH -)=1.0×10-2mol ·L -1,c (H +)=1.0×10-12mol ·L -1,pH =12。
【问题探究3】(3)常温下,pH =12的NaOH 溶液与pH =2的硫酸,若等体积混合后,求溶液的pH 为多少?若按9∶11的体积比混合后,溶液的pH 又为多少?【交流】先判断酸、碱谁过量,若酸过量,直接求c (H +)和pH ,若碱过量,则先求c (OH -),再求c (H +)和pH 。
可得前者酸碱恰好完全反应,则pH =7,后者酸过量pH =3。
【方法探究】强酸碱混合后溶液pH 的计算基本思路是什么?【交流1】(1)强酸与强酸混合:c (H +)混=c 1H +·V 1+c 2H +·V 2V 1+V 2,然后再求pH 。

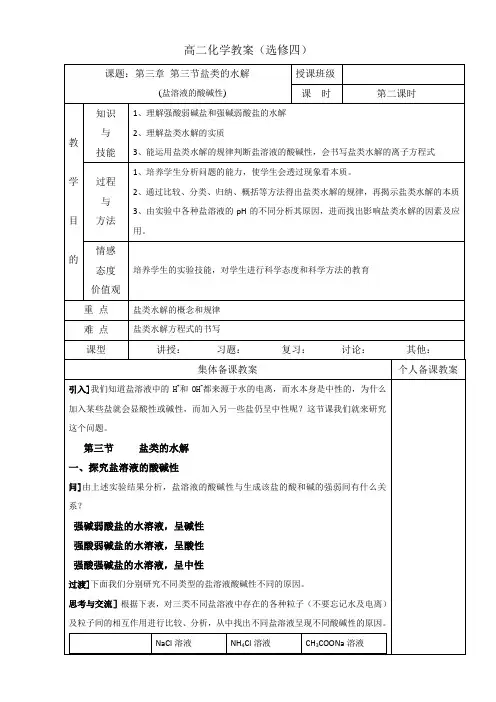
高二化学教案(选修四)C(H+)和C(OH-)相对大小C(H+)=C(OH-)C(H+)>C(OH-)C(H+)<C(OH-)溶液中的粒子Na+、Cl-、H+、OH-、H2O NH4+、Cl-、H+、NH3·H2O、OH-、H2OCH3COO H-、Na+、H+、OH-、H2O、CH3COOH有无弱电解质生成无有有相关化学方程式H2O H++OH-NaCl =Na+ + Cl-H2O H++OH-NH4++ OH-NH3·H2OH2O H++OH-CH3COO- + H+CH3COOH二、盐溶液呈现不同酸碱性的原因讲]CH3COONa溶于水之后,完全电离。
(因为CH3COONa是强电解质。
)投影]CH3COONa ═ CH3COO- + Na+………⑴问]把CH3COONa溶于水之后,溶液中存在哪些电离平衡?投影] H2O H+ + OH-………⑵讲]我们知道,CH3COOH是一种弱酸,在溶液中部分电离,溶液中既然存在CH3COO-和H+,根据,可逆反应,反应物和生成物同时共存,那么就一定有CH3COOH。
投影]CH3COO- + H+ CH3COOH………⑶讲]把⑴⑵⑶式联立,可得到投影]水解方程式:CH3COONa + H2O CH3COOH + NaOH讲]这说明CH3COONa溶于水后,反应有NaOH生成,所以溶液显碱性。
把上述化学方程式改写成离子方程式。
投影]CH3COO- + H2O CH3COOH + OH-讲]随着CH3COONa的加入,对水的电离有什么影响呢?促进了水的电离,可以看作是使水分解了。
醋酸钠与水反应的实质是:醋酸钠电离出的醋酸根离子和水电离出的氢离子结合生成弱电解质醋酸的过程。
投影]1、弱酸强碱盐,水解显碱性 CH3COONa = CH3COO−+ Na+投影]2、强酸弱碱盐,水解显酸性 NH4Cl = NH4+ + Cl−投影]3、强酸强碱盐:不水解4、弱酸弱碱盐:双水解,水解程度增大。

第三章物质在水溶液中的行为(一)水溶液1、水的电离和水的离子积水是一种极弱的电解质,存在以下电离平衡2H2O H3O++OH-,ΔH>0 简写为:H2O H++OH-;ΔH>0。
25℃时,c(H+)=c(OH-)=10-7mol·L-1水的电离程度: 1.8×10-7%水的离子积:K W=c(H+)·c(OH-)=10-14(25℃ )理解K W时要留意:(1)K W与温度有关,由于水的电离过程是吸热过程,所以温度上升,有利于水的电离,K W增大。
如100℃时,K W =10-12。
(2)K W 不仅适用于纯水,还适用于酸性或碱性的稀溶液。
不管哪种溶液均有如酸性溶液中{c(H+)酸+}·=K W碱性溶液中:{c(OH-)碱+} ·=K W(3)K W与c(H+)及c(OH-)的计算对于水溶液,要精确求算c(OH-)、c(H+)的大小,可依靠K W来计算。
对于中性溶液(或纯水),c(H+)=c(OH-)=。
而酸性溶液,若已知c(H+)、c(OH-)其中之一,另一种离子的浓度即可代入关系:K W=c(H+)c(OH-)求出。
应留意的是:在酸、碱性很弱的溶液中c(H+)和c(OH-)都很小,这时由水电离生成的c(H+)和c(OH-)与酸或碱供应的c(H+)或OH-的浓度较接近,因而不行忽视由水电离生成的c(H+)和c(OH-),应考虑水电离出来的c(H+)和OH-的浓度、并将总的离子浓度代入水的离子积常数关系式中进行求解。
(4)影响水电离平衡的外界因素:(1)酸、碱:抑制水的电离(pH之和为14的酸和碱的水溶液中水的电离被同等的抑制)(2)温度:促进水的电离(水的电离是吸热的)(3)易水解的盐:促进水的电离(pH之和为14两种水解盐溶液中水的电离被同等的促进)2、溶液的酸碱性和pH(1)溶液的酸碱性取决于溶液中c(H+)与c(OH-)的相对大小。
(2)pH:①水溶液里的H+浓度的负对数叫做pH,即pH=-lgc(H+)。



苏教版高中化学选修四32《溶液的酸碱性pH的简单计算》参考教专题单元节题知识与技能教学目标过程与方法情感态度与价值观专题4溶液中的离子反应第二单元溶液的酸碱性第1、2课时溶液的酸碱性了解溶液pH的定义,能进行pH的简单计算。
通过实验联想、比较等培养学生的想象能力和思维能力通过溶液PH的测定,何会化学在生产生活中的应用。
pH的简单计算pH的简单计算讨论法学生主体活动练习口答、检查25℃[H+]·[OH—]=10—7=10—14=Kw[阅读]P71本质对照表3—6大于7显碱性,小于7显酸性等于7显中性学生主体活动不湿润注意:强酸直接由[H+]总求pH值强碱由[OH—]总求pOH,后再求pH值(注意)先判断显性离子!教学课题教学重点教学难点教学方法教师主导活动教学过程[知识回顾]写出醋酸、一水合氨溶于水和水的电离方程式:CH3COOHCH3COO-+H+NH3·H2ONH4++OH—H2OH++OH—水的离子积常数[完成下表]溶液酸碱性酸性中性碱性c(H+)与c(OH—)关系任意温度室温(mol/L)pH值(室温)小于77大于7c(H+)>c(OH—)c(H+)=c (OH—)c(H+)①若pH酸+pH碱=14,则完全中和pH=7.②若pH酸+pH碱>14,则碱过量pH≈pH碱-0.3③若pH酸+pH碱<14,则酸过量pH≈pH酸+0.3[分析]①呈中性:即pH=7.nH+=nOH—10—a·V1=10—(14-b)·V2V1:V2=10—14+a+b10n=10a+b-14n=a+b-14a+b=14+n②若呈酸性.即pH<7nH+>nOH—10—a·V1>10—(14-b)·V2V1:V2>10—14+a+b10n>10-14+a+ba+b<14+n③若呈碱性,即pH>7,同理可知a+b>14+n教学过程教师主导活动学生主体活动3.关于酸、碱混合时的定性判断(常温)酸与碱混合时发生中和反应,但不一定恰好完呈中和。
第二节水的电离和溶液的酸碱性(教学设计)
【知识技能】
了解水的离子积的含义;掌握[H+]和[OH-]与溶液酸碱性的关系;初步学会有关水的离子积的简单计算。
【过程与方法】
通过学生自主设计实验方案,培养学生发现问题、思考问题的能力;观察动画和问题探究与讨论,培养学生分析问题的能力和归纳、总结、概括知识的能力。
【情感态度与价值观】
通过水的离子积和溶液酸碱性等内容的教学,对学生进行矛盾的对立统一、事物间的相互联系和相互制约、透过现象看本质等辩证唯物主义教育。
【重点、难点】
水的离子积常数的概念;溶液酸碱性与[H+]和[OH-]的关系。
【教学过程】
计
H
H
H H
H。
高中化学第三章第二节溶液的pH及计算学案2新人教版选修4第一篇:高中化学第三章第二节溶液的pH及计算学案2新人教版选修4溶液的pH4、有关pH的简单计算【例12】25℃,将pH=9与pH=12的两种强碱溶液等体积混合,求混合后溶液的pH结论:⑷强碱与强碱混合:先计算溶液中,再根据Kw计算溶液中,再运用pH定义式注意:①等体积混合时,pH混(pH1+pH2)/2 ②当△pH≥2 pH混=【例13】25℃,0.2 mol/L HCl溶液与0.5 mol/LBa(OH)2溶液等体积混合,求混合后溶液的pH 【例14】25℃,将pH=2与pH=11的强酸和强碱溶液等体积混合,求混合后溶液的pH【例15】25℃,pH=1强酸溶液和pH=13的强碱溶液等体积混合,求混合后溶液的pH结论:⑸强酸强碱混合溶液,应先比较n(H)和n(OH)大小若n(H)>n(OH),则酸过量,先求剩余,再求pH 若n(OH)>n(H),则碱过量,先求余,再利用_______求最后求pH。
【例16】用纯水稀释pH=4的盐酸溶液至⑴ 10倍⑵ 100倍⑶ 1000倍⑷ 100000倍求稀释后溶液的pH。
【例17】pH=4的CH3COOH溶液稀释100倍,求稀释后溶液的pH变化范围【例18】25℃,用纯水稀释pH=10的NaOH溶液至⑴ 10倍⑵ 100倍⑶ 1000倍⑷ 100000倍求稀释后溶液的pH。
【例19】25℃,pH=13的NH3·H2O溶液稀释100倍,求稀释后溶液的pH变化范围-++-+-结论:(6)稀释问题① 若将强酸冲稀10,pH增大个单位,若弱酸稀释则但若无限冲稀,pH接近于但②若将强碱冲稀10,pH减小个单位。
若是弱碱稀释则但若无限冲稀,pH接近于但练习1、甲、乙两溶液的pH值分别为6和8,下列叙述中不正确的是A.甲的H数目是乙的100倍C.乙不可能是稀醋酸+nnB.甲不可能是稀氨水D.甲不可能是强酸溶液,乙不可能是强碱溶液2、将pH=3的H2SO4溶液和pH=12的NaOH溶液混和,若使混和后溶液的pH=7,则 H2SO4溶液和NaOH溶液的体积比是A.1︰20 B.1︰10 C.20︰1 D.10︰13、1体积pH=2.5的盐酸与10体积某一元强碱溶液恰好完全反应,则该碱溶液的pH为A.9.0 B.9.5 C.10.5 D.11.04、现有pH=a和pH=b的两种NaOH溶液,已知b=a+2,将两种溶液等体积混和后,所得溶液的pH值接近于A.a-lg2 B.b-lg2 C.a+lg2 D.b+lg25、对重水也可用定义pH一样定义pD=-lgc(D),现已知重水的离子积为1.6×10下关于pD的叙述正确的是A.中性溶液pD等于7 B.在D2O中溶解0.01mol DCl配成1升溶液,则pD等于2.0 C.在D2O中溶解0.01mol NaOD配成1升溶液,则pD等于12.0 D.当由重水电离出来的c(D)等于10+—13+—15,以mol/L时,溶液的pD等于1或136、为更好表示溶液的酸碱性,科学家提出了酸度(AG)的概念,AG=lg,则下列叙述正确的是 A.中性溶液的AG=0B.常温下0.lmol/L氢氧化钠溶液的AG=12 C.酸性溶液的AG <0D.常温下0.lmol/L盐酸溶液的AG=127、在25℃时,水的离子积常数KW=1×10—14,在100℃时,KW=1×10—1,说明A.水的电离过程是一个吸热过程B.100℃时,KW较大C.KW 与电离平衡无直接关系++D.25℃时的c(H)比100℃的时c(H)大8、往纯水中加入下列物质,能使水的电离平衡发生移动的是A.NaCl固体B.NaOH固体 C.乙醇D.CH3COOH第二篇:高中化学选修4教学设计有关pH的简单计算第二课时教学目的:1、了解指示剂的变色范围,学会用pH试纸测定溶液的pH值2、初步学会计算酸碱的pH值以及氢离子浓度和pH值的互算3、掌握pH相同的强酸与弱酸的几个规律教学重点:有关pH的简单计算教学难点:熟练掌握有关pH的计算教学过程:复习提问:—①什么叫水的离子积?影响水的离子积因素?溶液的酸碱性与c(H+)、c(OH)及pH的关系?溶液pH的计-算?求0.1mol/L盐酸溶液中的[OH]?(25℃)求0.1mol/LnaOH溶液中[H+]?+②关于pH相同的酸(含强酸和弱酸)(1)溶液中c(H)相等(填“相等”或“不等”)。