高中化学复习知识点:溶液的酸碱性与pH的关系
- 格式:docx
- 大小:141.35 KB
- 文档页数:11

化学高考知识点ph化学高考知识点 - pHpH(potential of hydrogen)是用来表示溶液酸碱程度的指标,它是对数形式的无量纲数值。
pH值的范围从0到14,其中7表示中性溶液,小于7表示酸性溶液,大于7表示碱性溶液。
本文将讨论pH的基本概念、计算方法以及与化学高考相关的一些知识点。
1. pH的定义和表示方法pH定义为负 logarithm(以10为底)的H+(氢离子)浓度,即:pH = -log[H+]在水溶液中,水分解产生一定数量的H+和OH-(氢氧根离子),它们的乘积恒定为常数,即:[H+][OH-] = 1.0 x 10^-14 mol^2/L^2由于[H+] = [OH-],我们可以计算出:[H+] = [OH-] = 1.0 x 10^-7 mol/L因此,中性溶液的pH值为7。
2. 酸性和碱性溶液的pH值对于酸性溶液,[H+]的浓度大于1.0 x 10^-7 mol/L,因此pH值小于7。
pH的大小与[H+]的浓度呈反比关系,即[H+]越高,pH值越低,溶液越酸性。
对于碱性溶液,[H+]的浓度小于1.0 x 10^-7 mol/L,因此pH值大于7。
与酸性溶液类似,碱性溶液的pH值与[H+]的浓度呈反比关系。
需要注意的是,pH值的范围并非线性的,而是对数关系。
例如,pH值为6的溶液比pH值为7的溶液酸性要强10倍,而不是只是稍微酸一点。
3. pH值的测量pH值可以使用pH计或指示剂来测量。
pH计是最常用的测量工具,通过电极测量溶液中的电位差来计算pH值。
指示剂则根据溶液的颜色变化来估计pH值。
4. pH与化学反应的影响pH值的变化对于许多化学反应和生物过程具有重要影响。
酸碱中和反应是其中之一。
酸与碱反应会产生盐和水,使溶液的pH值趋于中性。
在酸性条件下,金属会与强酸反应生成金属盐和氢气。
例如,铁与盐酸反应会生成氯化铁和氢气。
在碱性条件下,氧化还原反应也会受到影响。
例如,氯气可以在碱性溶液中获得电子并还原为氯化物离子。

溶液的酸碱性与pH值溶液的酸碱性是指溶液中酸性物质和碱性物质的相对浓度。
酸碱性的强弱可以通过pH值来表示。
pH值是一个表示溶液酸碱性强弱的指标,其数值范围从0到14。
pH值小于7的溶液称为酸性溶液,pH值大于7的溶液称为碱性溶液,pH值等于7的溶液称为中性溶液。
溶液的酸碱性与其中溶解的酸性物质和碱性物质的特性和浓度有关。
在溶液中,酸质子(H+)和碱质子(OH-)是起主要作用的离子。
酸性溶液中质子的浓度高于水,而碱性溶液中质子的浓度低于水。
而中性溶液中酸性物质和碱性物质的浓度相等,质子的浓度与水相等。
酸性溶液的pH值通常小于7,其原因是酸性物质可以释放出质子(H+)离子,增加溶液中质子的浓度。
酸性物质中常见的有硫酸、盐酸、硝酸等。
这些物质会与水分子发生反应,将水分子中的一个氢原子取代,形成H+离子。
碱性溶液的pH值通常大于7,其原因是碱性物质可以释放出氢氧根离子(OH-)或接受质子。
碱性物质中常见的有氢氧化钠、氢氧化钾、氢氧化铵等。
这些物质在水中形成氢氧根离子和金属离子,氢氧根离子会与溶剂中的质子结合,减少溶液中质子的浓度。
酸性和碱性溶液之间可以相互中和。
当酸性溶液和碱性溶液混合时,质子和氢氧根离子会相互结合,生成水分子。
在这个反应过程中,溶液的酸碱性随着质子和氢氧根离子的浓度变化而改变。
pH值的改变取决于酸性和碱性物质的浓度和反应的平衡。
pH值的测量通常使用酸碱指示剂、pH计或电极进行。
酸碱指示剂是一种化学物质,可以通过改变其颜色来指示溶液的酸碱性。
pH计和电极则通过测量溶液中电离质子的浓度来确定pH值。
总之,溶液的酸碱性与其中溶解的酸性物质和碱性物质的浓度有关。
pH值是一种表示溶液酸碱性强弱的指标,其范围从0到14。
酸性溶液的pH值通常小于7,碱性溶液的pH值通常大于7,中性溶液的pH值为7。
通过使用酸碱指示剂、pH计或电极,可以准确测量溶液的pH值,以判断其酸碱性。

高三化学溶液的酸碱性与pH 的关系知识精讲 鲁教版【本讲教育信息】一. 教学内容:高考第一轮复习《化学选修4》第3章 物质在水溶液中的行为 第1节 溶液的酸碱性与pH 的关系 1、水的电离平衡和水的离子积。
2、影响水电离平衡的因素。
3、溶液的酸碱性与pH 关系。
4、pH 的有关计算。
二. 教学目的1、理解水的电离平衡和离子积的概念。
2、掌握影响水的电离平衡的因素。
3、掌握溶液的酸碱性和pH 的关系。
4、初步学会有关pH 的简单计算。
三. 重点和难点1、水的电离平衡和离子积的概念。
2、溶液酸碱性和pH 的关系及有关pH 的计算。
四. 考点分析本节内容在高考中的主要考查点是: 1、水的电离平衡和水的离子积。
2、利用水的离子积进行有关计算。
3、溶液的酸碱性与pH 的关系及有关pH 的计算。
4、影响水的电离平衡的因素。
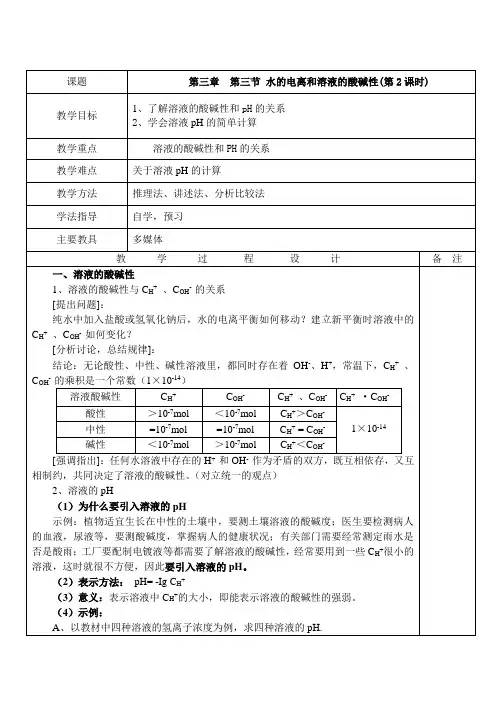
五. 知识要点 (一)水的电离1. 水是一种极弱的__________,它能微弱的电离,电离方程式是____________________,25℃时,1L 纯水中有__________mol 水电离,=+)H (c __________,=-)OH (c __________。
2. 水的离子积常数=w K __________,室温时=w K __________,升温时,水的电离平衡__________移动,)OH (c )H (c -+=__________=-w 7K ,L /mol 10__________。
100℃时纯水中=+)H (c L /mol 10)OH (c 6--=,则=w K __________。
3. 水的电离是吸热的,故升温,水的电离平衡向___________移动,降温,电离平衡向__________移动,降温时水电离出的)OH (c )H (c -+和都__________。
(二)溶液的酸碱度1. 溶液酸碱性的本质判断标准是__________,25℃时,酸性溶液的判断标准是__________、__________或__________;碱性溶液的判断标准有__________、__________、__________;中性溶液的判断标准还有__________、__________、__________。

溶液的酸碱性与pH值简介:溶液的酸碱性是指溶液中所含酸性物质和碱性物质的相对含量及其对水溶液的影响程度。
而pH值则是用来表示溶液酸碱性强弱的指标。
本文将探讨溶液的酸碱性是如何与pH值相关联的。
1. 酸性溶液酸性溶液含有过量的酸性物质,它们以游离的H+离子存在于溶液中。
酸性物质会释放出H+离子,然后与水分子中的OH-离子结合形成水分子。
在酸性溶液中,pH值低于7。
酸性物质可以是无机酸,如硫酸、盐酸,或有机酸,如柠檬酸、醋酸。
2. 碱性溶液碱性溶液则相反,它们含有过量的碱性物质,以游离的OH-离子存在于溶液中。
碱性物质会释放出OH-离子,然后与水分子中的H+离子结合形成水分子。
在碱性溶液中,pH值高于7。
碱性物质主要指无机碱,如氢氧化钠、氢氧化钙,或有机碱,如胺类物质。
3. 中性溶液中性溶液中,酸性物质和碱性物质的相对含量相等,游离的H+离子和OH-离子的浓度相互抵消,导致pH值等于7。
其中,最常见的中性溶液是纯水。
纯水在25摄氏度下,它自己的离子生成的浓度是10的负7次方,所以它的pH值是7。
4. pH值的计算pH值是用来表示溶液酸碱性强弱的无量纲指标。
它的计算公式为pH = -log[H+],其中[H+]为溶液中H+离子的浓度。
若已知溶液中H+离子的浓度,则可以通过计算-log[H+]来得到溶液的pH值。
例如溶液中H+离子浓度为0.001mol/L,则-pH = -log(0.001) = 3,所以该溶液的pH值为3。
5. pH值的重要性pH值对生物体和环境起着重要的影响。
人体内部的许多生化反应都对酸碱度非常敏感,特定的生理功能只在适宜的pH值下才能正常进行。
许多生物体的内部环境都是弱碱性的,维持在适宜的pH范围内有助于细胞的正常运作。
此外,环境中的水体、土壤等的pH值也对其中的微生物生态和植物生长产生重要影响。
总结:溶液的酸碱性与pH值是密切相关的。
酸性溶液含有过量的H+离子,pH值低于7;碱性溶液含有过量的OH-离子,pH值高于7;中性溶液中H+离子和OH-离子的浓度相等,pH值为7。

《溶液的酸碱性与 pH》知识清单一、溶液的酸碱性在化学中,我们常常需要判断溶液的酸碱性。
溶液的酸碱性取决于溶液中氢离子(H⁺)和氢氧根离子(OH⁻)的相对浓度。
当溶液中氢离子浓度大于氢氧根离子浓度时,溶液呈酸性;反之,当氢氧根离子浓度大于氢离子浓度时,溶液呈碱性;如果氢离子浓度等于氢氧根离子浓度,溶液则呈中性。
例如,常见的盐酸(HCl)溶液就是酸性的,因为在盐酸溶液中,HCl 会解离出氢离子(H⁺)和氯离子(Cl⁻),使得溶液中氢离子浓度增加,表现出酸性。
而氢氧化钠(NaOH)溶液是碱性的,因为NaOH 会解离出钠离子(Na⁺)和氢氧根离子(OH⁻),导致溶液中氢氧根离子浓度增大,呈现碱性。
我们日常生活中也有很多与溶液酸碱性相关的例子。
比如,柠檬汁是酸性的,肥皂水是碱性的。
二、pH 的定义为了更方便地表示溶液的酸碱性强弱程度,科学家引入了 pH 的概念。
pH 是指溶液中氢离子浓度的负对数。
pH 的计算公式为:pH = lgH⁺,其中 H⁺表示溶液中氢离子的物质的量浓度,单位为 mol/L。
例如,如果某溶液中氢离子浓度为 001 mol/L,那么该溶液的 pH 为:pH = lg(001) = 2三、pH 的范围pH 的取值范围通常在 0 到 14 之间。
当 pH < 7 时,溶液呈酸性,且 pH 值越小,酸性越强。
当 pH = 7 时,溶液呈中性。
当 pH > 7 时,溶液呈碱性,且 pH 值越大,碱性越强。
需要注意的是,pH = 0 表示氢离子浓度为 1 mol/L 的极强酸性溶液,而 pH = 14 则表示氢氧根离子浓度为 1 mol/L 的极强碱性溶液。
四、pH 的测量方法1、 pH 试纸pH 试纸是一种常见且简便的测量溶液 pH 的工具。
使用时,将一小段 pH 试纸浸入待测溶液中,然后迅速取出,与标准比色卡对比,即可大致确定溶液的 pH 值。
但 pH 试纸的测量精度相对较低,一般只能精确到整数。

溶液的酸碱性理解溶液的酸碱性与pH值的关联溶液的酸碱性理解与pH值的关联溶液的酸碱性是指溶液中溶解的酸性物质或碱性物质的含量。
通常用pH值来表示溶液的酸碱性强弱,pH值越小,表示溶液越酸;pH值越大,表示溶液越碱;而pH值为7时表示溶液是中性的。
正常情况下,水的自离子化产生同等浓度的氢离子(H+)和氢氧根离子(OH-),pH值为7,呈中性。
当溶液中含有酸性物质时,会释放出氢离子,使pH值下降,溶液变得酸性。
而含有碱性物质的溶液,则会释放出氢氧根离子,使pH值上升,溶液变得碱性。
pH值的计算是基于溶液中氢离子的浓度,由公式pH=-log[H+]得出。
pH值的范围从0到14,其中7为中性,低于7的溶液偏酸,高于7的溶液偏碱。
酸性溶液中的酸成分能够与水分子反应而产生氢离子,增加溶液中氢离子的浓度,使pH值下降。
常见的酸性物质有盐酸、硫酸等。
例如,将盐酸溶解在水中,盐酸分子将会解离成氢离子和氯离子,氢离子的浓度增加,导致溶液呈酸性;硫酸也会产生与盐酸类似的效果。
碱性溶液中的碱成分会与水分子反应生成氢氧根离子,增加溶液中氢氧根离子的浓度,使pH值升高。
常见的碱性物质有氢氧化钠、氢氧化钙等。
例如,将氢氧化钠溶解在水中,氢氧化钠分子会解离成氢离子和氢氧根离子,氢氧根离子的浓度增加,导致溶液呈碱性;氢氧化钙也会产生与氢氧化钠类似的效果。
除了酸性和碱性之外,还有一种溶液被称为中性溶液,其pH值为7。
中性溶液中的氢离子和氢氧根离子的浓度相等,所以呈中性。
例如,纯净的水即为中性溶液。
需要注意的是,pH值是对溶液酸碱性的定量衡量,但并不能反映酸碱溶液的强度。
有时候溶液的酸碱性强度需要通过其他方法来判断,如指示剂的变色反应。
总而言之,溶液的酸碱性与pH值有着密切的关联。
pH值的大小反映了溶液中氢离子或氢氧根离子的浓度,从而表征了溶液的酸碱性强弱。
了解溶液的酸碱性及其与pH值的关联对于化学实验、生活以及环境保护等方面都具有重要意义。

考点45 溶液的酸碱性及pH一、溶液的酸碱性与pH1.溶液的酸碱性(25 ℃时)溶液的酸碱性c(H+)与c(OH-) 比较c(H+)大小pH酸性溶液c(H+)>c(OH-) c(H+)>1×10-7mol·L-1<7中性溶液c(H+)=c(OH-) c(H+)=1×10-7mol·L-1=7碱性溶液c(H+)<c(OH-) c(H+)<1×10-7mol·L-1>72.溶液的pH(1)定义:pH=−lg c(H+)。
(2)pH 与溶液中c(H+)的关系①25 ℃,纯水的pH=7,溶液呈中性;pH<7的溶液呈酸性;pH>7的溶液呈碱性。
②pH表示溶液的酸碱性及其强弱:25 ℃时,pH(<7)越小,溶液的酸性越强;pH(>7)越大,溶液的碱性越强。
(3)pH的适用范围常温下,当溶液的酸碱性用pH表示时,一般情况下,1×10−14 mol·L−1<c(H+)<1 mol·L−1,即14>pH>0。
pH=0的溶液中并非无H+,而是c(H+)=1 mol·L−1;pH=14的溶液中并非无OH−,而是c(OH−)=1 mol·L−1。
当c(H+)>1 mol·L−1时,一般不用pH表示溶液的酸碱性,用c(H+)或c(OH−)直接表示溶液的酸碱性更方便。
注意:(1)未指明温度时,pH=7不代表溶液呈中性,如100 ℃时,pH=6为中性溶液。
(2)溶液的酸碱性也可以用pOH表示:pOH=−lg c(OH−)。
因为常温下,c(OH−)·c(H+)=10−14,若两边均取负对数得:pH+pOH=14。
3.pH的测定方法pH试纸的使用方法:取一片pH试纸,放在洁净的表面皿或玻璃片上,用洁净干燥的玻璃棒蘸取待测液点于试纸中央,然后与标准比色卡对照读出数值。