第二章 第二节 分子的立体结构 (第3课时)
- 格式:ppt
- 大小:1.64 MB
- 文档页数:36



第二章 第二节 第3课时A 级·基础达标练一、选择题(每小题只有1个选项符合题意)1.甲烷中的碳原子采用sp3杂化,下列用*标注的碳原子的杂化类型和甲烷中的碳原子的杂化类型一致的是( A )A.CHCH2CH3B.*CH2==CHCH3C.CH2==*CHCH2CH3D.HC≡*CCH3解析:CH4中碳原子为饱和碳原子,采用sp3杂化。
A项,亚甲基碳原子为饱和碳原子,采用sp3杂化;B、C项,C===C中的不饱和碳原子采用sp2杂化;D项,C≡C中的不饱和碳原子采用sp杂化。
2.BF3是典型的平面三角形分子,它溶于氢氟酸或NaF溶液中都形成BF,则BF3和BF中B原子的杂化轨道类型分别是( C )A.sp2、sp2 B.sp3、sp3C.sp2、sp3 D.sp、sp23.下列分子所含碳原子中,既有sp3杂化,又有sp2杂化的是( A )A.乙醛B.丙烯腈C.甲醛D.丙炔解析:乙醛中甲基的碳原子采取sp3杂化,醛基中的碳原子采取sp2杂化;丙烯腈中碳碳双键的两个碳原子均采取sp2杂化,另一个碳原子采取sp杂化;甲醛中碳原子采取sp2杂化;丙炔中甲基的碳原子采取sp3杂化,碳碳三键中两个碳原子均采取sp杂化。
4.化合物A是一种新型锅炉水除氧剂,其结构式如图所示:,下列说法正确的是( B )A.碳、氮原子的杂化类型相同B.氮原子与碳原子分别为sp3杂化与sp2杂化C.1 mol A分子中所含σ键为10 molD.编号为a的氮原子和与其成键的另外三个原子在同一平面内解析:A分子中碳、氮原子各形成了3个σ键,氮原子有一对孤电子对而碳原子没有,故氮原子是sp3杂化而碳原子是sp2杂化,A项错误,B项正确;A分子中有一个碳氧双键,故有12对共用电子对、11个σ键,C项错误;由于氮原子为sp3杂化,故相应的四个原子形成的是三角锥形结构,不可能共平面,D项错误。
5.下列分子中,各分子的空间构型、中心原子的杂化方式以及孤电子对数均正确的是( B )选项分子空间构型杂化方式孤电子对数A NH3平面三角形sp3杂化N含有一对孤电子对B CCl4正四面体sp3杂化C不含有孤电子对C H2O V形sp2杂化O含有两对孤电子对D CO三角锥形sp3杂化C含有一对孤电子对解析:NH3中心原子的价层电子对数=3+(5-3×1)=4,N原子的杂化方式为sp3,含有一对孤电子对,分子的立体构型为三角锥形,A项错误;CCl4中心原子的价层电子对数=4+(4-4×1)=4,C原子的杂化方式为sp3,没有孤电子对,分子的立体构型为正四面体,B项正确;H2O中心原子的价层电子对数=2+(6-2×1)=4,O原子的杂化方式为sp3,含有两对孤电子对,分子的立体构型为V形,C项错误;CO中心原子的价层电子对数=3+(4+2-3×2)=3,C原子的杂化方式为sp2,没有孤电子对,分子的立体构型为平面三角形,D项错误。




第三课时教学目标1、配位键、配位化合物的概念2、配位键、配位化合物的表示方法3、采用图表、比较、讨论、归纳、综合的方法进行教学4、培养学生分析、归纳、综合的能力教学重点配位键、配位化合物的概念教学难点配位键、配位化合物的概念教学过程[创设问题情景]什么是配位键?配位键如何表示?配位化合物的概念?学生阅读教材,然后讨论交流。
1、配位键⑴概念共用电子对由一个原子单方向提供给另一原子共用所形成的共价键。
⑵表示A B电子对给予体电子对接受体⑶条件:其中一个原子必须提供孤对电子。
另一原子必须能接受孤对电子轨道。
[提问]举出含有配位键的离子或分子举例:H3O+NH4+[过渡]什么是配位化合物呢?[讲解]金属离子或原子与某些分子或离子以配位键结合而形成的化合物称为配合物。
[过渡]配位化合物如何命名?[讲解] 硫酸四氨合铜[学生练习命名][Cu(NH3)4]Cl2K3[Fe(SCN)6]Na3[AlF6][小结]本节主要讲述了配位键和配位化合物。
[练习]1、铵根离子中存在的化学键类型按离子键、共价键和配位键分类,应含有A、离子键和共价键B、离子键和配位键C、配位键和共价键D、离子键2、下列属于配合物的是A、NH4ClB、Na2CO3.10H2OC、CuSO4. 5H2OD、Co(NH3)6Cl33、下列分子或离子中,能提供孤对电子与某些金属离子形成配位键的是①H2O ②NH3③F—④CN—⑤COA、①②B、①②③C、①②④D、①②③④⑤4、配合物在许多方面有着广泛的应用。
下列叙述不正确的是A、以Mg2+为中心的大环配合物叶绿素能催化光合作用。
B、Fe2+的卟啉配合物是输送O2的血红素。
C、[Ag(NH3)2]+是化学镀银的有效成分。
D、向溶液中逐滴加入氨水,可除去硫酸锌溶液中的Cu2+。
5.下列微粒:①H3O+②NH4+③CH3COO-④ NH3⑤CH4中含有配位键的是A、①②B、①③C、④⑤D、②④6.亚硝酸根NO2-作为配体,有两种方式。

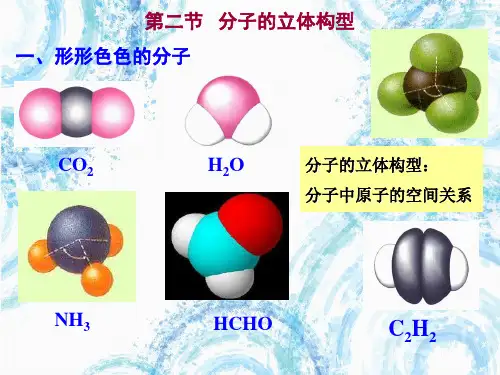
化学选修三第二章第二节分子的立体构型2选修三第二章第2节 分子的立体构型 第2节 分子的立体构型一、常见分子的空间构型1.双原子分子都是直线形,如:HCl 、NO 、O 2、N 2 等。
2.三原子分子有直线形,如CO 2、CS 2等;还有“V ”形,如H 2O 、H 2S 、SO 2等。
3.四原子分子有平面三角形,如BF 3、BCl 3、CH 2O 等; 有三角锥形,如NH 3、PH 3等; 也有正四面体,如P 4。
4.五原子分子有正四面体,如CH 4、CCl 4等,也有不规则四面体,如CH 3Cl 、CH 2Cl 2、CHCl 3。
另外乙烯分子和苯分子都是平面形分子。
二、价层电子对互斥理论(Valance Shell Electron Pair Repulsion Theory )简称VSEPR 适用AD m 型分子1、理论模型分子中的价电子对(包括成键电子对和孤电子对),由于相互排斥作用,而趋向尽可能彼此远离以减小斥力,分子尽可能采取对称的空间构型。
2、用价层电子对互斥理论推断分子或离子的空间构型的一般步骤: (1)确定中心原子A 价层电子对数目 法1.经验总结中心原子的价层电子对数=21(中心离子价电子数+配对原子提供电子总数)对于AB m 型分子(A 为中心原子,B 为配位原子),计算方法如下: n =中心原子的价电子数+每个配位原子提供的价电子数×m 2注意:①氧族元素的氧做中心时:价电子数为 6, 如 H 2O ,H 2S ;做配体时:提供电子数为 0,如在 CO 2中。
②如果讨论的是离子,则应加上或减去与离子电荷相应的电子数。
如PO -34中P 原子价层电子数5+(0×4)+3 = 8;NH +4 中N 原子的价层电子数5+(1×4)-1 = 8。
③结果为单电子时视作有一个电子对。
例:IF 5 价层电子对数为21[7+(5×1)] = 6对 正八面体(初步判断)N H +4 价层电子对数为21[5+(4×1)-1] = 4对 正四面体 PO -34 价层电子对数为21[5+(0×4)+3] = 4对 正四面体 NO 2 价层电子对数为21[5+0] = 2.5−→−3对 平面三角形 法2. 确定中心原子A 价层电子对数目-----普遍规则中心原子A 价层电子对数目=成键电子对数+孤对电子数 (VP = BP + LP )VP是价层电子对,BP是成键电子对(BOND ),LP是孤对电子对(LONE PAIR)VP = BP + LP =与中心原子成键的原子数+中心原子的孤对电子对数LP=配位原子数+LPLp =21(中心原子价电子数—配位原子未成对电子数之和)IF5Lp =21[7-(5×1)] = 1 构型由八面体−→−四方锥NH+4Lp =21[(5-1)-(4×1)] = 0 正四面体PO-34Lp =21[(5+3)-(4×2)] = 0 正四面体SO-24Lp =21[(6+2)-(4×2)] = 0 正四面体NO2Lp =21[5-(2×2)] =21−→− 1 构型由三角形−→−V形SO-23Lp =21[(6+2)-(3×2)] = 1 构型由四面体−→−三角锥法3:由Lewis结构式或结构式直接写出,双键、三键都是1对电子PClClClClCl PCl Cl ClPClClClCl+ClPClClClClCl-ClClClCl+ClPClClClClCl-VP: 5 4 4 6 4(2)价层电子对数目23456价层电子对构型直线形三角形四面体三角双锥八面体(3)价层电子对互斥模型说明的是价层电子对的空间构型,而分子的空间构型指的是成键电子对空间构型,不包括孤对电子。