人教版 九年级 化学 原子的构成
- 格式:doc
- 大小:67.88 KB
- 文档页数:8


原子的构成
1、原子的构成:原子是由原子核(质子和中子)和核外的电子构成,但并不是所有的原子都有中子(氢原子就没有中子),每个质子带一个单位的正电荷,每个电子带一个单位的负电荷,中子不带电。
2、原子呈电中性:由于原子核内质子所带的电荷数和核外电子所带的电荷数相等,但电性相反,因此原子不显电性。
3、原子核外电子的排布规律:原子的电子在原子核外是分层排布的,原子最少一个电子层,最多7个电子层,第一层最多排2个电子,第二层最多排8个电子,最外层不得超过8个电
2n
子,其规律为:2
4、1-18号元素的原子结构示意图
5、原子最外层电子数规律金属元素的原子最外层电子一般少于4个,反应时容易失去最外层电子,变成阳离子。
;非金属元素原子最外层一般多余4个电子,反应时一般容易得到电子变成阴离子;稀有气体元素原子最外层为2个电子(一个电子层)或8个电子,反应时不容易得失电子,是一种、稳定结构。
6、原子中的等量关系:质子数=核电荷数=核外电子数=等于原子序数
7、相对原子质量:是一个比值,相对原子质量=质子数+中子数。

课题2 原子结构第1课时 原子的构成 相对原子质量【基础 主干落实】 一、原子的构成 1.原子的构成特别提醒 并不是所有原子的原子核中都有中子,如普通氢原子的原子核中没有中子。
2.核电荷数与构成原子的粒子数目之间的关系: 在原子中,核电荷数= 质子 数= 核外电子 数。
3.原子的电性:原子核内质子所带正电荷总数 等于 核外电子所带负电荷总数,中子不带电,故原子不显电性。
二、相对原子质量1.定义:以一种碳原子(碳-12)质量的112为标准,其他原子的质量与它相比,作为这种原子的相对原子质量,符号为A r 。
2.表达式:相对原子质量(A r )=一个原子的实际质量一种碳原子质量×1123.近似计算:相对原子质量≈ 质子 数+ 中子 数。
特别提醒 相对原子质量是一个比值,单位是“1”,一般省略不写。
【漫画助学】原子核内的质子数不同,原子的种类不同。
【交流讨论】“原子核内的质子数一定等于中子数”,这种说法是否正确?提示:不正确,原子核内的质子数不一定等于中子数,如钠原子质子数为11,中子数为12。
【妙法指引】①相对原子质量不是原子的实际质量,但原子的实际质量越大,其相对原子质量越大;②不同种原子的实际质量之比等于它们的相对原子质量之比。
【重点案例探析】考点原子的构成【典题】(2023秋·邯郸丛台区期末)如图为某原子结构模型的示意图,其中a、b、c是构成该原子的三种不同粒子。
下列说法正确的是(D)A.原子中a的质量和c的质量相同B.原子中b与c的数目和等于原子质量C.原子中b与c的数目一定相同D.原子的质量主要集中在微粒b和c上方法点拨构成原子的各粒子之间的关系(1)数量关系:核电荷数=质子数=核外电子数(与中子数无关)。
(2)质量关系:组成原子核的质子和中子的质量相差不大,都比电子质量大得多,原子的质量主要集中在原子核上。
(3)体积关系:原子核居于原子中心,在原子中占的体积很小。

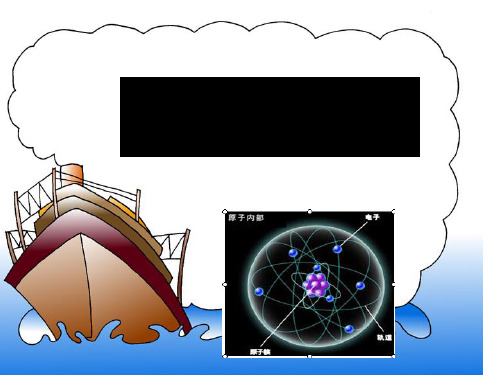

课题二、 原子的结构一、原子的构成1. 原子的构成 电子层原子核原子一般是由质子、中子和电子构成,并非所有的原子都有中子,质子数也不一定等于中子数。
2. 在原子中,核电荷数=核内质子数=核外电子数=原子序数由于原子核所带的正电荷与核外电子所带的负电荷的电量相等,电性相反,所以原子整体不显电性。
3. 原子核直径是原子直径的几万分之一,原子不是实心球体,核外有一个很大的空间,核外电子就在这个空间内高速运动。
4. 原子的种类由核电荷数(核内质子数)决定。
二、原子核外电子的排布A 、在含有多个电子的原子里,电子的能量并不相同,能量低的电子通常在离核较近的原子(不带电)原子核(带正电)核外电子(每个电子带一个单位负电荷)质子(每个质子带一个单位正电荷)中子(不带电)原子核—原子==蚂蚁(中心) — 体育场原子—乒乓球==乒乓球—地球区域运动,能量高的通常在离核较远的区域运动。
核外电子根据其能量的高低在不同的电子层内运动,这就是核外电子的分层排布。
现在发现的元素,原子核外电子最少的有1层,最多的有7层。
电子层序数越大,层内电子的能量越大,离原子核距离越远。
B、排布规律:①核外电子总是尽先排在能量最低的电子层里,第一层排满才排第二层,第二层排满才排第三层;②每个电子层最多能容纳2n2个电子。
(n为电子层序数,第一层n=1,第二层n=2)③最外层电子数不超过8个(第一层为最外层时,不超过2个)。
原子结构示意图:氯原子的原子结构示意图画出周期表中前三个周期元素的原子结构示意图相对稳定结构:稀有气体化学性质比较稳定,不易与其他物质发生化学反应,他们的原子最外层电子数都是8个(氦2个),这样的结构叫相对稳定结构。
三、离子的形成●常见元素名称、元素符号H He Li Be B , C N O F Ne ,氢氦锂铍硼碳氮氧氟氖Na Mg Al Si P ,S Cl A r K Ca钠镁铝硅磷硫氯氩钾钙。
Mn Fe Zn Ag Ba I Hg Cu Sn Pb P t Au锰铁锌银钡碘汞铜锡铅铂金●离子的形成:带电的原子或原子团叫做离子。
人教版初三化学上册原子的结构知识点人教版初三化学上册原子的结构知识点原子的中心是一些带正电的粒子,外围是一些绕转着的电子,下面是查字典化学网整理的原子的结构知识点,希望对大家有帮助。
知识点一、原子的构成1. 原子的构成原子由原子核和电子构成,原子核由质子和中子构成。
2. 每个质子带一个单位正电荷,每一个电子带一个单位负电荷,中子不带电。
原子核所带的正电荷数为核电荷数。
电子的质量很小,可忽略不计,原子的质量主要集中在原子核上。
3. 构成原子的粒子一般是质子、中子、电子。
构成原子的必要粒子是质子和电子,决定原子种类的是质子。
4. 原子核所带正电荷数(核电荷数)和核外电子所带负电荷数相等,但电性相反,所以整个原子不显电性。
5. 在原子中核电荷数=质子数=电子数,原子核内质子数不一定等于中子数。
二、相对原子量国际上以一种碳原子质量的1/12为标准,其他原子的质量跟它相比较所得到的比,作为这种原子的相对原子量(Ar)。
A.质子数c>dB.离子的还原性Y2->Z-C.气态氢化物的稳定性H2Y>HZD.原子半径X5.假设R元素无同位素,元素R原子的质量数为A,Rm-的核外电子数为x,则W g Rm-离子所含中子的物质的量为() A.(A-x+m)mol B.(A-x-m)mol C.WA(A-x+m)molD.WA(A-x-m)mol6.短周期元素X、Y的原子序数相差7,下列有关判断错误的是()A.X和Y可能处于同一周期B.X和Y可能处于相邻周期C.X和Y可能处于同一主族D.X和Y可能处于相邻主族7.下列关于元素周期表的叙述,不正确的是()A.共有7个周期,16个族B.形成化合物种类最多的元素在第二周期C.第ⅡA族的右边是第ⅢB族,第ⅢA族的左边是第ⅡB族D.某主族元素最高价氧化物对应的水化物的化学式为HnROm,其气态氢化物的化学式一定为H2m-nR或RH2m-n 8. (2009?嘉兴模拟)下列有关物质性质的比较中,正确的是 ()①热稳定性:CH4>NH3>H2O ②还原性:I->Br->Cl- ③酸性:H3PO4>H2SO4>HClO4 ④原子半径:Na>Mg>OA.①③B.②④C.①④D.②③原子的结构知识点的全部内容就是这些,预祝大家在新学期可以更好的学习。
第三单元物质构成的奥秘课题2 原子的结构★知识点一、原子的构成1、构成物质的三粒子:原子、分子、离子。
构成原子的三种粒子:质子、中子、电子。
原子由原子核和核外电子两部分构成。
2、原子不显电性的原因:原子核带的正电荷数与核外电子所带电量相等,电性相反。
3、原子的质量主要集中原子核;原子的质量主要由质子和中子决定。
4、不是所有原子都含有中子,如氢原子就不含中子。
5、原子中的等量关系:核电荷数=质子数=电子数。
二、原子核外电子的排布1、核外电子是分层排布的。
2、核外电子排布的规律:第一层最多2个;第二层最多8个;最外层不超过8个(只有一层不超过2个)3、120号元素的原子结构示意图。
4、元素在周期表中的周期数等于原子的电子层数。
5、元素的化学性质主要取决于原子的最外层电子数。
注:(1)稳定结构:最外层具有8个电子(只有一层具有2个电子)的结构。
(2)各类元素性质与原子结构的关系:最外层电子数得失电子倾向化学性质金属元素一般少于4个易失不稳定非金属元素一般为47个易得不稳定1、离子:带电荷的原子或原子团。
2、离子的分类阳离子;带正电荷的离子。
如:H+、Na+、Mg2+、Al3+、Ca2+、NH4+、Fe3+、Fe2+阴离子:带负电荷的离子。
O2、S2、Cl、OH、SO42、CO32、NO3、3、离子符号的意义:Mg2+:表示镁离子;1个镁离子带2个单位的正电荷2Mg2+:表示2个镁离子.4、离子的判断:质子数>电子数的是阳离子。
质子数<电子数的是阴离子。
5、离子与形成离子的原子在质量上相等,且属于同种元素。
四、相对原子质量1、概念:以一种碳原子质量的1/12为标准,其它原子的质量跟它相比较所得的比,就是相对原子质量。
2、计算式:某元素相对原子质量=()()kg1 12kg12⨯一个该原子的实际质量一种碳原子的实际质量3、相对原子质量=质子数+中子数。
注意:相对原子质量不是实际质量,单位是1,省略。