九年级化学原子的构成
- 格式:pdf
- 大小:1.74 MB
- 文档页数:10



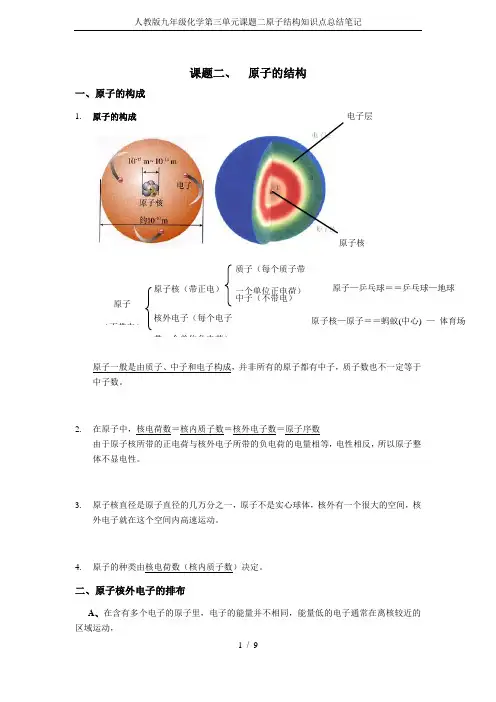
课题二、 原子的结构一、原子的构成1. 原子的构成 电子层原子核原子一般是由质子、中子和电子构成,并非所有的原子都有中子,质子数也不一定等于中子数。
2. 在原子中,核电荷数=核内质子数=核外电子数=原子序数由于原子核所带的正电荷与核外电子所带的负电荷的电量相等,电性相反,所以原子整体不显电性。
3. 原子核直径是原子直径的几万分之一,原子不是实心球体,核外有一个很大的空间,核外电子就在这个空间内高速运动。
4. 原子的种类由核电荷数(核内质子数)决定。
二、原子核外电子的排布A 、在含有多个电子的原子里,电子的能量并不相同,能量低的电子通常在离核较近的原子(不带电)原子核(带正电)核外电子(每个电子带一个单位负电荷)质子(每个质子带一个单位正电荷)中子(不带电)原子核—原子==蚂蚁(中心) — 体育场原子—乒乓球==乒乓球—地球区域运动,能量高的通常在离核较远的区域运动。
核外电子根据其能量的高低在不同的电子层内运动,这就是核外电子的分层排布。
现在发现的元素,原子核外电子最少的有1层,最多的有7层。
电子层序数越大,层内电子的能量越大,离原子核距离越远。
B、排布规律:①核外电子总是尽先排在能量最低的电子层里,第一层排满才排第二层,第二层排满才排第三层;②每个电子层最多能容纳2n2个电子。
(n为电子层序数,第一层n=1,第二层n=2)③最外层电子数不超过8个(第一层为最外层时,不超过2个)。
原子结构示意图:氯原子的原子结构示意图画出周期表中前三个周期元素的原子结构示意图相对稳定结构:稀有气体化学性质比较稳定,不易与其他物质发生化学反应,他们的原子最外层电子数都是8个(氦2个),这样的结构叫相对稳定结构。
三、离子的形成●常见元素名称、元素符号H He Li Be B , C N O F Ne ,氢氦锂铍硼碳氮氧氟氖Na Mg Al Si P ,S Cl A r K Ca钠镁铝硅磷硫氯氩钾钙。
Mn Fe Zn Ag Ba I Hg Cu Sn Pb P t Au锰铁锌银钡碘汞铜锡铅铂金●离子的形成:带电的原子或原子团叫做离子。


课题2 原子的结构一、原子的构成⒈构成原子的粒子 质子:一个质子带一个单位的正电荷原子核原子 中子:不带电电子:一个电子带一个单位的负电荷⑴原子核所带电量数称为核电荷数,由于原子核所带电量和核外电子的电量相等,但电性相反,因此原子不显电性。
核电荷数=质子数=核外电子数⑵原子核内的质子数不一定等于中子数,普通的氢原子的原子核内无中子。
⑶原子的种类是由质子数决定的。
⑷原子核只占原子体积的很小一部分,原子内相对有一个很大的空间,电子在这个空间里作高速运动。
二、原子核外电子的排布1、原子中电子的运动是分层运动的,在含多电子的原子里,电子的能量不同能量低的,通常在离核近的区域运动。
能量高的,通常在离核远的区域运动。
为了便于说明问题,通常就用电子层来表明运动着的电子离核远近的不同。
把能量最低、离核最近的叫第一层,能量稍高、离核稍远的叫第二层,由里往外依次类推,叫三、四、五、六、七层(也可分别叫K L M N O P Q 层)。
电子的这种分层运动是没有固定轨道的。
2、原子结构示意图的认识(1)1~20号元素,第一层最多能排2个,其它层最多能排8个,不足的,是几个就排几个。
各层电子数之和等于质子数,原子最外层电子数决定了元素的化学性质!(2)稀有气体元素最外层一般为8个(氦为2),为相对稳定的结构。
(3)非金属元素最外层一般多于4个,在化学反应中易得到电子,形成阴离子,从而达到相对稳定的结构。
(4)金属元素最外层一般少于4个,在化学反应中易失去电子,形成阳离子,从而达到相对稳定的结构。
三、离子1、定义:带电荷的原子(或原子团)。
2、离子符号表示的意义:表示离子(或一个离子),如:Mg 2+——表示镁离子(一个镁离子)2+ 表示每个镁离子带两个单位的正电荷表示两个镁离子⑴离子符号前面的化学计量数(系数)表示离子的个数;⑵离子符号的表示方法:在元素符号(或原子团)右上角表明离子所带的电荷,数值在前,正、负号在后。




课题二、 原子的结构一、原子的构成1. 原子的构成 电子层原子核原子一般是由质子、中子和电子构成,并非所有的原子都有中子,质子数也不一定等于中子数。
2. 在原子中,核电荷数=核内质子数=核外电子数=原子序数由于原子核所带的正电荷与核外电子所带的负电荷的电量相等,电性相反,所以原子整体不显电性。
3. 原子核直径是原子直径的几万分之一,原子不是实心球体,核外有一个很大的空间,核外电子就在这个空间内高速运动。
4. 原子的种类由核电荷数(核内质子数)决定。
二、原子核外电子的排布A 、在含有多个电子的原子里,电子的能量并不相同,能量低的电子通常在离核较近的原子(不带电)原子核(带正电)核外电子(每个电子带一个单位负电荷)质子(每个质子带一个单位正电荷)中子(不带电)原子核—原子==蚂蚁(中心) — 体育场原子—乒乓球==乒乓球—地球区域运动,能量高的通常在离核较远的区域运动。
核外电子根据其能量的高低在不同的电子层内运动,这就是核外电子的分层排布。
现在发现的元素,原子核外电子最少的有1层,最多的有7层。
电子层序数越大,层内电子的能量越大,离原子核距离越远。
B、排布规律:①核外电子总是尽先排在能量最低的电子层里,第一层排满才排第二层,第二层排满才排第三层;②每个电子层最多能容纳2n2个电子。
(n为电子层序数,第一层n=1,第二层n=2)③最外层电子数不超过8个(第一层为最外层时,不超过2个)。
原子结构示意图:氯原子的原子结构示意图画出周期表中前三个周期元素的原子结构示意图相对稳定结构:稀有气体化学性质比较稳定,不易与其他物质发生化学反应,他们的原子最外层电子数都是8个(氦2个),这样的结构叫相对稳定结构。
三、离子的形成●常见元素名称、元素符号H He Li Be B , C N O F Ne ,氢氦锂铍硼碳氮氧氟氖Na Mg Al Si P ,S Cl A r K Ca钠镁铝硅磷硫氯氩钾钙。
Mn Fe Zn Ag Ba I Hg Cu Sn Pb P t Au锰铁锌银钡碘汞铜锡铅铂金●离子的形成:带电的原子或原子团叫做离子。

九年级原子的结构知识点原子是物质的基本单位,由电子、质子和中子组成。
了解原子的结构对于我们理解化学、物理等科学领域至关重要。
本文将介绍九年级学生需要了解的原子的结构知识点。
一、原子的构成1. 电子:电子是带负电荷的基本粒子,它们围绕原子核轨道上运动。
电子的质量很小,约为质子的1/1836。
2. 质子:质子是带正电荷的基本粒子,它们位于原子核中心。
每个质子的质量约为1.67×10^-27千克。
3. 中子:中子是电中性的基本粒子,它们位于原子核中心。
每个中子的质量也约为1.67×10^-27千克,与质子的质量相近。
二、原子的电子层原子的电子以不同的轨道分布在电子层中,每个电子层可以容纳一定数量的电子。
1. K层:最靠近原子核的电子层,最多容纳2个电子。
2. L层:次于K层的电子层,最多容纳8个电子。
3. M层:再次次于L层的电子层,最多容纳18个电子。
4. N层:依次类推,最多容纳32个电子。
三、原子的核结构原子核是原子的中心部分,由质子和中子组成。
1. 原子序数:原子核中质子的数量称为原子序数,用字母"Z"表示。
在没有电荷的情况下,原子是电中性的,因此电子数也等于原子序数。
2. 质量数:原子核中质子和中子的总数称为质量数,用字母"A"表示。
3. 同位素:具有相同原子序数但质量数不同的原子称为同位素。
同位素具有相似的化学性质,但存在微小的质量差异。
四、原子的符号表示为了便于记录和描述各种元素的原子结构,科学家采用了原子符号表示法。
1. 原子符号:原子符号由元素的化学符号和原子序数组成。
例如,氧的原子符号为O,氢的原子符号为H。
2. 原子质量:在原子符号的上方或左上方,标记元素的质量数。
例如,氯的质量数为35.5。
五、元素周期表元素周期表是将元素按照原子序数和元素性质分类的表格。
1. 元素周期:元素周期表横向的行称为周期,纵向的列称为族。
同一周期内的元素拥有相同电子层数目,而同一族内的元素拥有相似化学性质。
九年级上册人教版化学原子的结构一、原子的构成。
1. 原子的组成粒子。
- 原子是由居于原子中心的原子核与核外电子构成的。
- 原子核由质子和中子构成(氢原子除外,氢原子的原子核内只有1个质子,没有中子)。
2. 粒子的电性和电量。
- 质子带正电,每个质子带1个单位正电荷。
- 中子不带电。
- 电子带负电,每个电子带1个单位负电荷。
- 在原子中,质子数=核电荷数 =核外电子数,原子整体不显电性。
例如,氧原子的质子数为8,核外电子数也是8,所以氧原子呈电中性。
3. 原子的质量。
- 原子的质量主要集中在原子核上,因为质子和中子的质量相对电子来说很大,电子的质量很小,几乎可以忽略不计。
- 相对原子质量≈质子数 + 中子数。
例如,钠原子的质子数为11,中子数为12,其相对原子质量约为11 + 12 = 23。
二、原子核外电子的排布。
1. 电子层。
- 核外电子是分层排布的。
离核最近的电子层为第一层,离核最远的电子层为最外层。
- 第一层最多容纳2个电子,第二层最多容纳8个电子,最外层电子数不超过8个(只有1层的不超过2个)。
2. 原子结构示意图。
- 以氧原子为例,其原子结构示意图为:- 小圆圈表示原子核,圆圈内的数字表示质子数(即核电荷数),弧线表示电子层,弧线上的数字表示该层的电子数。
氧原子的质子数为8,核外有2个电子层,第一层有2个电子,第二层有6个电子。
3. 元素化学性质与最外层电子数的关系。
- 最外层电子数决定元素的化学性质。
- 稀有气体元素(如氦、氖、氩等)的原子最外层电子数一般为8个(氦为2个),这种结构称为相对稳定结构,它们的化学性质比较稳定。
- 金属元素的原子最外层电子数一般少于4个,在化学反应中易失去电子,形成阳离子。
例如,钠原子最外层电子数为1,在化学反应中易失去1个电子形成钠离子(Na⁺)。
- 非金属元素的原子最外层电子数一般多于4个,在化学反应中易得到电子,形成阴离子。
例如,氯原子最外层电子数为7,在化学反应中易得到1个电子形成氯离子(Cl⁻)。