武汉理工无机(上)试卷
- 格式:doc
- 大小:15.89 MB
- 文档页数:5

《无机材料》考试试卷(A卷)(闭卷时间120分钟)院/系年级专业姓名学号一、名词解释肖特基缺陷非均匀成核烧结泰曼温度非本征扩散稳定扩散二、简答题1、简述硅酸盐晶体结构分类的原则和各类结构中硅氧四面体的形状。
2、试比较杨德尔方程和金斯特林格方程的优缺点及其适用条件。
3、影响固相反应的因素有那些?4、网络变性体(如Na2O)加到石英玻璃中,使硅氧比增加。
实验观察到当O/Si=2.5~3时,即达到形成玻璃的极限,根据结构解释为什么在2<O/Si<2.5的碱和硅石混合物可以形成玻璃,而O/Si=3的碱和硅石混合物结晶而不形成玻璃?5、在扩散传质的烧结过程中,使坯体致密的推动力是什么?哪些方法可促进烧结?说明原因。
三、论述题1、简述晶粒生长与二次再结晶的特点,以及造成二次再结晶的原因和控制二次再结晶的方法。
2、相变过程的推动力是什么?《无机材料》考试试卷(A卷)参考答案一、名词解释肖特基缺陷:如果正常格点上的原子,热起伏过程中获得能量离开平衡位置,迁移到晶体的表面,在晶格内正常格点上留下空位,即为肖特基缺陷。
非均匀成核:借助于表面、界面、微粒裂纹、器壁以及各种催化位置而形成晶核的过程。
烧结:由于固态中分子(或原子)的相互吸引,通过加热,使粉末体产生颗粒粘结,经过物质迁移使粉末体产生强度并导致致密化和再结晶的过程。
泰曼温度:反应物开始呈现显著扩散作用的温度。
非本征扩散:受固溶引入的杂质离子的电价和浓度等外界因素所控制的扩散。
或由不等价杂质离子取代造成晶格空位,由此而引起的质点迁移。
稳定扩散:若扩散物质在扩散层dx内各处的浓度不随时间而变化,即dc/dt=0。
这种扩散称稳定扩散。
二、简答题1、硅酸盐晶体结构分类的原则:结构中硅氧四面体的连接方式。
(2.5分)各类结构中硅氧四面体的形状:岛状结构:四面体;组群状结构;(1.5分)双四面体、三节环、四节环和六节环;(1.5分)链状结构:单链、双链;(1.5分)层状结构:平面层;(1.5分)架状结构:三维空间延伸的骨架。


武汉理工大学考试试题纸( A 卷)课程名称普通化学专业班级09一、(选择题,每题2分,共20分)1.下列化合物中( )是配合物。
A.(NH4)2SO4·FeSO4·6H2O B.KCl·MgCl2·6H2OC.K2PtCl6D.Cu(OOCCH3)22.298.15K时由下列三个反应的△r H m 数据可求的△f H m (CH4,g)的数值为()C(石墨) + O2 (g) = CO2 (g) △r H m = -393.5 kJ·mol-1H2(g) +1/2O2 (g) = H2O (l ) △r H m = -285.8 kJ·mol-1CH4(g) + 2O2(g) = CO2(g) + 2H2O (l ) △r H m = -890.3 kJ·mol-1A.-74.8 kJ·mol-1B.211.0 kJ·mol-1C.890 kJ·mol-1D.无法确定3.描述核外电子运动状态的下列各组量子数中,不可能存在的是( )A.3,0,-1,- 1/2B. 3,2, 2,+1/2C.2,1,1,- 1/2D.2,1,0,- 1/24.已知FeO (s)+C(s) =CO(g) + Fe(s) 反应的△r H m 为正,△r S m 为正(假定△r H m 和△r S m 不随温度而变),下列说法正确的是()A.低温下自发过程,高温下非自发过程B.高温下自发过程,低温下非自发过程C.任何温度下均为自发过程D.任何温度下均为非自发过程5.在一定条件下,如果某反应的△r G m (298.15K)为零,则该反应,()A.能自发进行B.不能自发进行C.处于平衡状态D.属于何种情况(自发或平衡)难以判别6.已知标准氯电极的电势为 1.358V,则当氯离子浓度减少到0.1mol·L-1,氯气分压减少到0.1×100kPa时,该电极的电极电势应为()A.1.358VB.1.328 VC.1.387VD.1.417V1.47.对于下列两个反应式,说法完全正确的是()2Fe3+ +2Br — = 2Fe2+ + Br2Fe3+ + Br —= Fe2+ +1/2Br2A.E 、△G 、K 都相等B.E 、△G 相等,K 不等C.E 相等,△G 、K 不等D.△G 相等,E 、K 不相等8.将AgCl和AgI的饱和溶液的清液混合,在其中加入AgNO3固体,将会()A.只有AgCl沉淀B.只有AgI沉淀C.AgCl,AgI都沉淀,以AgCl为主D. AgCl,AgI都沉淀,以AgI为主9.对于一个化学反应来说,下列叙述正确的是()A.△G 越小,反应速率越快B.△H 越小,反应速率越快C.活化能越小,反应速率越快D.活化能越大,反应速率越快10.AgCl在下列物质中溶解度最大的是()A.纯水B.6 mol·L-1 NH3·H2OC.0.1mol·L-1 NaClD.0.1mol·L-1 BaCl2二、填空题(本题20分,每空1分)1.某温度下,N2(g) +3H2(g) =2NH3(g), △r H m <0。

(,344CO g,则在该温度与分压条件下的密闭容器中:(反应向左进行无法判断某反应在高温时能自发进行,低温时不能自发进行,则其(>0>02(+Pb aq固体在水中会发生水解反应,其水解反应式为分)试分别叙述热力学第一定律,(?B OH硼砂溶解在水中,配制成100ml的0.10 mol10H2O)=381.2g..武汉理工大学教务处试题标准答案及评分标准用纸课程名称: 无机化学 ( A 卷)一、选择题(以下每题均为单选题,每题2分,共20分。
)1、D2、A3、B4、B5、D6、 B7、B8、A9、C 10、C二、填空题(每空1分,共25分。
)1、定容,定压, 2. w 体 = 2.48KJ·mol -1 ,△U =-427. 38 KJ·mol -13. 3244, H PO PO --4. 稀H 2SO 4,增大,盐效应5. HAc –NaAc 6. 2.25,2.25,左,不变,不,增大,右 7. 氯化一溴·一氯·二乙二胺合铁(Ⅲ) ,Fe 3+, Br /Cl /en ,Br /Cl /N, 68. )()())()((22212S H K S H K HAc K PbS K Ka a a sp θθθθθ=9.()()()()32 2BiCl s H O l BiOCl s HCl aq +→+,先将BiCl 3溶于较浓的盐酸中,然后再加水稀释到需要的浓度三、简答题(见后面)四、计算题(每题为10分,共50分)1. 由ln r mG RT K θθ∆=-可求得两个温度下的(973)(1173)r m r m G K G K θθ∆∆和: 1236.281092.2ln 97310314.8ln )973(---⋅=⨯⨯⨯⨯-=-=∆mol kJ K RT K G m r θθ13382.004.1ln 117310314.8ln )1173(--⋅-=⨯⨯⨯-=-=∆mol kJ K RT K G m r θθ由Gibbs 公式()(298.15)(298.15)r m r m r m G T H K T S K θθθ∆≈∆-∆,则可求出(298.15), (298.15)r m r m H K S K θθ∆∆:1(973)(298.15)973(298.15)28.6r m r m r m G K H K S K kJ mol θθθ-∆=∆-⨯∆=⋅1(1173)(298.15)1173(298.15)0.382r m r m r m G K H K S K kJ mol θθθ-∆=∆-⨯∆=-⋅解方程得: 14.169)15.298(-⋅=∆mol kJ K H m r θ,114.144)15.298(--⋅⋅=∆K mol J K S m r θ或由vant Hoff 等压方程(1173)1173973ln (973)8.3141173973r m H K K K K θθθ∆-=⨯,可求出14.169)15.298(-⋅=∆mol kJ K H m r θ,继而求得114.144)15.298(--⋅⋅=∆K mol J K S m r θ2. 解:已知M(Na 2B 4O 7·10H 2O)=381.2 g ·mol -1,28.6 g 硼砂(Na 2B 4O 7·10H 2O)在水中溶解其物质的量浓度是()12472128.6Na B O 10H O 0.075381.2 gc mol L g mol--⋅==⋅⋅ 由硼砂(Na 2B 4O 7·10H 2O)溶解方程式中各物质的系数比可知:()()()()100424723B OH ()2Na B O 10H O 0.150c c B OH c mol L --==⋅=⋅(1)溶解于水的硼砂生成等物质量的B(OH)3和()-4OH B ,两者为共轭酸碱对,组成缓冲体系。

无机化学试题三一、是非题(判断下列叙述是否正确,正确的在括号中画√,错误的画×。
本大题共10分,共计5小题,每小题2.0分)1. ds 区同族元素的金属活泼性自上而下逐渐增强。
2. 鲍林 ( Pauling ) 能级图表明了原子能级随原子序数而发生的变化。
3. He、Ne、Ar、Kr、Xe 的极化率依次增大。
4. 在 1.0 L 0.10 mol·L-1 [ Ag (NH3 )2 ]Cl 溶液中,通入 2.0 mol NH3 (g) 达到平衡时各物质浓度大小的关系是 c ( NH3 ) > c ( Cl- ) ≈ c ( [ Ag (NH3 )2 ]+) >c ( Ag+ ) 。
5. 如果某氢化物的水溶液为碱性,则此氢化物必为离子型氢化物。
二、选择题(在下列各题中,选择出符合题意的答案,将其代号填入括号内。
本大题共10分,共计5小题,每小题2.0分)6. 反应 2A + 2B → C,其速率方程式 v = k c (A)[ c (B)]2, 则对 A 而言,反应级数为A.3B.4C.2D.17. 对下列各相关配离子按磁矩相对大小顺序排列正确的是A.[ Ti (H2O)6]3+ = [V(H2 O)6]3+ >[ Cr (H2O)6]3+B.[Ti (H2O)6]3+ >[V(H2 O)6]3+ > [Cr (H2O)6]3+C.[Ti (H2O)6]3+ <[ V(H2 O)6]3+ <[ Cr (H2O)6]3+D.[ Ti (H2O)6]3+ < [V(H2 O)6]3+ = [Cr (H2O)6]3+8. 下列叙述中正确的是A.PCl3、SnCl2为非极性分子,CO2、NH3为极性分子l4、CO2为非极性分子,NH3、SnCl2为极性分子C.CO2、BCl3为非极性分子,PCl5 (g)、PCl3 (g) 为极性分子D.CO2、CCl4为非极性分子,PCl3、BeCl2为极性分子9. 已知K(HA) < 10-5,HA 是很弱的酸,现将 a mol·L-1 HA 溶液加水稀释,使溶液的体积为原来的n倍 ( 设α (HA) << 1),下列叙述正确的A.HA 溶液的解离度增大为原来n倍B.c (H+ ) 变为原来的 1 / nC.c (H+ ) 变为原来的 (1 / n)1/2D.c (H+ ) 变为原来的a / n倍10. 下列物质的晶体结构中既有共价键又有大π键和分子间力的是A.碘B.金刚砂C.石英D.石墨三、填空题(根据题意,在下列各题的横线处,填上正确的文字,符号或数值。
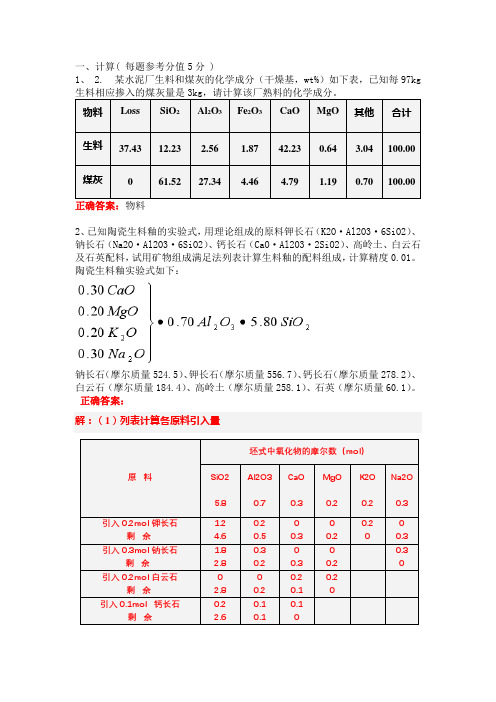
一、计算( 每题参考分值5分 )1、 2. 某水泥厂生料和煤灰的化学成分(干燥基,wt%)如下表,已知每97kg2、已知陶瓷生料釉的实验式,用理论组成的原料钾长石(K2O·Al2O3·6SiO2)、钠长石(Na2O·Al2O3·6SiO2)、钙长石(CaO·Al2O3·2SiO2)、高岭土、白云石及石英配料,试用矿物组成满足法列表计算生料釉的配料组成,计算精度0.01。
陶瓷生料釉实验式如下:钠长石(摩尔质量524.5)、钾长石(摩尔质量556.7)、钙长石(摩尔质量278.2)、白云石(摩尔质量184.4)、高岭土(摩尔质量258.1)、石英(摩尔质量60.1)。
正确答案:解:(1)列表计算各原料引入量3、玻璃的设计成分见表1表1 玻璃的设计成分(质量%)纯碱挥散率 3.10%;玻璃获得率 83.5%;萤石含率 0.85%;芒硝含率 15%;煤粉含率 4.7%;计算基础 200kg玻璃液;计算精度 0.01。
表2各种原料的化学成分(%)4、已知瓷坯及所用原料的化学组成如下表所示,试列表计算瓷坯的配方。
瓷坯及所用原料的化学组成表(%)19.00 39.000.19 0.47 0.30 0.780.50 0.1316.0012.60正确答案: 6、.某建筑工程采用钢筋混凝土结构,需要设计混凝土屋面板用的配合比,设计强度等级C30,其施工要求坍落度为30mm,保证率为95%。
工程采用32.5Mpa 普通硅酸盐水泥(实测强度为40.2Mpa),密度 3.10;采用中砂,表观密度 2.60,堆积1.45g/cm3;采用碎石,最大粒径为20mm, 表观密度为2.70,堆积密度1.52g/cm3;请用绝对体积法设计该混凝土的实验室配合比。
(已知:σ0=5Mpa,A=0.46,B=0.07,保证率为95%,t=-1.645, 混凝土含气量百分数α取1;混凝土的每立米用水量采用确定10/3(T+K ),其中K 为53,砂率取34%) 正确答案:答: (1)混凝土试配强度:R h=R d-tσ0=30-(-1.645×5)=38.2Mpa;(1分)(2)水灰比:,则:W/C=0.47(2分)(3)用水量:W0=(3+53)×10/3=186kg(1分)(4)混凝土单位水泥用量:C0=186÷0.47=396kg(1分)(5)根据绝对体积法原理,可得方程式:代入数据可得:S0=617kg (2分)G0=1186kg (2分)即混凝土每立方米的各种材料用量为:C0=396kg, W0=186kg, S0=617kg , G0=1186kg;混凝土配合比为:C:S:G:=1:1.56:2.99,7、试计算硅酸盐水泥熟料中的SiO2全部形成C2S时,相应的石灰饱和系数KH。
武汉理工大学2004年研究生入学考试试题代号:448 课程名称:无机非金属材料工学一、名词解释(20分)1.胶凝材料(3分)2.水泥的安定性(3分)3.高性能混凝土(4分)4.触变性(2分)5.酸度系数(写出其表达式)(2分)6.坯釉适应性(3分)7.浮法玻璃的平衡厚度(2分)8.退火温度(2分)二、填空:(每空1分,共30分)1.对于混凝土拌合物坍落度大于10mm的新拌混凝土,通常采用坍落度方法测定其流动性,而对于坍落度小于10mm的干硬性混凝土拌合物,可采用测定其稠度。
2.测定水泥ISO强度时,胶砂比,水灰比。
3.生产硅酸盐水泥的主要原料是,和。
4.水泥细度愈细,其强度,放热量。
5用碎石配制的混凝土比同条件下用卵石配制的混凝土流动性要,强度要。
6为了调节硅酸盐水泥的凝结时间,长掺入适量的。
7.水泥的主要水化产物有,,,,水化铁酸钙等。
8.根据成型方法的不同,坯料通常可分为三类:。
9.对各种坯料的基本质量要求是:。
10.施釉(glazing)的基本方法有浸釉、、三种。
11.存在于玻璃液中的气体有三种形态:。
12.根据澄清剂的不同作用机理大致可分为、硫酸盐类澄清剂和卤化物类澄清剂。
13.玻璃体的缺陷按其状态不同,可以分为三大类:。
14.耐火纤维的生产方法主要有以下几种、熔融提炼法和回转法、高速离心法、胶体法。
15.坯釉组成的表示方法有配量表示法、、示性矿物组成表示法及实验式表示法。
16.根据成型方法的不同,坯料通常可分为三类:。
17.陶瓷颜料种类很多,可以归纳三方面的用途: 、、绘制花纹图案。
18.施釉(glazing)的基本方法有浸釉、、三种。
19.对釉浆的质量要求是:一定的细度、适中的相对密度(浓度)、。
20.根据各种氧化物在玻璃结构中的作用不同可将它们分为、玻璃中间体、玻璃调整体。
21.玻璃制品的退火包括四个阶段。
22.耐火材料是耐火度不低于1580°C的无机非金属材料,不能作为制品使用温度的。
武汉理⼯⼤学考试试题纸(A卷)武汉理⼯⼤学考试试题纸(A卷)课程名称⽆机化学(下)专业班级⼀.选择题(15分)1. 下列硝酸盐热分解为⾦属的是()(A)NaNO3(B)Pb(NO3) 2(C)AgNO3(D)Cu(NO3) 22. 下列各组硫化物,其中均难溶于稀酸, 但能溶于浓盐酸的是()(A)Bi2S3和CdS (B) ZnS和PbS (C) CuS 和Sb2S3 (D) As2S3和HgS3. 下列氢氧化物中,哪⼀种既能溶于过量的NaOH,⼜能溶于过量的氨⽔()(A)Ni(OH)2 (B)Fe(OH) 3(C)Zn(OH)2(D)Al(OH)34. 与浓盐酸反应不能⽣成黄绿⾊⽓体的物质是()(A)PbO2(B)Fe2O3(C) Co2O3(D) MnO25. 配制SnCl2溶液,常在溶液中放⼊少量固体Sn粒,其理由是()(A)防⽌Sn2+被氧化;(B)防⽌Sn2+⽔解;(C)防⽌SnCl2溶液产⽣沉淀;(D)防⽌SnCl2溶液挥发6. 下列物质中酸性最强的是()(A) H2S (B) H2SO3(C) H2SO4(D) H2S2O77. 在FeCl3和KNCS 的混合溶液中,加⼊⾜够的NaF,其现象是()(A)变成⽆⾊(B) 颜⾊加深(C) 产⽣沉淀(D) 颜⾊变浅8. 下列离⼦与过量KI溶液反应只能得到澄清的⽆⾊溶液的是()(A)Cu2+(B) Fe3+(C) Hg2+(D) Hg22+9.在NaH2PO4溶液中加⼊AgNO3溶液后主要产物是()(A) Ag2O (B) AgH2PO4 (C) Ag3PO4(D) Ag2HPO410. 下列叙述中正确的是()(A) H2O2 的分⼦构型为直线形;(B)H2O2既有氧化性⼜有还原性,主要⽤作氧化剂(C)H2O2是中强酸,分⼦间有氢键;(D)H2O2与K2Cr2O7 的酸性溶液反应⽣成稳定的蓝⾊CrO5,此反应可⽤来鉴定H2O2⼆、按性质递变规律排序(⽤>,<表⽰)(7分)1. 氧化性HClO4H5IO6HBrO42. 熔点SnCl2SnCl43. 熔点BeCl2MgCl2 SrCl24. 热稳定性碳酸碳酸氢盐碳酸盐5. 碱性Sn(OH)2 Sn(OH)46. 还原性Cl-Br-I-7. 酸性HClO HBrO HIO三、完成并配平下列⽅程式(20分)1.在消防队员的背包中,超氧化钾既是空⽓净化剂,⼜是供氧剂2. H3BO3+HOCH2CH2OH→3. Na2S2 + SnS →4. SbCl3(aq) 溶液稀释时变浑5. PCl5+H2O→6. Mn2++ NaBiO3 + H+→7. 常温下,液溴与碳酸钠溶液→8. Ag++Cr2O72-→9. Hg22++I-(过量)→10. HF腐蚀玻璃四、填空题( 28分)1. 氯⽓能使湿润的KI-淀粉试纸变蓝,有关的反应式为();但试纸长久与氯⽓接触后,蓝⾊会消失,这是因为(),反应式为()。
第二套一、(1)(12分)根据CaTiO3晶胞图(见图1)回答下列问题:1.晶面BCGF、DEG的晶面指数;晶向DF、HA的晶向指数。
2.结构中各离子的配位数为多少,写出其配位多面体; 3.晶胞分子数是多少?何种离子添何种空隙,空隙利用率是多少?4.结构中是否存在TiO32-离子,为什么?2)(11分)图2是镁橄榄石(Mg2[SiO4])结构示意图,试回答:1.镁橄榄石属于哪种硅酸盐结构类型;2.计算说明O2-的电价是否饱和;3.结构中有几种配位多而体,各配位多面体间的连接方式怎样?4.镁橄榄石是否容易形成玻璃,为什么?图1 图2二、(10分)写出下列缺陷反应式:1.NaCl形成肖脱基缺陷。
2.AgI形成弗伦克尔缺陷(Ag+进入间隙)3.TiO2掺入到Nb2O3中,请写出二个合理的方程,写出固溶体的化学式,并判断可能成立的方程是哪一种?三、(10分)判断下列叙述是否正确?若不正确,请改正。
1.Na2O-SiO2系统中随SiO2含量的增加,熔体的粘度将降低。
2.扩散的推动力是浓度梯度,所有扩散系统中,物质都是由高浓度处向低浓度处扩散。
3.晶粒正常长大是小晶粒吞食大晶粒,反常长大是大晶粒吞食小晶粒。
4.固溶体是在固态条件下,一种物质以原子尺寸溶解在另一种物质中形成的单相均匀的固体。
5.在热力学平衡条件下,二元凝聚系统最多可以3相平衡共存,它们是一个固相、一个液相和一个气相。
四、(6分)什么叫弛豫表面?NaCl单晶表面具有什么样的结构特点?五、(6分)巳知Zn2+和Cr2+在尖晶石ZnCrO4中的自扩散系数与温度的关系分别为1.试求1403K时Zn2+和Cr2+在尖晶石ZnCrO4中的扩散系数。
2.将细铂丝涂在两种氧化物ZnO和Cr2O3的分界线上,然后将这些压制成型的样品进行扩散退火。
(标记物铂丝非常细,不影响离子在不同氧化物之间的扩散)。
根据所得数据判断铂丝将向哪一方向移动?六、(6分)为什么在成核一生成机理相变中,要有一点过冷或过热才能发生相变?什么情况下需过冷,什么情况下需过热,各举一个例子。
《无机化学》〔上册〕期末考试试卷及答案《无机化学》〔上册〕期末考试试卷试卷 (一)一、填空题 (每空1分,共44分)1.当体系的状态被改变时,状态函数的变化只决定于_________,而与_________无关2.空气中的SO2与水作用并经氧化,生成 ___________ 使大理石转化为_________, ________,因而使雕象遭到破坏.3.:碘元素的电势图: 0.145V E? 0.535VIO3–IO–I2I–0.49V 那么:E?IO–/I2=_______, E?IO3–/I–=_____________﹣·L1的H2SO4溶液(铂为电极),阴极产物是______, 阳极产物是 ______﹣﹣﹣:E? O2/OH=1.229V, E? H+/H2 = 0.000V, E? S2O82/SO42=2.01V5.我国化学家徐光宪总结归纳出了能级的相对上下与____________________有关,且能级的上下与值有关的近似规律.6.制备胶体的方法有_______和_______.7.气体的根本特征是它的性和性。
··L-1NaAc溶液,HAc的电离度将________________,这种作用被称为__________________.9.离子的结构特征一般包括: 离子电荷、、三个方面.10.:2A+B=2C为简单反响,此反响对A物质反响级数为___________,总反响为____________级反响.11.共价键按共用电子对来源不同分为_____________和_______________; 共价键按轨道重叠方式不同分为_______________和________________。
12.亚氯酸可用_____________________反响而制得水溶液,它极不稳定迅速分解,反响式为:1。
13.在化学反响方程式 2KMnO4+5H2O2+6HNO3=2Mn(NO3)2+2KNO3+8H2O+5O2↑中,氧化产物为 ___________, 复原产物为 ____________14.O2分子中有 _________________________键,依公式 _________________ 可以算出O2的磁矩.15.A,B两种气体反响,设A的浓度增加一倍,速度增加一倍,B的浓度增加一倍,那么反响速度增加三倍,假设总压力减小为原来的1/2时,反响速度将变为原来的_________倍,该反响的总反响级数为____________. —————————,,是由————————于————————年制备的。
武汉理工大学考试试题纸
课程名称无机化学(上) 专业班级2002级
一.选择题(共20分,每小题2分)
1.下列热力学函数中,数值为零的是()(A)Δf H0m(CO, g)(B)Δf G0m(P4,s)(C)S0(H2,g)(D)Δf G0m(OH-,aq)
2.下列各组中,均为状态函数的一组是()(A)G,H,p,w(B)S,H,p,Q(C)S,H,T,p(D)S,V,p,w
3.已知反应N2(g)+3H2(g)=2NH3(g), Δr H0m =-92.2 kJ·mol-1,,欲提高N2的转化率,应采取()(A)高温高压(B)高温低压(C)低温低压(D)低温高压
4.溶解AgBr沉淀时,可采用下列那种溶液()
(A)NaCl 溶液(B)Na2S2O3溶液(C)HCl溶液(D)KI溶液
5.下列哪一组物质可配制成缓冲溶液()(A)NaH2PO4—Na2HPO4(B)HAc--NaCl(C)HAc--HCl(D)NaAc—NH3·H2O
6.下列电对的电极电势受溶液酸度影响的是()(A)Fe2+/Fe(B)IO3-/I–(C)Cu2+/Cu(D)Fe3+/Fe2+
7.当主量子数n=2时,其所在电子层轨道最多可容纳多少个电子()(A)2(B)4(C)6(D)8
8.根据分子轨道理论,O2-的键级为()(A)2.5(B)2(C)1.5(D)1
9.下列离子中,极化率最大的是()(A)I-(B)F-(C)Br-(D)Cl-
10.一个化学反应进行越快,则说明下列哪个数值越小()
(A) Ea (B) ⊿rS0(C) ⊿rH0 (D) ⊿rG0
二.填空题(40分)
1.液态CCl4分子之间的作用力为__。
2.298K时反应2CO(g)+O2(g)=2CO2(g)的⊿r H0=akJ·mol-1,则在该温度下,该反应的⊿r U0=__。
3.根据酸碱只质子理论,H2O的共扼酸为_______,共扼碱为_______。
4.微观粒子的运动具有___性,电子在核外的运动规律可用__来描述。
5.0.20 mol·L-1HAc溶液的pH值等于_______;如在上述溶液中加入少量NaAc固体(忽略体积变化),使其浓度达0.10mol·L-1,此时溶液的pH值为___。
(已知Ka(HAa)=1.74×10-5)6.25℃时,E0(Cu2+/Cu)______E0(Cu(NH3)42+/Cu)。
7.在102℃和100kpa条件下,H2O(l)==H2O(g)过程的⊿r G0_______;⊿rS0_______;过程向______方向自发进行。
8.完成并配平下列化学反应方程式(用离子—电子法)
Mn2++ PbO2==MnO4-+Pb2+(酸性介质)
9.欲配制pH=9的缓冲溶液,已知下列物质解离常数K a0值或K b0值,问选择下列三种分子酸或分子碱及其共扼的离子碱或离子酸中那种最合适?____
(1)HCOOH,K a0=1.77×10-4,(2)HAc,K a0=1.74×10-5,(3)NH3·H2O,K b0=1.74×10-5。
10.在干冰晶体中,格点上的粒子为__,粒子之间的作用力为___。
11.某元素核外电子排布式1s22s22p63s23p63d54s2,则该元素的原子序数为__,元素符号为__,属于__周期,__族。
12.已知298K时下列热化学方程式:
(1)2NH3(g)==N2(g)+3H2(g), ⊿r H0=92.2kJ·mol-1,
(2)H2(g)+1/2O2(g)==H2O(g) ⊿r H0=-241.8kJ·mol-1,
(3)4NH3(g)+5O2(g)==4NO(g)+6H2O(g) ⊿r H0=-905.6kJ·mol-1,
试确定⊿f H0(NH3,g,298K)=__kJ·mol-1,⊿f H0(NO,g,298K)=__kJ·mol-1,⊿c H0(H2,g,298K)=__kJ·mol-1。
13.根据杂化轨道理论,N与F形成NF3时,采取___杂化,其分子构型为___,分子的偶极矩__0。
14.下列物质中,BaCl2,CsCl,FeCl3,SiCl4,___熔点最高。
15.下列物质中,SiO2,Au,NaCl,KCl。
___硬度最大。
三.计算题(40分)
1.在某一温度和1.0×105pa条件下,将一定量的SO3置于一密闭中,发生下列分解反应2SO3(g)== 2SO2(g) + O2(g),已知当反应达平衡时,SO3的离解度为27.2%,
试求此时该反应的标准平衡常数。
2.已知25℃时下列数据
⊿f H0(Ag2O,s)=-31.1kJ·mol-1,⊿f G0(Ag2O,s)=-11.2kJ·mol-1,
求反应Ag2O(s) =2Ag(s) +1/2O2(g)
(1)25℃时,上述反应O2的平衡分压;
(2)300℃时,上述反应O2的平衡分压;
(3)Ag2O(s)的热分解温度是多少?
(4)
3.用100ml1.0mol·L-1NH3·H2O溶液和3.0mol·L-1HCl溶液配制200mlpH=9.0的缓冲溶液,计算需此盐酸溶液多少毫升?已知NH3·H2O, K b0=1.8×10-5。
4.欲用3.0mol·L-1NH3氨水溶液中溶解0.10molAgCl,计算需要氨水的体积。
K0sp(AgCl)=1.8×10–10,K0f(Ag(NH3)2+)=1.1×10–7
5.已知25℃时下列原电池
(-)Ag∣AgBr︱Br-(1.00mol·L-1)‖Ag+(1.0mol·L-1)︱Ag(+)的电动势为0.7259V,计算
(1)E0(AgBr/Ag)的值
(2)AgBr的K0sp。
已知E0(Ag+/Ag)=0.7991V。