实验动物的抓取与固定
- 格式:ppt
- 大小:2.29 MB
- 文档页数:85

实验动物的抓取固定方法实验动物的抓取固定方法是指将实验动物固定在特定位置以便进行实验操作的方法。
正确的固定方法可以确保实验结果的准确性和可复现性,并且对实验动物的幸福指数也有较小的影响。
以下是一些常见的实验动物抓取固定方法:1.自由定位方法:适用于小型实验动物,如小鼠、大鼠等。
在实验开始前,将动物逐渐适应于实验室环境,让它们感到安全和舒适。
然后,将动物置于接触面积较小的透明塑料容器中,以避免其逃脱。
容器底部可以放置一张纸或软垫以提供舒适的表面。
动物可以自由运动,但不能逃离容器。
2.头部固定方法:适用于需要进行头部操作的实验,如脑电图记录、头部显微镜观察等。
首先,将实验动物固定在一个特定的装置上,如头部固定架或头部夹具。
固定时必须确保动物的头部完全固定,而身体其他部分可以保持自由运动。
可以使用软垫或减震器来提供额外的舒适度和安全性。
3.体位固定方法:适用于需要对实验动物进行全身操作的实验,如手术、注射等。
在体位固定前,需要逐渐让动物适应固定设备,以减少其压力和不适感。
然后,将动物放置在特定的固定装置上,如体位固定架或体位夹具。
固定时需要确保动物的四肢和身体部位被适当固定,同时保持头部和颈部的自由度以保证呼吸和进食。
4.高度限制方法:适用于需要控制动物行动范围的实验,如跑步机实验、挠痒实验等。
在进入实验环境之前,将实验动物逐渐适应于限制固定的空间以减少压力和不适感。
然后,将动物放置在一定高度的围栏或容器中,以限制其行动范围。
围栏或容器的高度应根据实验需要和动物种类来确定。
无论采用何种固定方法,都需要确保实验动物的福利和安全。
在固定过程中,应该定期检查动物的健康状况,并在固定结束后给予适当的休息和恢复时间。
此外,还应避免使用过于紧凑或不适合动物的固定设备,以防止造成动物的身体创伤或长期压力。
最重要的是,实验者应该尽量减少固定时间,并在实验结束后进行适当的养护和社交环境恢复,以保证实验动物的福祉。

固定小鼠通常是为了进行实验或研究目的,例如进行生物学研究或临床试验。
抓取和固定小鼠需要谨慎操作,以确保小鼠的安全和舒适性。
以下是常见的小鼠抓取和固定方法:
抓取小鼠:
1.手抓法:
o使用手指轻轻抓住小鼠的尾巴基部,提起小鼠,并将它移动到需要的位置。
这种方法对小鼠影响较小,但需要谨慎以避免伤害小
鼠尾巴。
2.抓耳法:
o将小鼠颈部和背部用手指轻轻固定住,然后用另一只手指抓住小鼠的一只耳朵。
这种方法适用于需要较长时间固定小鼠的情况。
固定小鼠:
1.手持法:
o将小鼠放在手掌上,用手指轻轻固定住小鼠的头部和尾部,确保小鼠不能轻易逃跑。
2.管道法:
o将小鼠放入一个合适大小的管道或透明容器中,使其移动受限。
这种方法可以用于限制小鼠的运动,但需注意容器通风和舒适
性。
3.握持法:
o使用特制的小鼠握持器或固定装置,将小鼠的身体部分固定住,以便进行实验操作。
在操作前确保握持器或装置不会对小鼠造成
损伤或不适。
无论使用何种方法,都需要谨慎、轻柔地操作,以减少对小鼠的压力和不适。
对小鼠的固定时间应尽量减少,避免对其造成过多的压力或不适。
最重要的是,确保操作符合实验室动物使用的伦理规范和法规要求。

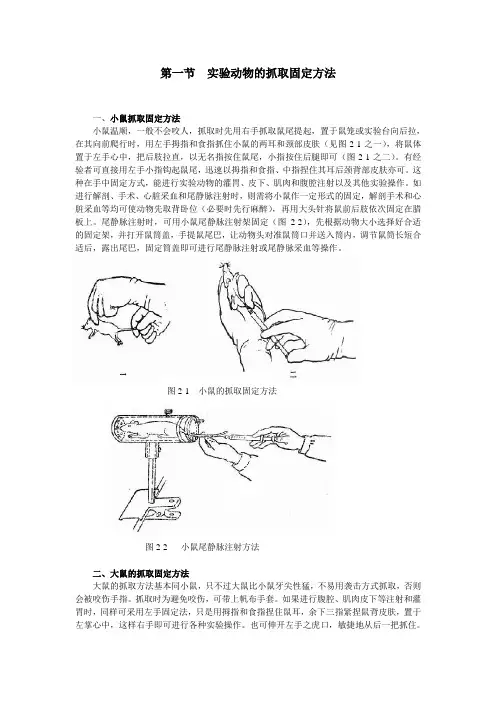
第一节实验动物的抓取固定方法一、小鼠抓取固定方法小鼠温顺,一般不会咬人,抓取时先用右手抓取鼠尾提起,置于鼠笼或实验台向后拉,在其向前爬行时,用左手拇指和食指抓住小鼠的两耳和颈部皮肤(见图2-1之一),将鼠体置于左手心中,把后肢拉直,以无名指按住鼠尾,小指按住后腿即可(图2-1之二)。
有经验者可直接用左手小指钩起鼠尾,迅速以拇指和食指、中指捏住其耳后颈背部皮肤亦可。
这种在手中固定方式,能进行实验动物的灌胃、皮下、肌肉和腹腔注射以及其他实验操作。
如进行解剖、手术、心脏采血和尾静脉注射时,则需将小鼠作一定形式的固定,解剖手术和心脏采血等均可使动物先取背卧位(必要时先行麻醉),再用大头针将鼠前后肢依次固定在腊板上。
尾静脉注射时,可用小鼠尾静脉注射架固定(图2-2),先根据动物大小选择好合适的固定架,并打开鼠筒盖,手提鼠尾巴,让动物头对准鼠筒口并送入筒内,调节鼠筒长短合适后,露出尾巴,固定筒盖即可进行尾静脉注射或尾静脉采血等操作。
图2-1 小鼠的抓取固定方法图2-2 小鼠尾静脉注射方法二、大鼠的抓取固定方法大鼠的抓取方法基本同小鼠,只不过大鼠比小鼠牙尖性猛,不易用袭击方式抓取,否则会被咬伤手指。
抓取时为避免咬伤,可带上帆布手套。
如果进行腹腔、肌肉皮下等注射和灌胃时,同样可采用左手固定法,只是用拇指和食指捏住鼠耳,余下三指紧捏鼠背皮肤,置于左掌心中,这样右手即可进行各种实验操作。
也可伸开左手之虎口,敏捷地从后一把抓住。
若做手术或解剖等,则需事先麻醉或处死,然后用细棉线绳活结缚腿,背卧位绑在大鼠固定板上;尾静脉注射时的固定同小鼠(只需将固定架改为大鼠固定盒)。
三、蛙类的抓取固定方法蛙类抓取方法宜用左手将动物背部贴紧手掌固定,以中指、无名指、小指压住其左腹侧和后肢,拇指和食指分别压住左、右前肢、右手进行操作(见图2-3)。
图2-3 蛙、蟾蜍抓取固定方法在抓取蟾蜍时,注意勿挤压其两则耳部突起之毒腺,以免毒液射进眼中。

实验动物的抓取和固定实验动物的抓取和固定在进行实验时,为了不损伤动物的健康,不影响观察指标,并防止被动物咬伤,首先要限制动物的活动,使动物处于安静状态,工作人员必须掌握合理的抓取固定方法。
抓取动物前,必须对各种动物的一般习性有所了解。
操作时要小心仔细、大胆敏捷、熟练准确、不能粗暴,不能恐吓动物,同时,要爱惜动物,使动物少受痛苦。
一、小鼠小鼠性情较温顺,一般不会咬人,比较容易抓取固定。
通常用右手提起小鼠尾巴将其放在鼠笼盖或其它粗糙表面上,在小鼠向前挣扎爬行时,用左手拇指和食指捏住其双耳及颈部皮肤,将小鼠置于左手掌心、无名指和小指夹其背部皮肤和尾部,即可将小鼠完全固定。
在一些特殊的实验中,如进行尾静脉注射时,可使用特殊的固定装置进行固定,如尾静脉注射架或粗的玻璃试管。
如要进行手术或心脏采血应先行麻醉再操作,如进行解剖实验则必须先行无痛处死后再进行。
二、大鼠大鼠的门齿很长,在抓取方法不当而受到惊吓或激怒时易将操作者手指咬伤,所以,不要突然袭击式地去抓它,取用时应轻轻抓住其尾巴后提起,置于实验台上,用玻璃钟罩扣住或置于大鼠固定盒内,这样即可进行尾静脉取血或注射。
如要作腹腔注射或灌胃等操作时,实验者应戴上棉纱手套(有经验者也可不戴),右手轻轻抓住大鼠的尾巴向后拉,但要避免抓其尖端,以防尾巴尖端皮肤脱落,左手抓紧鼠两耳和头颈部的皮肤,并将大鼠固定在左手中,右手即可进行操作。
三、家兔家兔比较驯服,不会咬人,但脚爪较尖,应避免家兔在挣扎时抓伤皮肤。
常用的抓取方法是先轻轻打开笼门,勿使其受惊,随后手伸入笼内,从头前阻拦它跑动。
然后一只手抓住兔的颈部皮毛,将兔提起,用另一只手托其臀,或用手抓住背部皮肤提起来,放在实验台上,即可进行采血、注射等操作。
因家兔耳大,故人们常误认为抓其耳可以提起,或有人用手挟住其腰背部提起均为不正确的操作。
在实验工作中常用兔耳作采血、静脉注射等用,所以家兔的两耳应尽量保持不受损伤。
家兔的固定方法有盒式固定和台式固定。
![一、实验动物抓取与固定的原则[精品]](https://uimg.taocdn.com/842f5e07cd7931b765ce0508763231126edb773d.webp)
一、实验动物抓取与固定的原则1.爱护动物的原则,避免抓取时对动物造成疼痛、不适、不安及其他应急反应。
2.选择最适合实验动物的固定方法的原则。
3.危险情况下,操作人员安全优先原则。
4.大胆、尽早固定的原则。
二、小鼠抓取与固定的操作程序1.用手抓取与固定的操作程序(1)用右手拇指和食指抓住尾部中央捏起来;(2)用手固定时把捏起来的小鼠放在笼子盖上,在动物向前挣的一瞬间,用左手的拇指和食指抓住颈背部到背中央的皮肤以固定其头部;(3)翻转抓住颈背部的左手,右手拉住小白鼠尾部再用左手的小指压住尾根部使小鼠整个呈一条直线。
2.固定器固定的操作程序(1)在无麻醉的情况下首先根据上述方法用左手将小鼠固定;(2)用乙醚麻醉时,可用长20~30CM的线绳分别捆住动物的四肢;(3)准备一个15~20cm的方木板,边缘楔入5个钉子;(4)把捆住四肢的线绳固定到固定台的钉子上固定,并且在头部上颚切齿的地方牵一根线绳以达到完全固定;(5)尾静脉给药时,可用专用的小鼠固定用容器,把小鼠放在里面只露出尾巴,再进行静脉注射。
3.特殊实验时的固定操作程序(1)进行手术或心脏采血时,应先行麻醉再操作;(2)进行解剖实验时,则必须先行无痛处死后再进行。
三、大鼠和沙鼠的抓取与固定操作程序1.用手抓取与固定的操作程序(1)左手食指按住动物的颈背部,拇指及其余3指放在胁部,食指和中指挟住左前肢,分开两前肢抓取动物,再用右手按住后肢固定。
(2)对受试动物进行给药时,用左手的拇指和食指抓住颈背部皮肤.其余3指抓住背部皮肤,小指和无名指挟住尾部牢牢固定。
(3)注意:4~5周龄以内的大鼠同小鼠一样抓住尾部提起来。
周龄较大的大鼠尾部皮肤因为容易被剥脱所以用左手从背部中央到胸部捏起来抓住。
2.固定器固定:同小鼠固定程序四、小鼠、大鼠和沙鼠性别鉴定的操作程序1.按照大鼠、小鼠和沙鼠的抓取与固定操作程序抓取动物;2.反转以上被抓取的动物,观察其外生殖器(阴蒂或阴茎)与肛门之间的距离;3.仔鼠性别判定以外生殖器(阴蒂或阴茎)与肛门之间的距离间隔短的是雌性,长的是雄性。

动物实验基本操作一、实验动物的抓取与固定。
(一)小鼠。
1. 抓取。
- 用右手拇指和食指捏住小鼠尾巴中部将其提起,放在鼠笼盖或其他粗糙表面上。
当小鼠向前挣扎时,用左手的拇指和食指迅速捏住小鼠两耳后颈背部皮肤,无名指和小指夹住小鼠尾巴根部,将小鼠固定成头部略向上的姿势。
- 原因:捏住尾巴提起小鼠可以避免小鼠咬伤操作人员,将其放在粗糙表面上是利用小鼠的本能反应(向前挣扎),便于后续准确抓取其颈背部皮肤。
而固定成头部略向上的姿势有利于进行诸如灌胃、注射等操作,并且能防止小鼠咬伤操作人员脸部等部位。
2. 固定。
- 如需进一步固定,可将小鼠放在特制的小鼠固定器内,将其身体和四肢固定好。
也可以将小鼠固定在泡沫板上,用大头针固定其四肢(这种方法常用于解剖实验)。
- 原因:使用固定器可以确保小鼠在实验过程中保持稳定,减少因挣扎而影响实验操作的准确性,同时也能保障操作人员的安全。
对于解剖实验,在泡沫板上用大头针固定四肢可以充分暴露小鼠的身体结构,便于进行精细的解剖操作。
(二)大鼠。
1. 抓取。
- 先用右手抓住大鼠尾巴中部,将大鼠提起,放在粗糙平面上。
然后用左手戴防护手套(大鼠体型较大且可能会激烈挣扎,容易咬伤操作人员),从大鼠背部绕到其胸前,拇指和食指捏住大鼠两耳后颈背部皮肤,其余手指握住大鼠身体,将其提起固定。
- 原因:与小鼠抓取类似,先抓住尾巴提起是为了初步控制大鼠,放在粗糙平面上利用其向前挣扎的本能便于后续抓取。
戴防护手套是因为大鼠的咬合力较强,为了防止操作人员受伤。
2. 固定。
- 可将大鼠放入大鼠固定器中固定。
对于需要进行手术等操作的大鼠,也可将其麻醉后固定在手术台上,用绑带固定其四肢。
- 原因:固定器和手术台固定都能保证大鼠在实验过程中保持稳定,使实验操作能够顺利进行,尤其是在进行需要精细操作的手术时,稳定的固定是确保手术成功的关键因素之一。
二、实验动物的给药操作。
(一)口服给药。
1. 灌胃法(以小鼠为例)- 准备好灌胃针(一般为特制的金属针具)和相应的药物溶液。



第一节实验动物的抓取固定方法实验动物的抓取和固定方法是实验前的重要步骤,为了保证实验结果的准确性和可靠性,合理的抓取和固定方法非常重要。
以下是一些常用的实验动物的抓取和固定方法,供参考。
一、小鼠的抓取和固定方法小鼠是常用的实验动物之一,其抓取和固定方法可以通过以下步骤完成:1.抓取方法:(1)轻轻拿起小鼠的尾部,将其抓起,使小鼠的前腿和后腿都可以在手指间自由移动。
(2)用食指和中指握住小鼠的脖子,使其头部静止,防止其乱动。
2.固定方法:(1)局部固定:可以使用一只手持住小鼠的尾部,另一只手用拇指和食指轻轻夹住小鼠的后脚,使小鼠无法移动。
(2)整体固定:将小鼠放置在适当大小的实验架上,使用尼龙绳或胶带固定小鼠的四肢,保持其整体静止。
二、大鼠的抓取和固定方法大鼠是较大的实验动物,其抓取和固定方法稍有不同,具体步骤如下:1.抓取方法:(1)用一只手握住大鼠的尾部部分,提起整个大鼠的身体。
(2)用另一只手支撑大鼠的胸部和腹部,使大鼠整体稳定。
2.固定方法:(1)局部固定:可以使用一只手持住大鼠的尾部,以及另一只手用拇指和食指夹住大鼠的后脚,使其无法移动。
(2)整体固定:将大鼠放置在适当大小的实验架上,使用尼龙绳或胶带固定大鼠的四肢和躯干,确保大鼠整体静止。
三、禽类的抓取和固定方法禽类实验动物包括鸡和鸽等,其抓取和固定方法可以通过以下步骤完成:1.抓取方法:(1)握住禽类动物的脚部,向上提起其整个身体。
(2)用另一只手握住禽类动物的颈部,使其头部静止。
2.固定方法:(1)局部固定:将禽类动物的脚部绑在实验台上,使其无法移动。
(2)整体固定:将禽类动物放置在适当大小的实验架上,使用尼龙绳或胶带固定禽类动物的四肢和躯干,确保整体静止。
以上是常见实验动物的抓取和固定方法,需要根据具体情况进行操作。
在进行实验前,一定要确保动物的舒适和安全,注意不要过度固定或受伤动物。
此外,实验过程中还需要定期观察动物的状态,并注意合理的康复和保健措施,以确保实验的准确性和动物的福利。

动物实验基本操作技术之一“实验动物抓取与固定”实验动物的抓取与固定是进行动物实验时的基本操作技术之一,确保实验动物在实验过程中能够稳定地保持固定的姿势,以便进行各种操作和测量。
本文将详细介绍实验动物抓取与固定的基本方法和注意事项。
一、实验动物的选取在选择实验动物时,要综合考虑实验的目的、动物的特性以及实验操作难度等因素。
常见的实验动物有小鼠、大鼠、兔子、猪等。
根据研究的需要,可以选择体型适中、繁殖能力强、易于操作和维护的动物品种。
二、实验动物的准备在进行实验前,需要对实验动物进行一系列的准备工作,以确保实验的准确性和动物的安全性。
1.饲养环境:提供适宜的饲养环境,包括恒温、恒湿的饲养箱、适当的饲料和水源等。
2.麻醉或镇痛:根据实验的需要,可以对动物进行麻醉或镇痛处理,以减轻实验操作对动物的伤害和痛苦。
3.消毒处理:在进行操作前,需要对实验器械、操作台面等进行消毒处理,以防止交叉感染。
三、实验动物抓取的方法在进行实验动物抓取时,可以根据实验的需要选择不同的方法。
1.手持抓取法:适用于小鼠等小型动物,操作者可以用手直接抓住动物的尾部或颈部,保持动物的姿势。
这种方法简单方便,但不适用于进行需要长时间固定的实验。
3.麻醉固定法:适用于大鼠、兔子、猪等体型较大的动物,可以在进行一些需要比较复杂的操作时使用。
在进行麻醉固定时,需要注意选择适宜的麻醉方法和药物,以确保动物的安全。
四、实验动物固定的方法固定实验动物的目的是为了保持动物在实验过程中的稳定性,以便进行各种操作和测量。
常见的实验动物固定方法有以下几种:1.割裂固定法:适用于进行小鼠、大鼠等小型动物的实验。
可以将动物的四肢用绳子或胶布固定在特制的操作平台上,确保动物保持特定的姿势不动。
2.弹簧夹固定法:适用于小鼠、大鼠等小型动物的实验。
可以使用特制的弹簧夹将动物的四肢固定在操作台上,并通过调节夹子的松紧度来控制动物的运动范围。
3.麻醉固定法:适用于大鼠、兔子、猪等体型较大的动物。
二、实验动物的抓取固定方法正确的抓取固定动物,是为了不损害动物健康,不影响观察指标,并防止被动物咬伤,保证实验顺利进行。
抓取固定动物的方法依实验内容和动物类而定。
抓取固定动物前,必须对各种动物的一般习性有所了解,抓取固定时既要小心仔细,不能粗暴,又要大胆敏捷,确实达到正确抓取固定动物的目的。
(一)小鼠抓取固定方法小鼠温顺,一般不会咬人,抓取时先用右手抓取鼠尾提起,置于鼠笼或实验台向后拉,在其向前爬行时,用左手拇指和食指抓住小鼠的两耳和颈部皮肤(见图11-1之一),将鼠体置于左手心中,把后肢拉直,以无名指按住鼠尾,小指按住后腿即可(图11-1之二)。
人经验者直接用左手小指钩起鼠尾,迅速以拇指和食指、中指捏住其耳后颈背部皮肤亦可。
种在手中固定方式,能进行实验动物的灌胃、皮下、肌肉和腹腔注射以及其他实验操作。
如进行解剖、手术、心脏采血和尾静脉注射时,则需将小鼠作一定形式的固定,解剖手术和心脏采血等均可使动物先取背卧位(必要时先行麻醉),再用大头针将鼠前后肢依次固定在腊板上。
尾静脉注射时,可用小鼠尾静脉注射架固定(图11-2),先根据动物大小选择好合适的固定架,并打开鼠筒盖,手提鼠尾巴,让动物头对准鼠筒口并送入筒内,调节鼠筒长短合适后,露出尾巴,固定筒盖即可进行尾静脉注射或尾静脉采血等操作。
图11-1小鼠的抓取固定方法图11-2 小鼠尾静脉注射方法(二)大鼠的抓取固定方法大鼠的抓取斯基本同小鼠,只不过大鼠比小鼠牙尖性猛,不易用袭击方式抓取,否则会被咬伤手指,抓取时为避免咬伤,可带上帆布手套。
如果进行腹腔、肌肉皮下等注射和灌胃时,同样可采用左手固定法,只是用拇指和食指捏住鼠耳,余下三指紧捏鼠背皮肤,置于左掌心中,这样右手即可进行各种实验操作。
也可伸开左手之虎口,敏捷地从后,一把抓住。
若做手术或解剖等,则需事先麻醉或处死,然后用细棉线绳活缚腿,背卧位绑在大鼠固定板上;尾静脉注射时的固定同小鼠(只需将固定架改为大鼠固定盒即可)。
实验动物抓取固定方法1.笼子抓取法:适用于小鼠、大鼠等小型实验动物。
方法是将一个适合大小的笼子放在动物的运动路径上,当动物进入笼子时,迅速抓住并将其顺利转移到目的地。
2.手抓法:适用于小鼠、大鼠等小型实验动物。
这种方法需要熟练的操作技巧。
首先,用非主手将动物颈部皮肤轻轻拉起,用主手迅速抓住动物的尾巴,同时用和抓尾巴相同的手指夹住动物的后躯(肋骨位置),这样可以保持动物的身体直立。
接着再用非主手将动物的头部牵引向上,使动物保持身体直立。
最后将动物缓慢地抬起,握紧,并将它放入适当大小的容器中。
这个过程需要迅速而顺利地完成,以减少动物的压力。
3.用布袋抓取法:适用于小鼠、大鼠、兔子、禽类等。
方法是利用一块布袋或塑料袋,将袋口留出足够大的空间,把袋子的其他部分紧紧包裹住动物的身体。
将袋子封闭,并将动物转移到目标地点。
4.罚式抓取法:适用于猫、狗等大型实验动物。
这种方法需要两个人协作进行。
首先,一个人用一个尺寸大小合适的网袋迅速包裹住动物的头部和前肢。
包裹完成后,另一个人迅速抓住动物的后肢,将其固定住。
然后将动物移动到目标地点进行进一步操作。
5.镊子抓取法:适用于小型爬行动物、鸟类等。
这种方法需要使用特殊的长镊子,在妥善保护动物的情况下,迅速抓住动物的身体或头部,将其转移到目标地点。
在进行实验动物抓取操作时,需要注意以下几点:1.抓取前准备工作:提前准备好需要使用的器具,并确保这些器具是干净且符合卫生标准的。
另外,需要确保实验场地的整洁,以减少动物受到惊吓和压力。
2.动作迅速而准确:抓取动作需要迅速而准确地进行,以减少对动物的影响和压力。
抓取人员应该经过专业培训,具备熟练的抓取技巧。
3.确保动物的安全:在抓取过程中,需要保持对动物的安全和福利的关注。
抓取时需要轻柔而稳定地操作,确保不对动物的身体和器官造成损伤。
4.适当使用镇静剂:对于一些较大、较凶猛的实验动物,可以在抓取前适当使用镇静剂,以降低动物的压力和困扰,并提高抓取的安全性。