2020版高考化学一轮复习专项突破20强弱电解质的相关图像课件鲁科版
- 格式:ppt
- 大小:1.35 MB
- 文档页数:14
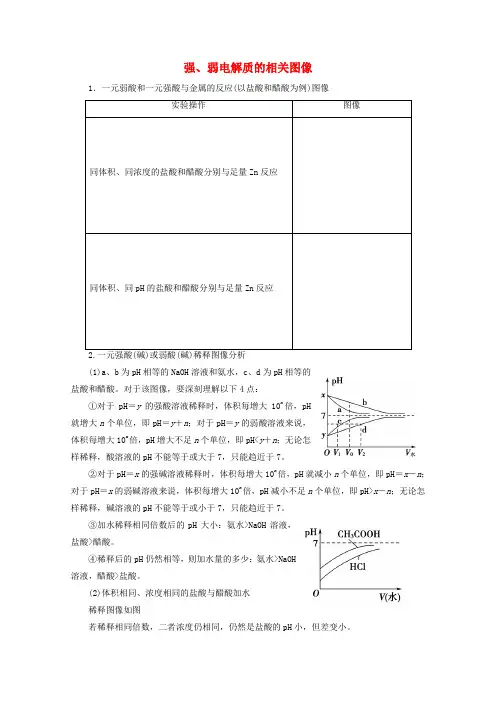
强、弱电解质的相关图像1.一元弱酸和一元强酸与金属的反应(以盐酸和醋酸为例)图像(1)a、b为pH相等的NaOH溶液和氨水,c、d为pH相等的盐酸和醋酸。
对于该图像,要深刻理解以下4点:①对于pH=y的强酸溶液稀释时,体积每增大10n倍,pH就增大n个单位,即pH=y+n;对于pH=y的弱酸溶液来说,体积每增大10n倍,pH增大不足n个单位,即pH<y+n;无论怎样稀释,酸溶液的pH不能等于或大于7,只能趋近于7。
②对于pH=x的强碱溶液稀释时,体积每增大10n倍,pH就减小n个单位,即pH=x-n;对于pH=x的弱碱溶液来说,体积每增大10n倍,pH减小不足n个单位,即pH>x-n;无论怎样稀释,碱溶液的pH不能等于或小于7,只能趋近于7。
③加水稀释相同倍数后的pH大小:氨水>NaOH溶液,盐酸>醋酸。
④稀释后的pH仍然相等,则加水量的多少:氨水>NaOH溶液,醋酸>盐酸。
(2)体积相同、浓度相同的盐酸与醋酸加水稀释图像如图若稀释相同倍数,二者浓度仍相同,仍然是盐酸的pH小,但差变小。
提醒:不论怎样稀释,酸溶液的pH不能等于或大于7,碱溶液的pH不能等于或小于7,都只能趋近于7。
[典例导航](2015·全国卷Ⅰ)浓度均为0.10 mol·L-1、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg V V 0的变化如图所示,下列叙述错误的是( )A .MOH 的碱性强于ROH 的碱性B .ROH 的电离程度:b 点大于a 点C .若两溶液无限稀释,则它们的c (OH -)相等D .当lg V V 0=2时,若两溶液同时升高温度,则c +c +增大 [思路点拨] ①lg VV 0=2时,稀释100倍,根据MOH 、ROH 的pH 变化⇒MOH 为强碱、ROH为弱碱。
②加水稀释,促进弱碱的电离⇒ROH 的电离程度b>a 。






大一轮复习讲义第6章化学反应与能量转化考纲要求KAOGANGYAOQIU1.理解电解池的构成、工作原理及应用。
2.能书写电极反应和总方程式。
内容索引NEIRONGSUOYIN考点一电解的原理考点二电解原理的应用探究高考明确考向课时作业01考点一电解的原理1.电解和电解池(1)电解:在______作用下,电解质在两个电极上分别发生___________和___________的过程。
(2)电解池:______转化为________的装置。
(3)电解池的构成①有与______相连的两个电极。
②_____________(或_____________)。
③形成__________。
知识梳理ZHISHISHULI电流氧化反应还原反应电能化学能电源电解质溶液熔融电解质闭合回路2.电解池的工作原理(1)电极名称及电极反应式(电解CuCl 2溶液为例)总反应式:CuCl 2=====通电Cu +Cl 2↑阳极氧化Cu 2++2e -===Cu阴极还原2Cl --2e -=== Cl 2↑(2)电子和离子的移动方向①电子:从电源________流出后,流向电解池阴极;从电解池的_______流出后流向电源的正极。
②离子:阳离子移向电解池的_____,阴离子移向电解池的______。
3.阴阳两极上放电顺序(1)阴极:(与电极材料无关)。
氧化性强的先放电,放电顺序:负极阳极阴极阳极(2)阳极:若是活性电极作阳极,则活性电极首先失电子,发生氧化反应。
若是惰性电极作阳极,放电顺序为注意①阴极不管是什么材料,电极本身都不反应,一定是溶液(或熔融电解质)中的阳离子放电。
②最常用、最重要的放电顺序为阳极:Cl->OH-;阴极:Ag+>Cu2+>H+。
③电解水溶液时,K+~Al3+不可能在阴极放电,即不可能用电解水溶液的方法得到K、Ca、Na、Mg、Al等金属。
4.用惰性电极电解电解质溶液的规律类型实例电极反应特点或反应式电解产物溶液pH变化溶液复原电解水型含氧酸H2SO4溶液中的H+和OH-分别在阴阳两极放电:阴极:___________________阳极:_________________________H2O2强碱NaOH活泼金属的含氧酸盐KNO34H++4e-===2H2↑4OH--4e-===2H2O+O2↑水减小增大不变电解电解质型无氧酸(氢氟酸除外)HCl电解质电离的阴阳离子分别在两极放电:阳极:________________H2Cl2不活泼金属的无氧酸盐CuCl2Cu Cl2放氢生碱型活泼金属的无氧酸盐NaCl阴极水电离的H+放电,阳极电解质电离的阴离子放电阴极:__________________阳极:______放氧生酸性不活泼金属的含氧酸盐AgNO3阳极水电离的OH-放电,阴极电解质的阳离子放电阴极:______________Ag阳极:_______2Cl--2e-=== Cl2↑增大CuCl2(或H2、NaOH)HCl增大H2Cl2HClAg++e-===AgO2Ag2O减小(1)电解质溶液的导电过程就是电解质溶液被电解的过程()(2)某些不能自发进行的氧化还原反应,通过电解可以实现()(3)直流电源跟电解池连接后,电子从电源负极流向电解池阳极()(4)电解稀硫酸制H 2、O 2时,可用不活泼的铜做阳极()(5)电解CuCl 2溶液,阴极逸出的气体能够使湿润的淀粉碘化钾试纸变蓝色()(6)电解盐酸、硫酸等溶液,H +放电,溶液的pH 均增大()辨析易错易混·正误判断×√√×××1.根据金属活动性顺序表,Cu 和稀H 2SO 4不反应,怎样根据电化学的原理实现Cu 和稀H 2SO 4反应产生H 2?提升思维能力·深度思考答案Cu 做阳极,C 做阴极,稀H 2SO 4做电解质溶液,通入直流电就可以实现该反应。

第25讲弱电解质的电离平稳考纲要求 1.了解电解质的概念,了解强电解质和弱电解质的概念。
2.明白得电解质在水中的电离和电解质溶液的导电性。
3.明白得弱电解质在水中的电离平稳,能利用电离平稳常数(K a、K b)进行相关计算。
考点一弱电解质的电离平稳1.弱电解质(1)概念(2)与化合物类型的关系强电解质主若是大部份离子化合物及某些共价化合物,弱电解质主若是某些共价化合物。
2.弱电解质的电离概念(1)电离平稳的成立在必然条件下(如温度、压强等),当弱电解质电离产生离子的速度和离子结合成份子的速度相等时,电离进程达到了平稳。
(2)电离平稳的成立与特点①开始时,v(电离)最大,而v(结合)为0。
②平稳的成立进程中,v(电离)>v(结合)。
③当v(电离)=v(结合)时,电离进程达到平稳状态。
3.外因对电离平稳的阻碍(1)浓度:在必然温度下,同一弱电解质溶液,浓度越小,越易电离。
(2)温度:温度越高,电离程度越大。
(3)同离子效应:加入与弱电解质具有相同离子的电解质时,可使电离平稳向结合成弱电解质分子的方向移动。
(4)化学反映:加入能与弱电解质电离出的离子反映的物质时,可使电离平稳向电离方向移动。
如:以mol·L-1CH3COOH溶液为例,填写外界条件对CH3COOH CH3COO-+H+ΔH >0的阻碍。
改变条件平衡移动方向n(H+)c(H+)导电能力K a加水稀释向右增大减小减弱不变加入少量冰醋酸向右增大增大增强不变通入HCl(g)向左增大增大增强不变加NaOH(s)向右减小减小增强不变加CH3COONa(s)向左减小减小增强不变加入镁粉向右减小减小增强不变升高温度向右增大增大增强增大(1)强电解质稀溶液中不存在溶质分子,弱电解质稀溶液中存在溶质分子(√)(2)氨气溶于水,当NH3·H2O电离出的[OH-]=[NH+4]时,说明NH3·H2O电离处于平稳状态(×)(3)室温下,由mol·L-1一元碱BOH的pH=10,可知溶液中存在BOH===B++OH-(×)(4)电离平稳右移,电解质分子的浓度必然减小,离子浓度必然增大(×)(5)25 ℃时,mol·L-1 CH3COOH加水稀释,各离子浓度均减小(×)(6)电离平稳向右移动,弱电解质的电离度必然增大(×)解析(2)NH3+H2O NH3·H2O NH+4+OH-,NH3·H2O电离出的[OH-]与[NH+4]永久相等,不能说明NH3·H2O电离处于平稳状态。

大一轮复习讲义第2章元素与物质世界考纲要求KAOGANGYAOQIU1.了解电解质的概念,了解强电解质和弱电解质的概念。
2.理解电解质在水中的电离以及电解质溶液的导电性。
3.了解离子反应的概念、离子反应发生的条件,能正确书写离子方程式并能进行有关计算。
内容索引NEIRONGSUOYIN考点一电解质及电离考点二离子反应和离子方程式书写的基本方法考点三离子方程式的正误判断探究高考明确考向课时作业01考点一电解质及电离知识梳理ZHISHISHULI1.电解质及其分类答案①电离②强电解质③强酸④强碱⑤弱电解质⑥弱酸⑦弱碱⑧水溶液⑨熔融即时巩固下列物质中,属于电解质的是__________,属于非电解质的是________,属于强电解质的是________,属于弱电解质的是_____。
(填序号)①H 2SO 4②盐酸③氯气④硫酸钡⑤乙醇⑥铜⑦H 2CO 3⑧氯化氢⑨蔗糖⑩氨气⑪CO 2⑦①④⑦⑧⑤⑨⑩⑪①④⑧2.熟记常见的强电解质和弱电解质(1)强电解质强酸:HSO4、HNO3、HCl、HBr、HI、HClO42强碱:NaOH、KOH、Ba(OH)2盐:盐不论难溶、易溶,大多数盐都是强电解质(2)弱电解质弱酸:CHCOOH、HClO、HF、HCN、H2SO3、H2S、H2CO3、H3PO43弱碱:NH·H2O3水及少数盐,如(CHCOO)2Pb33.电离方程式的书写自由移动(2)电离方程式①强电解质完全电离,用“____”表示,写出下列物质在水溶液中的电离方程式。
(NH 4)2SO 4:;BaSO 4:;KAl(SO 4)2:。
②弱电解质部分电离,用“_____”表示,多元弱酸的电离分步书写,多元弱碱分步电离一步书写。
写出下列物质在水溶液中的电离方程式:NH 3·H 2O :;H 2CO 3:。
H 2CO 3H ++、H ++NH 3·H 2O +OH -(NH 4)2SO 4===2 +BaSO 4===Ba 2++KAl(SO 4)2=== K ++Al 3++2NH +4 SO 2-4 SO 2-4 SO 2-4 NH +4 CO 2-3 HCO -3 HCO -3 ===HCO -3 ③酸式盐的电离。
