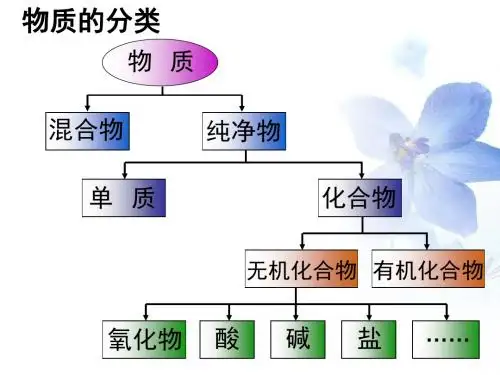
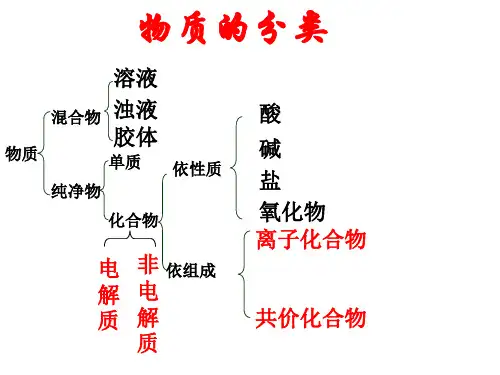
知识点 2 电解质的电离与溶液的导电性
【例题2】 下列叙述正确的是( ) A.NaCl溶液在电流作用下电离成Na+和ClB.NaCl是电解质,故NaCl晶体能导电 C.氯化氢溶于水能导电,但液态氯化氢不能导电 D.导电性强的溶液里自由移动离子数目一定比导电性弱的溶液 里自由移动离子数目多 解析:NaCl固体溶于水,在水分子的作用下,电离出自由移动的Na+ 和Cl-,而不是电流的作用,A错误;NaCl是电解质,但晶体中Na+和Cl不能自由移动,故NaCl晶体不导电,B错误;HCl液态时不导电,但溶 于水能电离出H+和Cl-,故C正确;溶液导电性强弱与离子的浓度和 离子所带电荷多少有关,而非离子数目,D错误。 答案:C
CO2和SO2的水溶液均导电,它们是电解质吗? 提示:不是。电解质必须是在水溶液里或熔融状态下自身发生电 离的化合物,而CO2和SO2的水溶液之所以导电,是因为它们与水反 应生成了电解质H2CO3和H2SO3,所以CO2和SO2是非电解质。
二、电解质的电离
1.定义
电解质在水溶液里或熔融状态下离解成自由移动离子的过程。
三、电离方程式的书写要点 1.质量守恒:“ ”两边原子种类、数目、质量不变。 2.电荷守恒:正电荷总数=负电荷总数。 3.电离过程中,原子团并不拆开。 4.元素或原子团的正价数等于形成的阳离子所带的正电荷数。 同理,元素或原子团的负价数等于形成的阴离子所带的负电荷数。 离子的个数用阿拉伯数字标在离子符号之前。
点拨电解质的电离与是否有外加电流没有关系,电解质电离的外 部条件是将电解质溶于水或者将电解质熔化。
知识点 3 电离方程式的书写
【例题 3】 下列电离方程式书写正确的是( )
A.NaOH B.NaOH