第二节电解质和非电解质PPT课件
- 格式:ppt
- 大小:42.00 KB
- 文档页数:7







电解质和非电解质课件电解质和非电解质是化学中的两个重要概念。
它们在溶液中的行为和性质不同,对于理解化学反应和电解过程有着重要的意义。
本课件将详细介绍电解质和非电解质的定义、特性、溶解度等内容,帮助大家更好地理解这两个概念。
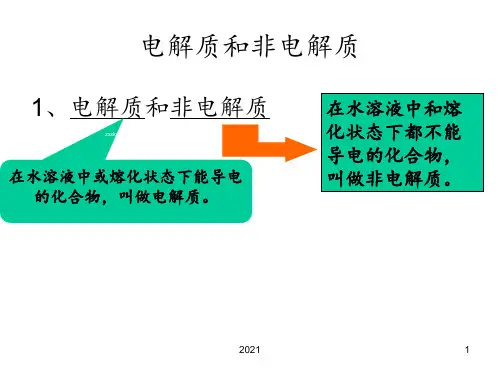
一、电解质的定义和特性电解质是指在溶液或熔融状态下能够导电的物质。
它可以分为强电解质和弱电解质两种。
1. 强电解质强电解质在溶液中能够完全离解成离子。
常见的强电解质包括无机酸、无机碱、盐类等。
它们在水中溶解时,能够生成大量的离子,使溶液具有良好的导电性。
2. 弱电解质弱电解质在溶液中只能部分离解成离子。
大部分有机物质属于弱电解质,如醋酸、酒精等。
弱电解质的离解程度较低,因此其溶液的导电性较差。
二、非电解质的定义和特性非电解质是指在溶液中不能导电的物质。
它主要包括分子化合物和某些共价键很强的化合物。
非电解质的分子在溶液中不会离解成离子,因此不具有导电性。
常见的非电解质包括水、乙醇、蔗糖等。
这些物质在溶液中的分子之间通过弱作用力相互吸引,不会产生离子。
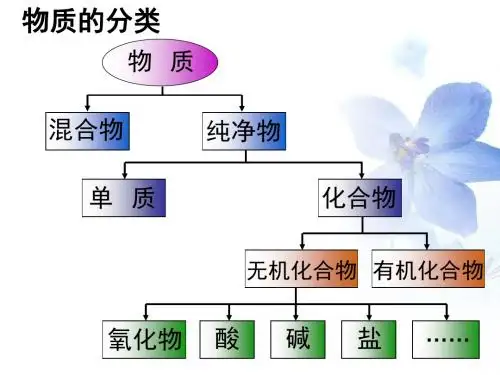
三、溶解度与电解质、非电解质的关系溶解度是指单位温度和压力下,溶质在溶剂中达到平衡时的最大溶解量。
电解质和非电解质的溶解度存在一定的差异。
1. 电解质的溶解度强电解质的溶解度通常较高。
由于其能够完全离解成离子,进一步提高了其在溶液中的溶解度。
但需要注意的是,溶解度并不唯一,还会受温度、压力等因素的影响。
2. 非电解质的溶解度非电解质的溶解度相对较低。
由于非电解质的分子在溶液中不离解成离子,只是通过弱作用力与溶剂分子相互作用,因此溶液中的非电解质浓度较低。
总结:电解质和非电解质是化学中两个重要的概念。
电解质在溶液中能够导电,分为强电解质和弱电解质两种;非电解质在溶液中不能导电,溶解度较低。
了解电解质和非电解质的区别和特性,对于理解化学反应、电解过程以及溶液的性质具有重要意义。
以上就是关于电解质和非电解质的简要介绍。
希望这份课件能够对大家有所帮助,加深对这两个概念的理解。