2020年高中化学竞赛路易斯共价键理论
- 格式:ppt
- 大小:1.88 MB
- 文档页数:40


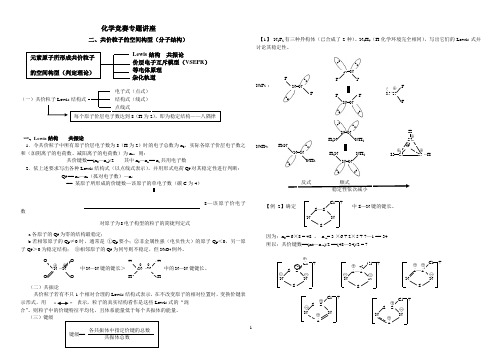
化学竞赛专题讲座二、共价粒子的空间构型(分子结构)Lewis 结构 共振论 价层电子互斥模型(VSEPR ) 等电体原理 杂化轨道一、Lewis 结构 共振论1.令共价粒子中所有原子价层电子数为8(H 为2)时的电子总数为n 0,实际各原子价层电子数之和(加阴离子的电荷数、减阳离子的电荷数)为n v ,则:共价键数==(n 0—n v )/2 其中n 0—n v == n s 共用电子数2.依上述要求写出各种Lewis 结构式(以点线式表示),并用形式电荷Q F 对其稳定性进行判断:Q F == n v —n r (孤对电子数)—n s== 某原子所形成的价键数—该原子的单电子数(碳C 为4)8—该原子价电子数a.各原子的Q F 为零的结构最稳定;b.若相邻原子的Q F ≠0时,通常是 ①Q F 要小;②非金属性强(电负性大)的原子Q F <0,另一原子Q F >0为稳定结构; ③相邻原子的Q F 为同号则不稳定,但N 2O 4例外。
(二)共振论个相对合理的Lewis 结构式表示,在不改变原子的相对位置时,变换价键表示形式,用Lewis 式的“混合”(三)键级【1】 N 2F 2有三种异构体(已合成了2种)、N 4H 4(H 化学环境完全相同),写出它们的Lewis 式并讨论其稳定性。
N 2F 2 :N 4H 4:因为:n 0 = 6³8 = 48 , n v = 3 ³6 + 2³5 + 7—1 == 34 所以:共价键数==(n 0—n v )/2 ==(48—34)/2 = 7较稳定 最稳定(S=N 键的键长最短)对原子为8电子构型的粒子的简捷判定式各共振体中指定价键的总数键级== N=N N=N N=N N=N N=NCl +S —S N N S⊕+2Cl +S —S N N S⊕+2Cl +S —S N N S⊕ ⊕ Cl +S —S N NS⊕⊕ O O N —N O O ⊕ ⊕ H HN—N H H0 0 中N —N 键的键长> 中的N —N 键键长。

高中化学奥林匹克竞赛辅导《共价键与分子结构》专题训练知识总结1.共价键理论:(1)路易斯(Lewis)共价键理论:路易斯共价键理论在价键理论的发展史上起到了继往开来的作用,但存在诸多不足,如不能解释共价键的本质和特性、八隅体的例外情况(如BF3)、氧气分子的顺磁性等问题。
(2)价键理论:简称VB法,又称电子配对法。
价键理论说明了共价键的本质、特征和类型,解单电子,根据价键理论只能形成两个C-H键,但CH4能形成4个C-H键,且4个C-H键完全等同,甲烷分子构型为正四面体,这些都是价键理论无法解释的。
(3)杂化轨道理论:元素原子形成分子时由于原子之间存在相互影响,使若干不同类型能量相近的原子轨道混合起来,重新组合成一组新的轨道的过程叫杂化,所形成的新轨道叫做杂化轨道。
为等性杂化与不等性杂化。
杂化轨道理论的提出解释了甲烷、水分子等的立体构型,但在不知道立体构型的情况下,杂化轨道理论并不能判断分子或离子中心原子的杂化类型,也不能预测分子或离子的立体构型。
(4)价层电子对互斥理论(Valence Shell Electron Pair Repulsion,VSEPR):运用该理论可以对分子或离子的立体构型进行预测。
价层电子对互斥理论的中心思想是在共价分子或离子中,中心原子周围的价层电子对尽可能采用使其本身受到静电排斥力最小的几何构型。
NH3分子的中心原子N周围有3对N-H成键电子对和1对孤对电子,即价层电子对总数为4;CH4分子中心原子C周围4对成键电子对,无孤对电子,价层电子对数也为4。
2.应用价层电子对互斥理论预测AX m型的共价分子或离子的立体构型:(1)先计算中心原子周围的价层电子对数n:n=(中心原子价电子数+外围原子提供的价电子数±离子电荷)/2在计算价层电子对数时需要注意的是:a.氧族元素(如O、S等)做外围原子时不提供电子,作为中心原子时提供6个电子。
b.计算阴离子中心原子的价层电子对时要加上阴离子的带电量,计算阳离子中心原子的价层电子对计算时要减去阳离子的带电量。


高一化学竞赛辅导《共价键与分子结构》共价键与分子结构共价键理论1、共价键的成键原理价键的形成可以看作是原子轨道重叠或电子配对的结果。
两个原子如果都有未成键的电子,并且自旋方向相反,就能配对,也就是原子轨道可重叠形成共价键。
重叠部分越大,所形成的共价键就越牢固。
(键长越短,键能越大)由一对电子形成的共价键叫做单键,如果原子各有二个或三个未成键的电子,构成的共价键则是双键或叁键。
这一理论最早是由路易斯(1916年,G.C.Lewis,美国化学家),所以我们通常所说电子式又称为路易斯结构式。
在路易斯结构式中,线段的意义,如前所述,代表共用电子对,仍称“单键”、“双键”和“叁键”(代表1,2,3对共用电子对)。
成对的小黑点则代表未用来形成化学键的“价层电子对”,叫做“孤对电子对”(有时分子里有单个的非共用电子,如NO2)。
对于无机物,写路易所结构式就要困难得多。
但大多数情况下,“八偶律”仍是起作用的。
从上面已经写出的路易斯结构式里我们很容易发现这一点。
但有时八偶律不起作用。
主要有两种例外。
①缺电子结构——价电子,包括形成共价键的共用电子对之内,少于8电子的,称为缺电子结构。
例如,第3主族的硼和铝,中性原子只有3个价电子,若一个硼原子和其它原予形成3个共用电子对,也只有6个电子,这就是缺电子结构。
典型的例子有BCl3、AlCl3(这些化学式是分子式,即代表一个分子的结构)。
缺电子结构的分子有接受其它原子的孤对电予形成配价键的能力。
例如:BCl3+:NH3=Cl3B←NH3②多电子结构例如,PCl5里的磷呈5价,氯呈1价。
中性磷原予的价电子数为5。
在PCl5磷原子的周围的电子数为10,超过8。
这种例外只有第3周期或更高周期的元素的原子才有可能出现。
2、共价键的特性①饱和性。
当原子的未成键的一个电子与某原子的一个电子配对之后,就不能再和第三个电子配对了,这就是共价键的饱和性。
②方向性。
成键时,两个电子的原子轨道发生重叠,重叠部分的大小决定共价键的牢固程度。
第六讲 共价键理论一、经典共价键理论− Lewis Structure (八电子规则)1916年,美国化学家路易斯(G.N.Lewis )提出:分子中每个原子应具有稳定的稀有气体原子的电子层结构。
这种稳定结构通过原子间共用一对或若干对电子来实现。
这种分子中原子间通过共用电子对结合而成的化学键称为共价键。
1.基本思想:当n s 、n p 原子轨道充满电子,成为八电子构型,该电子构型稳定,所以在共价分子中,每个原子都希望成为八电子构型(H 原子为2电子构型)。
2.共价分子中成键数和孤电子对数的计算:计算步骤:a .令n o − 共价分子中,所有原子形成八电子构型(H 为2电子构型)所需要的电子总数b .令n v − 共价分子中,所有原子的价电子数总和阴离子的价电子总数:各原子的价电子数之和加负电荷数 阳离子的价电子总数:各原子的价电子数之和减正电荷数 c .令n s − 共价分子中,所有原子之间共用电子总数n s = n o - n v ,n s /2 = (n o - n v ) / 2 = 成键电子对数(成键数) d .令n l − 共价分子中,存在的孤电子数。
(或称未成键电子数) n l = n v - n s ,n l /2 = (n v - n s )/2 = 孤对电子对数例如:P 4S 3、HN 3、N +5、H 2CN 2(重氮甲烷)、NO -33.Lewis 结构式的书写 例如:P 4S 3HN 3HN N N H N N N HNNNN 5+,,,NN N NN NN N NN NN N NN NN N N NCH 2N 2(重氮甲烷) ,HCHNN HC HNN(有时,孤对电子省略不写。
)练习:下列各Lewis 结构式中,能正确表示出NO 3-离子的Lewis 结构式是A. NO O O B. NO O O C. NO O OD. NO OO当Lewis 结构式不只一种形式时,如何来判断这些Lewis 结构式的稳定性呢?4.Lewis 结构式稳定性的判据 −− 形式电荷Q F (1) Q F 的由来: 以CO 为例n o = 2 ⨯ 8 = 16 n v = 4 + 6 =10 n s / 2 = (16 - 10) / 2 = 3 n l / 2 = (10 - 6) / 2 = 2为了形成三对平等的共价键,可以看作O 原子上的一个价电子转移给C 原子,即: ,所以氧原子的Q F 为+1,碳原子的Q F 为-1。