人教版高中化学选择性必修二教案:共价键的极性
- 格式:docx
- 大小:494.32 KB
- 文档页数:7


第2课时共价键三维目标1.知识与技能(1)知道共价键的概念;(2)了解极性键和非极性键的概念;(3)能用电子式表示共价化合物的形成过程。
2.过程与方法(1)通过对共价键形成过程的学习,培养学生抽象思维和综合概括的能力;(2)通过离子键和共价键的学习,培养学生对微观粒子运动的想象力。
3.情感态度与价值观(1)培养学生用对立统一规律认识问题;(2)通过对共价键形成过程的分析,培养学生怀疑、求实、创新的精神;(3)培养学生由个别到一般的研究问题的方法,使学生领会从宏观到微观,从现象到本质的认识事物的科学方法。
教学重点共价键和共价化合物的概念理解;化学反应的本质理解。
教学难点共用电子对的理解;极性键和非极性键的理解。
课前准备多媒体平台:共价键形成的动画。
教学过程知识回顾回顾氯化钠的形成,离子键的概念、实质、形成条件。
复习原子、离子、分子的电子式以及离子化合物的形成过程的书写。
写出下列物质的电子式:Mg3N2、PH3、K2O导入新课我们知道钠在氯气中燃烧生成氯化钠,由于钠原子容易失去1个电子形成阳离子,氯原子容易得到1个电子形成阴离子,然后钠离子和氯离子间通过静电作用形成了氯化钠这种离子化合物。
那我们在初中学习过的共价化合物HCl的形成和NaCl的形成一样吗?H2和Cl2在点燃或光照的情况下,H2和Cl2分子分别被破坏形成氢原子和氯原子,当氢原子和氯原子相遇时是通过什么样的方式结合在一起的呢?是通过阴阳离子间静电作用结合在一起的吗?推进新课[分析]两种非金属元素的原子化合时,原子间并不是一方失去电子形成阳离子,一方得到电子形成阴离子来形成相互作用力的,而是原子间共用最外层上的电子,形成共用电子对以使原子双方均达到稳定的电子层结构。
共用电子对同时受到两个原子核的吸引,从而将两个原子紧密地联系在一起,如同双面胶把两个小球黏在一起。
[投影]氯原子之间通过共价键形成氯气分子的动画。
[分析]我们以氯原子为例来探讨一下氯分子的形成。


第2章分子结构与性质2.3.1 共价键的极性一.选择题(共10小题)1.分子有极性分子和非极性分子之分。
下列对极性分子和非极性分子的认识正确的是()A.只含非极性键的分子一定是非极性分子B.含有极性键的分子一定是极性分子C.非极性分子一定含有非极性键D.极性分子一定含有极性键【答案】D【解析】键的极性是由组成共价键的原子是否相同决定,而分子的极性由键的极性和分子的空间构型共同决定。
只含非极性键的分子不一定是非极性分子(O3为极性分子)、极性分子一定含有极性键,而含有极性键的分子、当空间构型非常对称时也可能为非极性分子,例如CH4。
故选D。
2.下列说法正确的是( )A.含有非极性键的分子一定是非极性分子CCl是由极性键构成的极性分子B.4C.由极性键形成的双原子分子一定是极性分子D.键的极性与分子的极性无关【答案】C【解析】H O,选项A错误;A.含有非极性键的分子不一定是非极性分子,如22CCl是由极性键构成的非极性分子,选项B错误;B.4C.由极性键形成的双原子分子,分子中正负电荷中心不重合,从整个分子来看,电荷的分布是不均匀的,不对称的,所以是极性分子,选项C正确;D.分子的极性除与键的极性有关外,还与分子的空间构型有关,选项D错误。
答案选C。
3.已知BeCl2为共价化合物,两个Be—Cl键间的夹角为180°,则BeCl2属于( )A.由极性键构成的极性分子B.由极性键构成的非极性分子C.由非极性键构成的极性分子D.由非极性键构成的非极性分子【答案】B【解析】BeCl2中Be-Cl键是不同元素形成的共价键,为极性键,两个Be-Cl键间的夹角为180°,说明分子是对称的,正电荷中心与负电荷的中心重合,BeCl2属于非极性分子,故BeCl2由极性键形成的非极性分子,故答案为B。
4.用一带静电的玻璃棒靠近A、B两种纯液体流,根据图分析,这两种液体分子的极性正确的是( )。
A.A是极性分子,B是非极性分子B.A是非极性分子,B是极性分子C.A和B都是极性分子D.A和B都是非极性分子【答案】B【解析】试题分析:根据实验现象可知,A液体不偏转,说明A是非极性分子。

第二章分子结构与性质第一节共价键2.1.1共价键【教材分析】本章比较系统的介绍了分子的结构和性质,内容比较丰富。
首先,在第一章有关电子云和原子轨道的基础上,介绍了共价键的主要类型σ键和π键,以及键参数——键能、键长、键角;接着,在共价键概念的基础上,介绍了分子的立体结构,并根据价层电子对互斥模型和杂化轨道理论对简单共价分子结构的多样性和复杂性进行了解释。
最后介绍了极性分子和非极性分子、键的极性对化学性质的影响、分子间作用力、氢键等概念,以及它们对物质性质的影响,并从分子结构的角度说明了“相似相溶”规则等。
【课程目标】课程目标学科素养1.认识共价键的本质,原子间通过原子轨道重叠形成共价键。
2.熟知共价键的概念与形成,知道共价键的特征——具有饱和性和方向性。
3.能够从不同的角度对共价键分类,会分析σ键和π键的形成及特点。
a.微观探析:微观角度探析共价键的微粒、类型。
b.模型认知:建立σ键和π键的思维模型,判断分子中存在σ键和π键的种类及个数。
【教学重难点】教学重点:σ键和π键的形成及特点教学难点:σ键和π键的形成及特点【教学过程】【情境微课堂】诺贝尔物理学奖得主理查德·费曼曾说过,假如发生了大灾难,人类全部的科学知识只能概括为一句话传诸后世,那么这句话应该是“万物皆由原子构成”。
早在19世纪中叶,化学家就已经把分子中原子之间的相互作用形象地称作化学键。
20世纪初,在原子结构理论的基础上,建立了化学键的电子理论。
共价键是现代化学键理论的核心。
分子的空间结构和分子之间的作用力是理解分子结构与性质关系的重要内容。
【新课导入】[学生活动]NaCl和HCl的性质差异大,请用电子式描述NaCl和HCl的形成过程,从微粒间相互作用的角度解释NaCl和HCl性质差异大的原因。
你能从元素的电负性差别来理解吗?填写下表。
元素Na Cl H Cl C O电负性0.9 3.0 2.1 3.0 2.5 3.5电负性差值 2.10.91[回答]元素的电负性差值很大,化学反应形成的电子对不会被共用,形成离子键,而共价键是电负性差值不大的原子间形成的共价键。


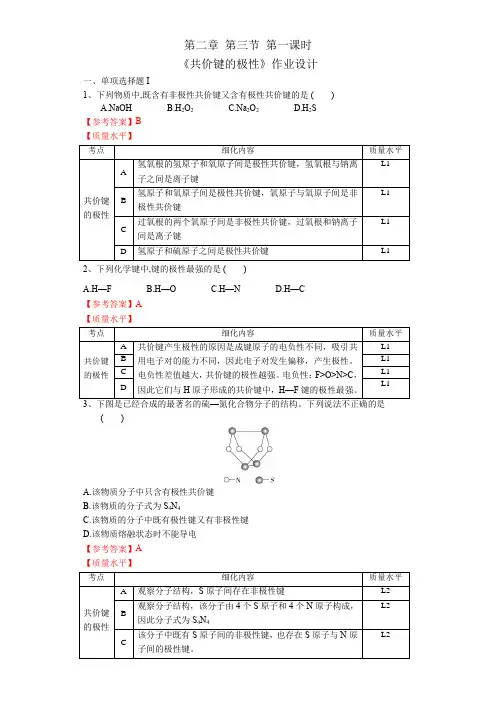
第二章第三节第一课时《共价键的极性》作业设计一、单项选择题I1、下列物质中,既含有非极性共价键又含有极性共价键的是()A.NaOHB.H2O2C.Na2O2D.H2S 【参考答案】B【质量水平】2、下列化学键中,键的极性最强的是()A.H—FB.H—OC.H—ND.H—C【参考答案】A【质量水平】()A.该物质分子中只含有极性共价键B.该物质的分子式为S4N4C.该物质的分子中既有极性键又有非极性键D.该物质熔融状态时不能导电【参考答案】A【质量水平】A.含有非极性键的分子一定是非极性分子B.非极性分子中一定含有非极性键C.由极性键形成的双原子分子一定是极性分子D.键的极性与分子的极性无关 【参考答案】C 【质量水平】A.CH 4和H 2OB.CO 2和HClC.NH 3和H 2SD.HCN 和BF 3 【参考答案】C 【质量水平】6、下列物质中,酸性最强的是 ( ) A.CH 2ClCOOH B.CH 2FCOOH C.CHF 2COOH D.CHBr2COOH 【参考答案】C 【质量水平】微波炉工作原理是通电后炉内的微波场以几亿赫兹的高频改变外电场的方向,水分子因而能迅速摆动,产生热效应。
水分子能迅速摆动是因为 ( ) A.水分子中具有极性共价键 B.水分子是极性分子C.水由氢、氧两种元素组成D.水分子中有共用电子对【参考答案】B 【质量水平】8、研究表明:H 2O 2具有立体结构,两个氢原子像在一本半展开的书的两页纸上,两页纸面的夹角为93°51',氧原子在书的夹缝上,O—H 键与O—O 键之间的夹角为96°52'。
下列说法不正确的是( )A.H 2O 2分子中既含极性键,又含非极性键B.H 2O 2为极性分子C.H 2O 2分子中的两个O 原子均是sp 3杂化D.H 2O 2分子中既有σ键,又有π键 【参考答案】D 【质量水平】9 、下列叙述正确的是( )A .卤化氢分子中,卤素的非金属性越强,共价键的极性越大B .以极性键结合的分子一定是极性分子C .判断2A B 或2AB 型分子是否是极性分子的依据是看分子中是否含有极性键D .非极性分子中,各原子间都以非极性键结合 【参考答案】A 【质量水平】三、非选择题10、已知运送卫星的火箭所需燃料除液态H2O2外,还有另一种液态氮氢化合物。

分子结构与物质的性质共价键的极性课后篇素养形成必备知识基础练1.下列说法正确的是()A.含有非极性键的分子一定是非极性分子B.非极性分子中一定含有非极性键C.由极性键形成的双原子分子一定是极性分子D.分子的极性只与键的极性有关,如H2O2;非极性分子中不一定含有非极性键,如CH4、CO2均是非极性分子,却不含非极性键;分子的极性不仅与键的极性有关,还与分子的空间结构有关。
2.X、Y为两种不同的元素,下列化学式表示的物质一定为极性分子的是()A.XYB.XY2C.XY3D.XY4项,在XY分子中X、Y是不同的原子,吸引电子能力不同,正、负电荷中心不重合,一定是极性分子;B项,分子结构完全对称时就是非极性分子,如CO2;C项,分子结构完全对称就是非极性分子,如BF3,分子结构不完全对称就是极性分子,如NH3;D项,分子结构完全对称就是非极性分子,如CH4。
3.(双选)下列关于粒子结构的描述错误的是()A.CS2、C2H2、BeCl2都是直线形分子l4和CHCl3均是四面体形的非极性分子C.H2S和NH3均是由极性键构成的极性分子D.HCl和HS-均是含有一个极性键的极性分子C—H的键长小于C—Cl的键长,故CH2Cl2的空间结构不是对称的正四面体形,因而属于极性分子,B错误;HS-不是分子,是阴离子,D项错误。
4.(双选)通常状况下,NCl3是一种油状液体,其分子空间结构与氨分子相似,下列对NCl3的有关叙述正确的是()A.NCl3分子中N—Cl的键长比CCl4分子中C—Cl的键长长B.NCl3分子是非极性分子C.NCl3分子中的所有原子均达到8电子稳定结构D.NBr3与NCl3分子的空间结构相似原子的原子半径大于N原子的原子半径,所以CCl4中C—Cl的键长比NCl3中N—Cl的键长长,A错误;NCl3分子的空间结构与氨分子相似,都是三角锥形结构,氨分子是极性分子,所以NCl3分子也是极性分子,B错误;NCl3分子中N原子最外层电子数为5+3=8,NCl3分子中Cl原子最外层电子数为7+1=8,所以N原子和Cl原子均达到8电子稳定结构,C正确;NBr3与NCl3分子的空间结构都是三角锥形,D项正确。

2020-2021学年新教材人教版化学选择性必修2教师用书:第2章第3节第1课时共价键的极性范德华力含解析第三节分子结构与物质的性质第1课时共价键的极性范德华力发展目标体系构建1。
能从微观角度理解共价键的极性对分子极性的影响,能说出范德华力对分子某些性质的影响。
2.通过键的极性及范德华力对物质性质的影响的探析,形成“结构决定性质"的认知模型。
一、共价键的极性1.键的极性和分子的极性(1)键的极性分类极性共价键非极性共价键成键原不同元素的原子同种元素的原子子电子对发生偏移不发生偏移成键原子的电性一个原子呈正电性(δ+)一个原子呈负电性(δ-)呈电中性(2)极性分子和非极性分子(3)键的极性与分子极性之间的关系①只含非极性键的分子一定是非极性分子.②含有极性键的分子,如果分子中各个键的极性的向量和等于零,则为非极性分子,否则为极性分子。
③极性分子中一定有极性键,非极性分子中不一定含有非极性键。
例如CH4是非极性分子,只含有极性键。
含有非极性键的分子不一定为非极性分子,如H2O2是含有非极性键的极性分子。
微点拨:键的极性只取决于成键原子的元素种类或电负性的差异,与其他因素无关。
2.键的极性对化学性质的影响键的极性对物质的化学性质有重要的影响.例如,羧酸是一大类含羧基(—COOH)的有机酸,羧基可电离出H+而呈酸性。
羧酸的酸性可用p K a的大小来衡量,p K a越小,酸性越强。
羧酸的酸性大小与其分子的组成和结构有关,如下表所示.不同羧酸的p K a羧酸p K a丙酸(C2H5COOH)4。
88乙酸(CH3COOH) 4.76甲酸(HCOOH)3。
75氯乙酸(CH2ClCOOH)2。
86二氯乙酸1.29(CHCl2COOH)三氯乙酸(CCl3COOH)0.65三氟乙酸(CF3COOH)0.23为什么甲酸、乙酸、丙酸的酸性逐渐减弱?[提示]烃基是推电子基团,烃基越长推电子效应越大,使羧基中的烃基的极性越小,羧酸的酸性越弱.所以,甲酸的酸性大于乙酸的,乙酸的酸性大于丙酸的……随着烃基加长,酸性的差异越来越小。

《共价键的极性》教学设计一、课标解读《共价键的极性》是选择性必修模块2物质结构与性质的主题2:微粒间的相互作用与物质的性质中的内容,课程标准(《普通高中化学课程标准(版修订)》)对这部分内容的要求具体如下:1.内容要求(1)知道共价键可分为极性和非极性共价键;(2)知道分子可以分为极性分子和非极性分子,知道分子极性与分子中键的极性、分子的空间结构密切相关。
2.学业要求(1)能利用电负性判断共价键的极性;(2)能根据分子结构特点和键的极性来判断分子的极性,并据此对分子的一些典型性质及其应用作出解释。
二、教材分析本节内容选自高中化学人教版选择性必修二《物质结构与性质》第2章“分子的结构与性质”第3节分子的性质第一课时。
本节是在学习了共价键和分子的立体构型的基础上,进一步来认识分子的极性,能从共用电子对是否发生偏移的角度认识键的极性的实质是成键原子分别带正电和负电。
掌握分子极性和分子中键的极性、分子的空间结构密切相关。
能从微观角度理解共价键的极性和分子极性的关系,培养学生微观辨识的科学素养,通过键的极性对物质性质的影响的探析,形成“结构决定性质"的认知模型。
鲁科版教材中内容的编排顺序与人教版中不同,在鲁科版中共价键的极性安排在第一节共价键的分类中,而分子的极性安排在第三节,两个内容的学习较为分散。
在鲁科版教材中安排了分子极性的实验:用带静电的橡胶棒分别靠近水流和四氯化碳,观察流向,给学生认识分子极性提供了感性认识,便于学生直观感知。
三、学情分析教学中要充分考虑学生已有的知识基础,已学习了共价键、电负性、酸的电离常数等知识,通过上一节的学习,学生也了解了常见分子的空间构型,这些都为本节课学习共价键的极性和分子的极性做好了知识铺垫。
能力方面,学生从微观角度理解并解释宏观性质的能力比较欠缺,需要进一步通过本节内容的学习进行强化。
四、素养目标【教学目标】1.知道共价键可分为极性共价键和非极性共价键;能利用电负性判断共价键的极性。
第二章分子结构与性质
第二节分子的空间结构
2.3.1共价键的极性
【教材分析】
本节是在学习了共价键和分子的立体构型的基础上,进一步来认识分子的一些性质,包括共价键的极性和非极性,并由此引出一些共价分子的性质及其应用;范德华力、氢键及其对物质性质的影响,特别是物质的熔沸点及溶解性等;教学时要注意引导学生运用“物质结构决定物质性质,性质反映结构”的观念来理解和解释分子的性质。
【课程目标】
教学重点:极性分子与非极性分子的判断
教学难点:极性分子与非极性分子的判断
【教学过程】
【情境引入】
微波炉的加热原理
任务一:分子的极性
【讲解】
分子的极性
(1)极性分子:分子的正电中心和负电中心不重合,使分子的某一部分呈正电性,另一部分呈负电性,这样的分子是极性分子。
如HCl、H2O等。
(2)非极性分子:分子的正电中心和负电中性重合,使分子没有带正电和带负电的两部分,这样的分子是非极性分子。
如P4、CO2等。
【设疑】
为什么水分子内部正电中心和负电中心不重合?
共用电子对在两原子周围出现的机会是否相同?即共用电子对是否偏移?
【讲解】
有些共用电子对的两个原子由于电负性不同,那么共用电子对在两原子周围出现的机会便不同,即共用电子对发生偏移。
有些共用电子对的两个原子由于电负性相同,那么共用电子对在两原子周围出现的机会相同,即共用电子对不发生偏移。
根据共用电子对是否偏移,可以将共价键分为极性键和非极性键。
任务二:键的极性
【讲解】
2.键的极性
以HCl分子为例,HCl分子是由不同元素的原子构成的,Cl原子的电
负性大于H原子,致使共用电子对发生偏移,那么会使H原子呈正电
性、Cl原子呈负电性。
以Cl2分子为例,Cl2分子是由同种元素的原子
构成的,每个Cl原子的电负性相同,致使共用电子对不发生偏移,使成键原子呈电中性。
【讲解】
判断分子的极性可依据分子中的化学键的极性向量和。
从向量的角度认识分子的极性,若分子中共价键的极性的向量和等于0,则分子中没有带正电和带负电的两部分,为非极性分子,如BF3、CH4等。
【展示】
展示BF3、CH4的空间构型。
【讲解】
BF3分子中对称的3个F所带负电的向量和位于分子中心,即与B重合,且负电量与B所带正电量相等,分子不带电,为非极性分子。
CH4分子中对称的4个H所带正电的向量和位于分子中心,即与C重合,且正电量与C所带负电量相等,分子不带电,为非极性分子。
【学生活动】
试从向量的角度理解极性分子,并解释H2O、NH3为极性分子的原因。
【讲解】
H2O为极性分子的原因:2个H所带正电的向量和位于2个H连线的中间,即正电中心与负电中心不重合。
NH3为极性分子的原因:为极性分子3个H所带正电的向量和位于3个H连线的正三角形的中心,即正电中心与负电中心不重合,为极性分子
【思考】
共价键的极性和分子的极性之间有必然的联系吗?
【资料卡片】
臭氧分子的空间结构与水分子的相似,
臭氧分子中的共价键是极性键,
臭氧分子有极性,但很微弱。
仅是水分子的极性的28%。
其中心氧原子是呈正电性的,
而端位的两个氧原子是呈电负性的。
【展示】
常见的极性分子和非极性分子
【思考交流】
如何判断分子的极性?
任务三:判断分子极性的方法
【讲解】
1、化合价法
2、根据分子的空间结构判断
【总结】
分子极性的判断方法
分子的极性是由分子中所含共价键的极性与分子的立体构型两方面共同决定的。
(1)只含有非极性键的双原子分子或多原子分子大多是非极性分子,如O2、H2、P4、C60。
(2)含有极性键的双原子分子都是极性分子,如HCl、HF、HBr。
(3)含有极性键的多原子分子,立体构型对称的是非极性分子;立体构型不对称的是极性分子。
(4)判断AB n型分子极性的经验规律:
①若中心原子A的化合价的绝对值等于该元素所在的主族序数,则为非极性分子;若不等,则为极性分子。
②若中心原子有孤电子对,则为极性分子;若无孤电子对,则为非极性分子。
如CS2、BF3、SO3、CH4为非极性分子;H2S、SO2、NH3、PCl3为极性分子。
【课堂练习】
根据图2-18,思考和回答下列问题:
(1)以下双原子分子中,哪些是极性分子,哪些是非极性分子?
H2O2 Cl2 HCl
(2)P4和C60是极性分子还是非极性分子?
(3)以下化合物分子中,哪些是极性分子,哪些是非极性分子?
CO2 HCN H2O NH3 BF3CH4CH3Cl
【讲解】
(1)以下双原子分子中,H2O2、HCl是极性分子,Cl2 是非极性分子。
(2)P4和C60是非极性分子。
(3)HCN、H2O、NH3、CH3Cl是极性分子,CO2、BF3、CH4是非极性分子。
【点拨】
①稀有气体分子是非极性分子,但不含共价键
②臭氧是极性分子,共价键为极性键
③H2O2是由极性键和非极性键构成的极性分子
【拓展延伸】
表面活性剂
阅读教材,了解表面活性剂和细胞膜并回答问题。
【思考交流】
为什么钠和水的反应比钠和乙醇的反应剧烈?
【讲解】
乙醇分子中的C2H5—是推电子基团,使得乙醇分子中的电子云向着远离乙基的方向偏移,羟基的极性比水分子中的小,因而钠和乙醇的反应不如钠和水的剧烈
任务四:键的极性对化学性质的影响
【讲解】
键的极性对物质的化学性质有重要的影响。
例如,羧酸是一大类含羧基(—COOH)的有机酸,羧基可电离出H+而呈酸性。
羧酸的酸性可用p K a的大小来衡量,p K a越小,酸性越强。
羧酸的酸性大小与其分子的组成和结构有关,如下表所示。
不同羧酸的p K a
【学生活动】
1.为什么甲酸、乙酸、丙酸的酸性逐渐减弱?
2.CF3COOH的酸性大于CCl3COOH,解释原因。
3.试分析羧酸的酸性与分子的组成和结构的关系。
【提示】
1.烃基是推电子基团,烃基越长推电子效应越大,使羧基中的烃基的极性越小,羧酸的酸性越弱。
所以,甲酸的酸性大于乙酸的,乙酸的酸性大于丙酸的……随着烃基加长,酸性的差异越来越小。
2.三氟乙酸的酸性大于三氯乙酸的,这是由于氟的电负性大于氯的电负性,F—C的极性大
于Cc的极性,使F3C一的极性大于Cl3C一的极性,导致三氟乙酸的羧基中的羟基的极性更大,更易电离出氢离子。
同理,三氯乙酸的酸性大于二氯乙酸的,二氯乙酸的酸性大于氯乙酸的。
3.①与羧酸(—COOH)相连的C—X(X为卤素原子)的极性越大,羧酸的酸性越大;C—X的数量越多,羧酸的酸性越大,如酸性:CF3COOH>CCl3COOH>CH3COOH;CCl3COOH>CHCl2COOH>CH2ClCOOH。
①烃基越长,羧酸的酸性越小,如酸性:C2H5COOH<CH3COOH<HCOOH。
【课堂练习】
见课件
【拓展延伸】
分子结构修饰
不改变分子的主体骨架,保持分子的基本结构不变,仅改变分子结构中的某些基团而得到新的分子,分子被修饰后,其性质也可以发生显著的变化
【课堂小结】
回顾本节课的内容,本节课需要掌握判断分子的共价键和极性。