同源性分析标准操作规程
- 格式:doc
- 大小:16.50 KB
- 文档页数:2

临床微生物检测的基因同源性分析医院感染的流行病学研究是临床微生物学工作者的重要课题,在医院感染监测的研究中,一个很重要的问题就是如何确定感染途径和传播途径,以采取有效预防和控制措施,从而防止医院感染或者暴发流行,因此对微生物鉴定和菌株同源性分析提出了更高的要求。
目前,传统的细菌鉴定和同源性分析技术已不能很好地满足医院感染诊断和流行病学调查的需要,从型、亚型、株,甚至分子水平上去认识细菌变得愈来愈重要了。
近年来分子生物学的理论和技术在细菌感染诊断中的渗透和广泛应用,使得细菌鉴定、耐药基因的检测、分子流行病学调查变得更加准确、简洁和快速。
细菌DNA同源性分析技术如脉冲场凝胶电泳、聚合酶链反应、DNA探针杂交以及序列分析等方法是目前在分子水平上分析细菌的主要手段,它在鉴定细菌感染的爆发、确定院内交叉感染、感染病原菌之间的基因同源性等方面有着重要的作用,本文将对常用基因同源性分析方法的机理和过程做简要综述。
一、质粒分型(Plasmid profile assay):1、原理:质粒是可移动的染色体外元件,可以自发丢失或者被宿主稳定地获得,因此流行病学上相关的分离菌株有可能表现出不同的质粒图谱。
把质粒提取出来,进行常规的琼脂糖电泳分析,就可以知道分离菌株携带质粒的大小和数目。
2、实验过程:a.质粒抽提;b.0.8%琼脂糖电泳;c.EB染色、凝胶成像。
3、实验方法的评价:a.步骤比较简单,对实验仪器要求不高。
b.在评价那些从局限的时间和地点(如一个医院中的急性爆发)分离出来的菌株非常有效。
缺点:a.实验结果的重复性不好。
b.分辨力不高。
二、染色体DNA的限制性内切核酸酶分析(Restriction Endonuclease Assay REA)1、原理:限制性内切核酸酶(REA)在特异的核酸识别序列切割DNA,DNA被消化后,所得到的限制性片段的数目和大小是由酶的识别位点和DNA的组成共同决定的。
在传统的限制性内切核酸酶分析中,人们用含有相对多的限制性位点的内切核酸酶消化细菌的DNA,这样就会得到成百上千条长度在0.5-50Kb范围内的DNA片段。
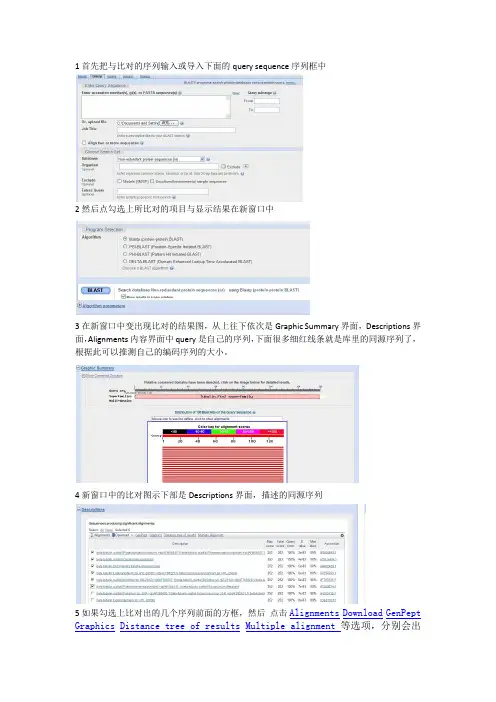
1首先把与比对的序列输入或导入下面的query sequence序列框中
2然后点勾选上所比对的项目与显示结果在新窗口中
3在新窗口中变出现比对的结果图,从上往下依次是Graphic Summary界面,Descriptions界面,Alignments内容界面中query是自己的序列,下面很多细红线条就是库里的同源序列了,根据此可以推测自己的编码序列的大小。
4新窗口中的比对图示下部是Descriptions界面,描述的同源序列
5如果勾选上比对出的几个序列前面的方框,然后点击Alignments Download GenPept Graphics Distance tree of results Multiple alignment等选项,分别会出
现两个序列比对结果,下载所勾选的序列,对应的蛋白序列,基因图示,进化树图像和所有勾选的序列的同源性比对结果图。

标准操作规程(SOP)——一、目的在以监测禽流感病毒为主要目标的同时,对其他重要常见呼吸道感染病毒的确诊提供重要的参考依据。
国家流感中心实验室按照规定方法对不明原因呼吸道感染病例的标本进行处理和检测,使病例标本的处理和检测得到有效的控制。
保证检测结果的快速性和可靠性,同时确保样本不被污染和污染环境。
二、范围适用于中国国家流感中心操作人员进行不明原因呼吸道感染病例标本的检测。
三、定义(一)分子鉴别诊断技术(Molecular Differential Diagnosis, MDD):利用急性呼吸道感染的多重分析系统,将靶序列富集多重PCR(Target enriched multiplex PCR,Tem-PCR)和Multiple Analysis Profiling(xMAP)技术有机结合,能鉴别诊断禽流感及流感等重要呼吸道病毒,包括呼吸道合胞病毒、流感甲型、流感乙型、副流感Ⅰ、Ⅱ、Ⅲ型、腺病毒Ⅳ、Ⅶ型,同时对感染病毒的亚型等信息进行汇报,包括人群中常见的H1, H3型和近来备受关注的H5,H7和H9型。
(二)平均荧光强度值(Mean fluorescence intensity,MFI):杂交反应过程分子在颜色编码的微球表面进行反应,对于每一种病原体,靶序列特异的捕获探针与一组颜色编码的微球之间形成特异的共价结合。
在杂交悬浮体系中,标记的PCR 产物被结合有微球的探针捕获。
Luminex 200分析样品时,经过一套微流体系统检测装置,红色激光识别病原体,绿色激光检测杂交信号,即MFI值,根据MFI 值的强弱从而显示特定病原体的有无。
四、程序(一)生物安全要求H5、H7亚型高致病性禽流感病毒,H2N2亚型流感病毒的操作需要在BSL-3级实验室中进行,并遵守BSL-3级实验室生物安全操作规程,参见“生物安全个人防护SOP”。
其余流感病毒的操作需要在BSL-2级实验室中进行,并遵守BSL-2级实验室生物安全操作规程,参见“生物安全个人防护SOP”。


利用系统进化分析软件对序列进行同源性分析1.0目的1.1为了保持国际上各个耐药性实验室的高检验水准,进行分子进化分析是有很重要作用的。
它不仅可以保证流行病学目的顺利实现,而且有利于发现检测阶段可能产生的潜在的交叉污染。
1.2利用此软件进行分析所得的信息对于进行艾滋病毒在人群中传播的流行病学研究具有十分重要的意义。
1.3通过对实验室之前分析的数据与当前数据进行比较,可以发现在此前实验过程中由于标本处理不当所导致的潜在的实验室污染。
1.4对于确保得到高质量的实验结果并及时发现可能出现在实验室里的问题具有重要意义。
2.0仪器设备2.1计算机一台。
2.2Windows 95以上的操作系统。
2.3BioEdit 以及MEGA 4 分析软件。
2.3.1均为免费软件,可以从互联网上下载,在计算机上进行安装。
3.0操作过程3.1局限及要求3.1.1经过序列编辑软件拼接处理后的txt文件或fasta文件均可,例如ChromasPro软件。
3.1.2可以在MEGA上分析的分子序列或距离矩阵数据。
3.1.3Mega 4软件只能将长度相等的序列转换为MEGA输出文件,因此,任何多序列文件必须通过BioEdit软件进行对齐修剪,然后才能进入通过Mega软件转换成*.meg格式进行分析。
3.1.4该数据集的大小受限于计算机上可用的物理(RAM)和虚拟内存。
3.1.5分析的序列必须包括两个或两个以上长度相同的序列,所有序列分析之前必须用MEGA软件对齐。
3.1.6核苷酸和氨基酸序列应该用英文字母连续书写,不区分大小写。
一些特殊的特殊符号,例如表示对齐缺口,碱基缺失等的符号也可以包含在序列中。
3.1.7空格和制表符经常用于数据文件中,因此会被MEGA忽略。
ASCII字符,如(.)(- )(?),一般都作为特殊符号来表示序列中的不同碱基,分别表示第一个序列,对齐缺口及碱基缺失。
3.1.8BioEdit 软件进行序列比对3.1.9双击BioEdit图标打开BioEdit 序列对比编辑器窗口。

猪2型圆环病毒感染的PCR检测及甘肃株的同源性分析猪2型圆环病毒(PDCoV)是一种对猪群健康产生严重影响的病毒,它引起了猪产业的巨大损失。
PCR(聚合酶链反应)是一种常用的病毒检测方法,可以快速、准确地检测出PDCoV的存在。
本文将介绍PDCoV的PCR检测方法以及对甘肃株的同源性分析。
首先,我们需要准备样品。
为了进行PDCoV的PCR检测,我们需要收集猪粪便等样品,并将其保存在适当的条件下,以确保样品中病毒的完整性和稳定性。
收集的样品应当来源于不同地点和不同时间的猪场,以保证样本的多样性。
接下来,我们需要提取样品中的病毒RNA。
病毒RNA提取是PCR检测的前提,它可以通过商业化的RNA提取试剂盒或自制方法来实现。
重点在于保证提取的RNA质量和纯度,以确保PCR反应的准确性和可靠性。
完成RNA提取后,我们可以进行PDCoV的PCR检测。
PCR反应是一种基于DNA聚合酶的体外扩增方法,可以将目标DNA的特定片段放大到可检测的浓度。
在这里,我们需要选择合适的引物和探针,以扩增并检测PDCoV的特定基因区域。
在PCR反应中,我们首先需要将提取的RNA反转录为cDNA,以便使用DNA聚合酶进行扩增。
接着,我们将cDNA与引物和探针一起放入PCR反应管中,进行PCR扩增。
PCR反应通常包含一个热启动步骤,用于激活DNA聚合酶,并一系列的循环步骤,包括变性、退火和延伸,以完成DNA片段的扩增。
扩增结束后,我们可以使用凝胶电泳等方法,检测PCR产物的存在与否。
通过凝胶电泳,我们可以观察到特定大小的PCR产物,从而确定猪样品中是否存在PDCoV。
在对PDCoV进行PCR检测后,我们可以进一步对甘肃株的同源性进行分析。
同源性分析可以帮助我们了解不同样品中PDCoV的遗传相似度,并揭示其传播途径和流行规律。
同源性分析通常使用序列比对和系统进化分析等方法。
首先,我们需要提取PDCoV阳性样品中的RNA,并通过逆转录为cDNA。

临床微生物检测的基因同源性分析方法临床微生物检测的基因同源性分析医院感染的流行病学研究是临床微生物学工作者的重要课题,在医院感染监测的研究中,一个很重要的问题就是如何确定感染途径和传播途径,以采取有效预防和控制措施,从而防止医院感染或者暴发流行,因此对微生物鉴定和菌株同源性分析提出了更高的要求。
目前,传统的细菌鉴定和同源性分析技术已不能很好地满足医院感染诊断和流行病学调查的需要,从型、亚型、株,甚至分子水平上去认识细菌变得愈来愈重要了。
近年来分子生物学的理论和技术在细菌感染诊断中的渗透和广泛应用,使得细菌鉴定、耐药基因的检测、分子流行病学调查变得更加准确、简洁和快速。
细菌DNA 同源性分析技术如脉冲场凝胶电泳、聚合酶链反应、DNA 探针杂交以及序列分析等方法是目前在分子水平上分析细菌的主要手段,它在鉴定细菌感染的爆发、确定院内交叉感染、感染病原菌之间的基因同源性等方面有着重要的作用,本文将对常用基因同源性分析方法的机理和过程做简要综述。
一、质粒分型(Plasmid profile assay):1、原理:质粒是可移动的染色体外元件,可以自发丢失或者被宿主稳定地获得,因此流行病学上相关的分离菌株有可能表现出不同的质粒图谱。
把质粒提取出来,进行常规的琼脂糖电泳分析,就可以知道分离菌株携带质粒的大小和数目。
2、实验过程:a.质粒抽提;b.0.8%琼脂糖电泳;c.EB染色、凝胶成像。
3、实验方法的评价: 优势:a.步骤比较简单,对实验仪器要求不高。
b.在评价那些从局限的时间和地点(如一个医院中的急性爆发)分离出来的菌株非常有效。
缺点:a.实验结果的重复性不好。
b.分辨力不高。
二、染色体DNA的限制性内切核酸酶分析(Restriction Endonuclease Assay REA)1、原理:限制性内切核酸酶(REA)在特异的核酸识别序列切割DNA,DNA被消化后,所得到的限制性片段的数目和大小是由酶的识别位点和DNA的组成共同决定的。

基因组同源性
基因组同源性是指两个相比较的序列之间的匹配程度,衡量基因与基因之间的相似关系。
同源性是指在分子生物学和遗传学中,从某一共同祖先经过趋异进化而形成的不同的基因序列。
两个序列同源,也就是说明它们是同一来源,来自同一祖先。
当两条序列同源时,它们的核苷酸序列通常有显著的一致性。
同源性目前都是通过全基因组测序技术来完成的。
全基因组测序是对未知基因组序列进行个体的基因组测序。
全基因组测序技术主要包括第二代测序技术和第三代测序技术,一般能在24小时之内报告结果。
检测出的基因序列通过一定的算法和分析,和计算机库中已有的基因序列进行比较,可以得出同源性与否的判断,并计算出相似性达到的百分数。

一般鉴别试验标准操作规程目的:建立一般鉴别试验标准操作规程范围:适用于一般鉴别试验操作职责:QC检验员对本标准实施负责执行标准:《中国药典》2020版四部第35页通则0301规程:1 简述1.1药品的“一般鉴别试验”,是含有一离子或具有某一基团的药物共有的化学反应。
在药典附录中,此项内容是通过化学反应进行试验来证明药品中含有某一离子或基团,而不是对未知物进行定性分析,应结合正文中的其他鉴别试验和性状项下的描述,才能证实供试品的真实性。
1.2 选入一般鉴别试验方法的原则是:专属性强,再现性好,灵敏度高,操作简便、快速。
对无机药品是根据阴、阳离子的特殊反应进行鉴别,对有机药品则大都采用官能团反应。
2 仪器所有仪器要求洁净,以免干扰化学反应。
3 试药与试液3.1 试药应符合《中国药典》2020年版要求,使用时应研成粉末或配成试液。
3.2试液除另有规定外,均应按《中国药典》2020年版试液项下的方法进行配制和贮藏,要求新配制的,必须新鲜配制。
4 操作方法4.1 钙盐4.1.1 取铂丝,用盐酸湿润后,蘸取供试品,在无色火焰中燃烧,火焰即显砖红色。
4.1.2 取供试品溶液(1→20),加甲基红指示液2滴,用氨试液中和,再滴加盐酸至恰好酸性,加草酸试液,即生成白色沉淀;分离,沉淀不溶于醋酸,但可溶于盐酸。
4.2 钠盐4.2.1 取铂丝,用盐酸湿润后,蘸取供试品,在无色火焰中燃烧,火焰即显鲜黄色。
4.2.2 取供试品约100mg,置10ml试管中,加水2ml溶解,加15%碳酸钾溶液2ml,加热至沸,应不得有沉淀生成;加焦锑酸钾试液4ml,加热至沸;置冰水中冷却,必要时用玻棒摩擦试管内壁,应有致密的沉淀生成。
4.3 钡盐4.3.1 取铂丝,用盐酸湿润后,蘸取供试品,在无色火焰中燃烧,火焰即显黄绿色;通过绿色玻璃透视,火焰显蓝色。
4.3.2取供试品溶液,滴加稀硫酸,即生成白色沉淀;分离,沉淀在盐酸或硝酸中均不溶解。

同源性分析标准操作规程一、同源性分析的应用包括感染暴发的判断,感染病原菌的确定及感染源的寻找。
二、基本方法1.细菌的表型特征分型技术(如血清型、耐药表型等)。
2.基因分型技术(如.PFGE、Rep—PCR、AFLP等)。
三、操作步骤(一)表型分型(血清型、耐药表型)1.标本孵育:从患者感染部位采集标本,并接种于相应培养基(培养瓶)中孵育。
2.分离菌种:分离病原菌(细菌或真菌),并鉴定细菌(真菌)种类。
3.血清分型:如可能则对同种细菌进行血清分型,如军团菌等。
4.药敏试验:根据细菌(真菌)种类选择药敏卡(纸片),进行药敏试验。
5.结果分析:分析血清型和药敏谱,如结果相同或药敏相差不大则提示有同源性。
(二)基因分型(PFGE)1.菌栓制备:将细菌悬液与2%低熔点琼脂糖凝胶混合,制备菌栓。
2.细菌消化:分别用含溶菌酶和(或)蛋白酶K的裂解液对菌栓进行消化。
3.洗涤菌栓:可用无菌水反复清洗或PMSF中和多余的蛋白酶K。
4.酶切:按照各种不同限制性内切酶的说明进行酶切。
5.制胶:用PF(讵电泳凝胶模具制备:PF(逼级琼脂糖凝胶。
6.电泳:根据不同细菌酶切片段的大小选择适当的脉冲参数,进行电泳。
7.凝胶成像:胶块染色后在凝胶成像仪下成像。
8.结果分析:根据Tenover等制定的标准对凝胶图像进行分析,判断菌株之间的同源性。
四、注意事项1.不同的分型方法,在分型能力、重复性、分辨能力、操作和成本等方面都不尽相同,可根据情况进行选择。
2.表型分型方法的分辨能力普遍比基因分型方法低,但简便、快速,适用于对感染暴发的初筛。
3.基因分型方法需要特殊实验器材,操作较繁琐且耗时,但为感染暴发同源性分析的“金标准”。
检验科要创作条件,开展该项业务。

医院感染暴发【调查】标准操作规程前期准备1.管理机制:多部门协作,确保人员、设施和经费到位。
2.了解现场信息:发病地点、人数、可疑感染源和病原体、事件严重程度。
3.文献复习:疾病、调查、采样、检验方面的知识,可能病原体及相关危险因素等。
4.调查人员及物资准备:调查队伍,采样和防护用品(根据检验目的,确定样品的类型、采样时机及方法)。
证实暴发存在将目前的数量与以前可比的数量进行对比(前提是需要排除假暴发)。
核实诊断1.调查获取详细的临床资料。
2.审核临床表现、实验室结果与流行病学资料。
3.描述疾病谱的特征,核实诊断。
建立病例定义1.病例定义是确定调查对象的划分依据;病例定义以调查对象的主要临床表现为依据,应明确限定时间、地点和人群;必要时可有影像学或检验资料,不应包括所研究的暴露和危险因素。
2.建立病例定义。
(1)确诊病例:经实验室查证;(2)临床病例:典型病例特征,不需要实验室证据;(3)可能、疑似病例:部分典型特征。
搜索病例按照病例定义进行识别和分类,按不同类别进行计数。
个案调查1.开展病例个案调查,获得病例的发病经过、诊治过程等详细信息。
2.个案调查内容-一般包括基本信息、临床资料、流行病学资料等。
3.个案调查表可参照WS/T524-2016《医院感染暴发控制指南》附录A。
描述三间分布1.时间分布.2.空间分布。
3.人群分布。
建立假设1.疾病假设。
2.贮存宿主假设。
3.传播途径假设。
4.媒介假设。
5.危险因素假设。
检验假设1.考虑因果关系,设计分析研究来检验假设,常用的有队列研究、病例-对照研究。
2.根据分析研究的结果,通过采样、微生物实验室鉴定等方法寻找病原体。
3.通过脉冲场凝胶电泳(PFGE)等技术手段证实同源性。
重新调查并验证假设重新回顾和审视前面每一个过程是否正确。
1.病例筛查:核实暴发。
2.病原调查:证实相关危险因素的相关性。
3.现场调查:原因推断。
4.分子流行病学:证实同源性。
5.病例对照研究、队列研究:证实相关因素。
同种同源的鉴定方法1.形态学鉴定法:形态学鉴定法是最常用的同种同源鉴定方法之一、通过观察和比较物种的形态特征,如外部形态、内部结构和解剖形态,来确定是否属于同一种。
这种方法适用于对于较大的、可见的形态特征进行鉴定。
2.细胞学鉴定法:细胞学鉴定法是通过观察和比较细胞的形态和结构,来确定物种是否属于同一种。
其中最常用的是核型分析,通过染色体的数量、形状和大小等特征,来判断是否属于同一种。
细胞学鉴定法对于微生物、植物和动物等多种物种具有普遍适用性。
3.分子生物学鉴定法:分子生物学鉴定法是同种同源鉴定中较为准确的方法。
通过比较物种的基因组DNA序列或蛋白质序列来判断是否属于同一种。
包括PCR技术、DNA测序、比较基因组学和系统发育分析等方法,可以提供更为直接的证据来判断物种的同源性。
4.生理生化鉴定法:生理生化鉴定法是通过比较物种的生理特性和生化反应来判断是否属于同一种。
包括生长特性、营养要求、代谢途径、生物合成反应和酶的活性等方面的检测和比较。
这种方法对于微生物、植物和动物等多种物种具有一定的可比性和应用性。
5.生态学鉴定法:生态学鉴定法是通过研究物种的生境特征、种群结构、生态位和生活习性等方面的差异,来判断是否属于同一种。
这种方法适用于自然界中存在多个物种有较小差异的情况,通过观察和采集包括个体、种群和群落等的数据,进行统计和分析,判断物种的同源性。
综上所述,同种同源的鉴定方法包括形态学鉴定法、细胞学鉴定法、分子生物学鉴定法、生理生化鉴定法和生态学鉴定法等。
每种方法都有其适用的范围和优缺点,在进行鉴定时应结合具体情况综合运用,以确保鉴定结果的准确性。
1.目的保证制剂的稳定性。
2.X围固体制剂。
3.责任研发制剂实验人员负责此程序的实施。
4.程序4.1原辅料相容性试验-针对国内申报项目若辅料用量较大的(如稀释剂等),可按主药:辅料=1:5 的比例混合,若用量较小的(如润滑剂等),可按主药:辅料=20:1的比例混合或根据实际情况设定混合比例,取一定量,参照药物稳定性指导原则中影响因素的实验方法或其他适宜的实验方法,重点考察性状、含量、有关物质等等,必要时,可用原料药和辅料分别做平行对照实验,以判别是原料药本身的变化还是辅料的影响。
影响因素试验一般包括高温、高湿、光照试验。
一般将原料药供试品置适宜的容器中(如称量瓶或培养皿),摊成≤5mm厚的薄层,疏XX料药摊成≤10mm 厚的薄层进行试验。
高温试验供试品置密封洁净容器中,在60℃条件下放置10 天,于第5 天和第10天取样,检测有关指标。
如供试品发生显著变化,则在40℃下同法进行试验。
如60℃无显著变化,则不必进行40℃试验。
高湿试验供试品置恒湿密闭容器中,于25℃、RH90%±5%条件下放置10 天,在第5 天和第10天取样检测。
检测项目应包括吸湿增重项。
若吸湿增重5%以上,则应在25℃、RH 75±5%下同法进行试验;若吸湿增重5%以下,且其他考察项目符合要求,则不再进行此项试验。
液体制剂可不进行此项试验。
恒湿条件可采用恒温恒湿箱或通过在密闭容器下部放置饱和盐溶液来实现。
根据不同的湿度要求,选择NaCl饱和溶液(15.5- 60 ℃,RH 75%±14%)或KNO3 饱和溶液(25℃,RH 92.5%)。
光照试验供试品置光照箱或其它适宜的光照容器内,于照度4500Lx±500Lx 条件下放置10 天,在第5 天和第10 天取样检测。
以上为影响因素稳定性研究的一般要求。
根据药品的性质必要时可以设计其他试验,如考察pH值、氧、低温、冻融等因素对药品稳定性的影响。
关于分子生物学中的同源性分析作者:李尚伟杜娟来源:《教育教学论坛》2014年第51期摘要:同源性是指在进化过程中源于同一祖先的分支之间的关系,包括直系同源和旁系同源。
直系同源基因描述在不同物种中来自于共同祖先的基因,而旁系同源基因描述在同一物种内由于基因复制而分离的同源基因。
同源性与相似性是两个不同的概念,前者是质的概念,后者突出量的描述,但它们之间又有一定关系,可以通过相似性来推测序列是否具有同源性。
介绍了用BLAST进行序列同源性分析的方法。
关键词:同源性;直系同源;旁系同源;相似性;BLAST中图分类号:G642.0 文献标志码:A 文章编号:1674-9324(2014)51-0184-02在分子生物学的教学及研究中,经常对核苷酸或氨基酸序列进行比对以确定基因之间或蛋白质之间的同源关系,进而根据同源性来推测物种间的亲缘关系。
基因或蛋白质之间的同源关系包括直系同源和旁系同源,序列间的同源性可用相似性或一致性来进行量化,用相似性(一致性)来判断序列是否同源。
一、同源性的概念在生物学中,同源性(homology)是指在进化过程中源于同一祖先的分支之间的关系。
我们可以在生物学的不同层次(如形态性状、分子性状等)上进行同源性分析,形态性状由于进行上或个体发育上的共同来源而呈现出本质上的相似性,但其功能不一定相同,那么它们就是同源的,如马的前肢与鸟的翅就是同源器官。
在分子水平上同源性主要是指基因的核苷酸序列或蛋白质的氨基酸序列之间的相似程度。
同源基因或蛋白质(homolog)指遗传上从某一共同祖先经趋异进化而形成的具有不同序列的基因或蛋白质。
同源性是一个相对的概念,在一定水平和范围内对其研究才有意义[1]。
二、直系同源与旁系同源同源关系包括两种类型:直系同源(ortholog)和旁系同源(paralog)。
这里我们主要以同源基因为例来进行讨论,同源蛋白质是同样的情况。
同源基因是遗传上来自某一共同祖先DNA序列的基因,包括直系同源基因和旁系同源基因。
DNA同源性分析(DNA-DNA杂交)根据Wassill(1998)等方法改进基因组DNA的提取1) 将活化的菌株到ATCC172培养基中,摇瓶培养28 °C,48-52 h;2) 菌体10000 g, 5 min,去上清,得到湿菌体;3)用10 mL的SET缓冲液(含20 mmol L-1Tris·HCl,pH 7.5,25 mmol L-1 EDTA,75 mmol L-1 NaCl)洗一次后,再用该溶液10 mL重悬菌体,加溶菌酶的终浓度是1 mg mL-1,37 °C水浴2-4 h;4)加蛋白酶K溶液(终浓度是1 µg mL-1),混匀,55 °C水浴1 h。
加10 %的SDS(终浓度是1%), 颠倒混匀,55 °C 水浴2-4 h,直至溶液变清亮;5)加5M NaCl,NaCl的终浓度1.25M,并不时上下颠倒彻底混匀,加等体积的氯仿/异戊醇(24:1),颠倒混匀;6)12000 g,5 min,取上清;再加等体积的氯仿/异戊醇(24:1),颠倒混匀;7)12000 g,5 min,取上清;加等体积的异丙醇混匀,12000 g,3 min,用70 %的乙醇来洗两次,最后风干,然后在55 °C水浴将DNA溶解在1~2mL的ddH2O;8) 加入RNase至20 μg mL-1,37°C,30 min;9) 加入一倍体积的氯仿:异戊醇(24:1)轻摇混匀后,12000 g,5 min;10) 取上清,加入等体积的异丙醇,混匀,12000 g,3 min,去上清,用10 mL70 %的乙醇洗涤两次,吹干后装入离心管置于-20 °C保存备用。
同源性分析标准操作规程
持有部门:检验科
制定部门:丰都县人民医院医院感染管理科执行时间: 2013年11月1日
一、同源性分析的应用
包括感染暴发的判断,感染病原菌的确定及感染源的寻找。
二、基本方法
1.细菌的表型特征分型技术(如血清型、耐药表型等)。
2.基因分型技术(如.PFGE、Rep—PCR、AFLP等)。
三、操作步骤
(一)表型分型(血清型、耐药表型)
1.标本孵育:从患者感染部位采集标本,并接种于相应培养基(培养瓶)中孵育。
2.分离菌种:分离病原菌(细菌或真菌),并鉴定细菌(真菌)种类。
3.血清分型:如可能则对同种细菌进行血清分型,如军团菌等。
4.药敏试验:根据细菌(真菌)种类选择药敏卡(纸片),进行药敏试验。
5.结果分析:分析血清型和药敏谱,如结果相同或药敏相差不大则提示有同源性。
(二)基因分型(PFGE)
1.菌栓制备:将细菌悬液与2%低熔点琼脂糖凝胶混合,制备菌栓。
2.细菌消化:分别用含溶菌酶和(或)蛋白酶K的裂解液对菌栓进行消化。
3.洗涤菌栓:可用无菌水反复清洗或PMSF中和多余的蛋白酶K。
4.酶切:按照各种不同限制性内切酶的说明进行酶切。
5.制胶:用PF(讵电泳凝胶模具制备:PF(逼级琼脂糖凝胶。
6.电泳:根据不同细菌酶切片段的大小选择适当的脉冲参数,进行电泳。
7.凝胶成像:胶块染色后在凝胶成像仪下成像。
8.结果分析:根据Tenover等制定的标准对凝胶图像进行分析,判断菌株之间的同源性。
四、注意事项
1.不同的分型方法,在分型能力、重复性、分辨能力、操作和成本等方面都不尽相同,可根据情况进行选择。
2.表型分型方法的分辨能力普遍比基因分型方法低,但简便、快速,适用于对感染暴发的初筛。
3.基因分型方法需要特殊实验器材,操作较繁琐且耗时,但为感染暴发同源性分析的“金标准”。
检验科要创作条件,开展该项业务。