大肠杆菌高密度培养基组分
- 格式:docx
- 大小:145.92 KB
- 文档页数:3

课程设计说明书课程名称:发酵工程设计题目:大肠杆菌的高密度发酵院系:生物与食品工程学院学生姓名:******学号:************专业班级:10生物工程(2)班指导教师:*****课程设计任务书大肠杆菌的高密度摘要:在工业生产过程中,由于技术或是生产条件的限制,在大肠杆菌高密度发酵培养中很难实现其高密度发酵。
针对这一问题,我组专门为此设计一实验来探索发酵过程中的限制性因素。
我们从开始的发酵培养基的组分及其配比,到后来的灭菌方式,投料程序以及在发酵过程中温度的设定控制,PH值的设定控制及溶氧的设定控制都进行了严格的监测,再到最后的OD值,氨基氮以及还原糖的测定都进行严谨的完成。
关键词:大肠杆菌高密度发酵OD值目录1.设计背景 (1)1.1大肠杆菌高密度发酵产品及其质量安全现状 (1)1.2高密度发酵定义 (1)1.3 规定标准 (1)2.设计方案 (2)3.方案实施 (3)3.1 大肠杆菌简介 (3)3.2 菌种选材 (3)3.3 种子扩大培养 (3)3.4 发酵培养基配比 (3)3.5 发酵过程 (4)4.结果与结论 (7)5.收获与致谢 (9)6.参考文献 (10)1.设计背景1.1大肠杆菌高密度发酵产品及其质量安全现状目前,在发酵产业进入工业化,自动化的今天,产品的高密度发酵越来越受到国内外的重视。
人们在根据实验与生产阶段总结的经验中,逐步掌握发酵生产所需要的最佳控制条件。
在此过程中所得的产品密度更大,纯度更高,质量安全也得到了保障。
1.2高密度发酵定义高密度发酵(high cell density cultivation,HCDC)是指在一定条件和培养体系下,获得最多的细胞量,由此更多地或更高效地获得目的产物。
即利用一定的培养技术和装置提高菌体的发酵密度,使菌体密度较普通培养有显著提高,最终提高产物的比生产率(单位体积单位时间内产物的产量)。
通常认为菌体密度超过50 g(DCW)/L即为高密度发酵。


大肠杆菌培养基大肠杆菌(Escherichia coli)是一种革兰氏阴性杆菌,是一种常见的肠道细菌,也是一种重要的实验室模式生物。
大肠杆菌培养基是一种用于培养和繁殖大肠杆菌的营养培养基,它提供了大肠杆菌所需的营养物质和生长条件,使其能够在实验室中进行研究和应用。
大肠杆菌培养基的组成。
大肠杆菌培养基的组成通常包括以下成分:1. 碳源,大肠杆菌需要碳源来进行能量代谢和生长。
常见的碳源包括葡萄糖、蔗糖、乳糖等。
2. 氮源,氮源是大肠杆菌合成蛋白质和核酸的重要原料。
常见的氮源包括氨基酸、氨基酸盐、蛋白胨等。
3. 矿物盐,矿物盐是细胞生长和代谢所必需的微量元素,如钙、镁、钾、磷等。
4. 生长因子,大肠杆菌培养基中通常还添加了一些生长因子,如维生素、核酸、辅酶等,以促进大肠杆菌的生长和繁殖。
5. pH调节剂,培养基的pH值对大肠杆菌的生长有重要影响,通常需要添加pH调节剂来保持培养基的适宜pH范围。
根据不同的研究目的和实验条件,大肠杆菌培养基的配方会有所不同,可以根据实际需要进行调整和优化。
大肠杆菌培养基的制备方法。
大肠杆菌培养基的制备方法相对简单,一般包括以下步骤:1. 称取适量的葡萄糖、蛋白胨、氯化钠等成分,加入适量的蒸馏水中,搅拌均匀。
2. 调节pH值至适宜范围,通常大肠杆菌培养基的pH范围为7.0-7.4。
3. 加热蒸馏水,使培养基成分充分溶解。
4. 经过高温高压灭菌,使培养基无菌。
5. 分装培养基到适量的培养皿或试管中,待凝固后即可使用。
根据实验需求,可以添加抗生素、染色剂等成分,以实现对大肠杆菌的选择性培养。
大肠杆菌培养基的应用。
大肠杆菌培养基在科研和实验室应用中具有广泛的用途,主要包括以下几个方面:1. 细菌学研究,大肠杆菌培养基常用于大肠杆菌的分离、鉴定和培养,用于研究其生长特性、代谢途径、致病机制等。
2. 分子生物学实验,大肠杆菌是常用的重组DNA宿主细胞,大肠杆菌培养基可用于大肠杆菌的转化、表达、筛选等实验。

大肠杆菌培养一、菌种冻存液的制备含有足量细菌的液体培养基离心后在沉淀中加入等量40%甘油,-80o C冻存。
二、培养基制备LB培养基配方(胰化蛋白胨(Trypton):10 g/L;酵母提取物(Yeast Extract):5 g/L;NaCl:10 g/L;pH 7.4)液体培养基胰化蛋白胨 10.0g酵母粉 5.0g氯化钠 10.0g水 1000mlpH 7.4固体培养基在液体培养基的基础上再加入1.5%-2.0%的琼脂三、平板的制备1)称取胰化蛋白胨10.0g,酵母粉5.0g,NaCl 10.0g,加入800mL二次水溶解,并用玻璃棒搅拌均匀,用1mol/L的NaOH调pH至7.4左右,定容至1L,调pH 7.4(若溶液pH大于7.4,用1mol/L HCl回调)。
2)分装在锥形瓶中,每瓶量不宜太多,没过瓶底一指左右。
如需固体培养基在分装后的液体培养基内加入约2%的琼脂(150mL液体培养基加入2.5g琼脂)。
3)在锥形瓶口依次覆盖带滤纸通气小孔的塑料膜和硬质纸,用皮筋捆好。
所有锥形瓶如上述操作。
用记号笔注明培养基名称、配制日期。
4)高压蒸汽灭菌锅121 oC灭菌15min。
5)灭菌后的培养基取出置电热鼓风干燥器内60oC烘干,待锥形瓶的封口纸干燥后取出。
液体培养基可直接保存或使用,此时加有琼脂的培养基不会凝固,可在预先紫外杀菌30min以上的无菌操作台上,将培养基倒入培养皿内,每个培养皿培养基约10-15mL(直径90mm),在培养皿中厚度大约4mm左右。
将平皿叠放在无菌操作台上,放置10min左右,待琼脂基本凝固可涂平板。
6)若平板不直接使用,灭菌后将培养基在锥形瓶中保存,待需制备平板时,微波炉中火加热约3min,使琼脂熔化,室温冷却20min至不烫手可制备平板。
四、接种大肠杆菌1)取实验室储备的大肠杆菌BL21冻存液,管口用酒精灯灼烧,打开离心管。
2)接种方法一:用灭菌枪头蘸取冻存液在平板边缘上划横条,每三道为一组,旋转平皿一圈,最后中间划之字;接种方法二:用移液枪吸取100uL溶液于平板上,用酒精灯灭菌厚的涂抹棒划十字,涂布平板。
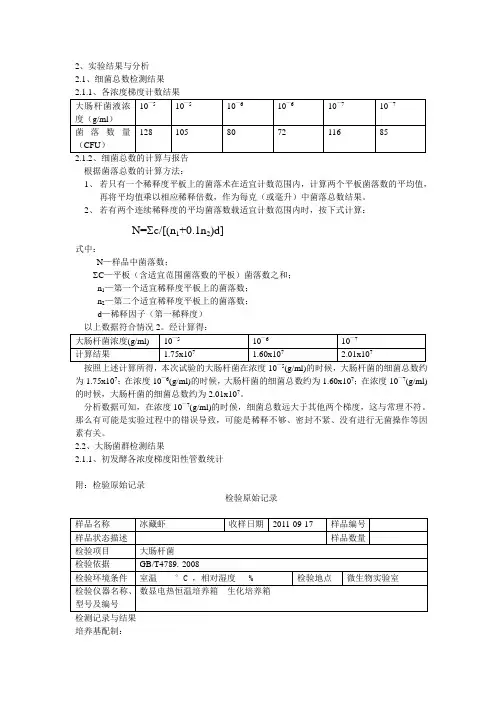
2、实验结果与分析2.1、细菌总数检测结果2.1.2、细菌总数的计算与报告根据菌落总数的计算方法:1、若只有一个稀释度平板上的菌落术在适宜计数范围内,计算两个平板菌落数的平均值,再将平均值乘以相应稀释倍数,作为每克(或毫升)中菌落总数结果。
2、若有两个连续稀释度的平均菌落数载适宜计数范围内时,按下式计算:N=∑c/[(n1+0.1n2)d]式中:N—样品中菌落数;∑C—平板(含适宜范围菌落数的平板)菌落数之和;n1—第一个适宜稀释度平板上的菌落数;n2—第二个适宜稀释度平板上的菌落数;d—稀释因子(第一稀释度)为1.75x107;在浓度10—6(g/ml)的时候,大肠杆菌的细菌总数约为1.60x107;在浓度10—7(g/ml)的时候,大肠杆菌的细菌总数约为2.01x107。
分析数据可知,在浓度10—7(g/ml)的时候,细菌总数远大于其他两个梯度,这与常理不符。
那么有可能是实验过程中的错误导致,可能是稀释不够、密封不紧、没有进行无菌操作等因素有关。
2.2、大肠菌群检测结果2.1.1、初发酵各浓度梯度阳性管数统计附:检验原始记录检验原始记录检测记录与结果培养基配制:样品配制:1、 固体样品,无菌称取25g 样品加225ml 生理盐水,均质。
2、 液体样品,需稀释的,吸取25ml 于225生理盐水,混匀。
菌落总数:检验依据:GB/T4789.2-2008大肠杆菌:检验一句GB/T4789.3-2003大肠杆菌:检验一句GB/T4789.3-2003注:“P ”表示阳性结果,“N ”表示阴性结果检验起止时间:2011年09月25日至2011年09月27日检测人:复核人:。

培养基组分对hCG核酸疫苗质粒拷贝数的影响王剑;夏杰;陆兵;徐殿胜【摘要】研究了培养基组分对hCG核酸疫苗质粒拷贝数的影响.结果表明,复合培养基比合成培养基更利于hCG核酸疫苗质粒DNA的生产.通过均匀设计实验确定,当培养基中含有胰蛋白胨10 g·L-1、酵母浸出粉8 g·L-1、NaCl 10 g·L-1、甘油10 g·L-1、KH2PO40.37 g·L-1、K2HPO4 2.01 g·L-1时,单位菌体质粒含量可达6.68 mg·g-1;在此基础上添加乙酸2.0 g·L-1、谷氨酰胺1.2 g·L-1、甘氨酸1.0 g·L-1、天门冬氨酸0.4 g·L-1,可使质粒拷贝数进一步扩增,单位菌体质粒含量可达9.32 mg·g-1,为LB培养基的5.12倍.【期刊名称】《化学与生物工程》【年(卷),期】2009(026)005【总页数】4页(P46-49)【关键词】DNA疫苗;质粒;拷贝数;培养基;均匀设计实验【作者】王剑;夏杰;陆兵;徐殿胜【作者单位】华东理工大学生物反应器工程国家重点实验室,上海,200237;华东理工大学生物反应器工程国家重点实验室,上海,200237;华东理工大学生物反应器工程国家重点实验室,上海,200237;华东理工大学生物反应器工程国家重点实验室,上海,200237【正文语种】中文【中图分类】R392目前,质粒DNA作为核酸疫苗和基因治疗剂的载体越来越受到研究者的重视。
质粒DNA作为基因载体比较安全、使用方便,但其在靶细胞中的基因表达效率低、持续时间短,所需剂量大,同时发酵产生的质粒DNA与细胞蛋白、多糖等物质一起以混合物的形式进入下游纯化过程,给分离和纯化工艺带来了很多困难[1,2]。
因此,对于DNA疫苗工程菌的大规模生产而言,一方面要获得较高的菌体密度,另一方面还需要菌体内含有较高的质粒拷贝数,以获得大量高纯度的质粒DNA,减轻后续纯化工艺负担[3]。

大肠杆菌鉴别培养基及菌落特点大肠杆菌(Escherichia coli)是一种常见的肠道菌群中的细菌。
它是一种革兰氏阴性、非芽孢杆菌,可以通过合适的培养基进行鉴别和分离。
本文将介绍大肠杆菌的鉴别培养基及菌落特点,并对其进行详细解释。
一、鉴别培养基1. 麦康凯氏培养基(MacConkey agar):麦康凯氏培养基是一种选择性和区分性培养基,通常用于分离和鉴别肠道革兰氏阴性菌。
它含有麦康凯氏紫(crystal violet)和牛胆盐(bile salts)等抑制革兰氏阳性菌生长的成分,同时含有乳糖和中性红等成分,能够区分能够利用乳糖的细菌和不能利用乳糖的细菌。
大肠杆菌在麦康凯氏培养基上生长良好,形成红色或粉红色的菌落,说明它可以利用乳糖产生酸性代谢产物。
2. EMB培养基(eosin methylene blue agar):EMB培养基是一种选择性和区分性培养基,常用于分离和鉴定肠道革兰氏阴性菌。
它含有嗜酸染料亚甲蓝(methylene blue)和伊美司粉(eosin Y)等成分,能够抑制革兰氏阳性菌的生长。
大肠杆菌在EMB培养基上形成绿色或金属光泽的菌落,说明它可以产生酸性代谢产物。
3. XLD培养基(xylose lysine deoxycholate agar):XLD培养基是一种选择性和区分性培养基,主要用于分离和鉴定肠道沙门氏菌属(Salmonella)和伤寒沙门氏菌(Shigella)。
大肠杆菌在XLD培养基上形成黄色的菌落,与其他肠道致病菌如沙门氏菌和伤寒沙门氏菌形成明显的区别。
二、菌落特点大肠杆菌在以上鉴别培养基上的菌落特点如下:1. 麦康凯氏培养基上的大肠杆菌菌落为红色或粉红色,直径约为2-3毫米,呈圆形或不规则形状。
2. EMB培养基上的大肠杆菌菌落为绿色或金属光泽的菌落,直径约为2-3毫米,边缘清晰。
3. XLD培养基上的大肠杆菌菌落为黄色的菌落,直径约为2-3毫米,表面平整。

大肠杆菌工程菌高密度发酵生产L-抗坏血酸-2-葡糖苷酶余玉奎;桂馨;李平;李敏【摘要】为提高大肠杆菌基因工程菌E.coli-pET21a高密度培养生产L-抗坏血酸-2-葡糖苷酶产量,采用摇瓶培养的方法,通过考察培养液菌体量和酶产量,筛选适用于E.coli-pET21a液体深层发酵的培养基.50 L发酵罐采用适用于工业化大生产的搅拌、供氧、pH控制和过程补料方式,进行液体深层发酵放大培养,大幅度提高酶产量.通过优化发酵过程控制pH和诱导温度,发酵液酶活提高至88 U/mL,达到摇瓶培养的10.1倍.研究结果对大肠杆菌基因工程菌高密度培养,高效表达生物酶有重要的参考价值.【期刊名称】《工业微生物》【年(卷),期】2018(048)002【总页数】6页(P29-34)【关键词】L-抗坏血酸-2-葡糖苷;维生素C;大肠杆菌;液体深层发酵;诱导剂【作者】余玉奎;桂馨;李平;李敏【作者单位】同济大学生命科学与技术学院,上海200092;同济大学生命科学与技术学院,上海200092;同济大学生命科学与技术学院,上海200092;同济大学生命科学与技术学院,上海200092【正文语种】中文维生素C(英语:Vitamin C,又称L-抗坏血酸)作为酸性药剂、还原剂、抗氧化剂、漂白剂以及化学反应物、食品和饮料中的稳定剂[1],广泛应用于化妆、保健、医药、食品行业。
在医疗卫生方面,维生素C参与许多新陈代谢过程,具有提高人体免疫力、抗衰老、预防心血管、增加对感冒抵抗力、促进胶原蛋白的合成[2]、抑制癌细胞增殖[3],防治坏血病和传染病、促进创伤愈合等作用,是辅助治疗的保健药品[4]。
在化妆品中,维生素C可作为还原剂、紫外线吸收剂和黑色素形成抑制剂来使用[2]。
具有美白皮肤、预防色斑、抗氧化功效。
由于人体内缺乏古洛糖酸内酯氧化酶,不能自身合成维生素C,必须靠体外摄取[5]。
因此,维生素C被列为人体的必需营养元素,在保护人类健康和生长过程中起到不可替代的重要作用[1]。

两次诱导实现重组大肠杆菌高密度、高表达研究3马文峰 庄英萍33 郭美锦 丁满生 储 炬 张嗣良(华东理工大学生物反应器工程国家重点实验室国家生化工程技术研究中心 上海 200237)摘要:通过不同温度诱导模式对大肠杆菌高密度,高表达的研究,确定两次升温诱导模式实现大肠杆菌高密度、高表达重组人载脂蛋白的目的。
实验证实两次诱导成功的避免了乙酸对高密度、高表达的影响,最终发酵的细胞密度OD 600达150,蛋白表达量418g ・L 21,证明两次升温诱导的发酵方法在高密度、高表达外源蛋白上是成功的,从而为基因工程菌规模化生产奠定了基础。
关键词:重组大肠杆菌,ApoA 2I M ilano ,高密度,高表达,两次诱导中图分类号:T Q92016 文献标识码:A 文章编号:025322654(2005)022******* 3国家高技术研究发展计划(“863”计划)(No 12002AA217021)国家重大科技专项资助(No 12002AA2Z3451)33通讯作者 Tel:086221264252234,Fax:086221264253702,E 2mail:YPZ@nc 2bi o 1com收稿日期:2004207205,修回日期:2004209201Study on the Recom b i nan t Human ApoA 2I M il ano H igh D en sity and H ighExpressi on by Two Tem pera ture 2Sh i fted I nducti on i n Escherich ia coli3MA W en 2Feng Z HUANG Ying 2Ping 33 G UO Mei 2J in D I N G Man 2ShengCHU Ju ZHANG Si 2L iang(East China U niversity of Science and Technology,S tate Key Laboratory of B ioreactorEngineering,N ational R eserch Center for B iotechnology,Shanghai 200237)Abstract:The te mperature effect on the reco mbinant pr otein p r oducti on f or mati on was investigated in p resent study 1The culture te mperature of gr owth phase is 30℃,and the culture te mperature of inducti on phase was ar 2ranged according t o three modes 1H ign cell 2density and high ex p ressi on culture of E 1coli t o pr oduct reco mbinant hu 2man apoli popr otein A 2I M ilano by tw o te mperature 2shifted inducti on 1T wo te mperature 2shifted inducti on was carried out high density and high ex pressi on reco mbinant hu man Apo A 21M ilano 1The reco mbinant p r otein Apo A 2I M ilano reached 418g ・L 21with the final cell density of OD 6001501And the t w o te mperature 2shifted inducti on av oided the acetic acid successfully t o the influence of the high density and high ex p ressi on 1T wo te mperature 2shifted inducti on was vi 2able in high density culture and high ex pressi on of heter ogenous pr otein in reco mbinati on E 1coli 1The sduty p r ovides a basic work for p r oducti on of reco mbinant Apo A 2I M ilano in scale 1Key words:Reco mbinant E 1coli ,Apo A 2I M ilano ,H igh density,H igh expressi on,T wo te mperature 2shifted induc 2ti on 大肠杆菌表达异源蛋白的方式依启动子不同,分为组成型和诱导型。

大肠杆菌一般培养方法大肠杆菌(Escherichia coli)是一种常见的肠道细菌,也是生物学研究中最常用的模式菌株之一、大肠杆菌具有广泛的分布范围,可以在许多环境中生存和繁殖。
本文将介绍大肠杆菌的一般培养方法。
一、培养基的制备大肠杆菌的培养基通常包括两个主要组分:固体培养基和液体培养基。
固体培养基用于菌落计数和细菌分离,并可用于培养单个菌落。
液体培养基则可用于扩大菌种和进行大规模的培养。
1.固体培养基的制备最常用的固体培养基为琼脂培养基。
制备过程如下:(1)称取所需琼脂,加入适量的蒸馏水中,进行均匀搅拌。
(2)加热至100摄氏度,溶解琼脂。
(3)煮沸1-2分钟,消毒琼脂。
(4)冷却至约50摄氏度。
(5)加入所需的培养基成分,如营养物质和抗生素等。
(6)倒入培养皿中,待凝固后即可使用。
2.液体培养基的制备最常用的液体培养基包括LB培养基(Lysogeny Broth)和TB培养基(Terrific Broth)。
制备过程如下:(1)称取所需培养基成分,加入适量蒸馏水中。
(2)加入琼脂和洗涤剂等成分,以调整液体的黏度和表面张力。
(3)调整pH值。
(4)加热并搅拌溶解,待溶解后冷却。
(5)过滤培养基,以去除不溶性杂质。
(6)分装到培养瓶中。
二、大肠杆菌的预培养将保存的大肠杆菌菌种(如冻存菌)挑取一高洁净的培养皿上贴菌,通常可采用菌板上交叉涂布法,用三角稀菌棒反复涂抹菌落。
之后用无菌瓷珠轻压菌落,使其均匀分散于培养皿上。
贴菌后将培养皿倒置,避免水分凝结在盖子上。
培养皿翻转的目的是避免水珠滴入培养基内,影响气体交换。
然后将培养皿放入培养箱中,37℃保温,24小时后进行预培养。
三、大肠杆菌的正式培养预培养后,取适量的大肠杆菌菌落液,加入培养基中,并进行摇床培养。
有时候,还需要在培养基中添加相应的抗生素,以筛选具有特定基因或表现的菌株。
培养条件一般为37摄氏度、摇床转速为200-250转/分钟。
培养时间根据需要和实验目的而定。

课程设计说明书课程名称:发酵工程设计题目:大肠杆菌的高细胞密度发酵院系:生物与食品工程学院学生姓名:郑帅超学号:201106040030专业班级:11 生物技术指导教师:李安华2014年5月26日课程设计任务书设计题目枯草芽孢杆菌产淀粉酶发酵工艺的优化学生姓名郑帅超所在院系生物与食品工程学院专业、年级、班11生物技术设计要求:1、树立正确的设计指导思想,严谨负责、实事求是、刻苦钻研、勇于探索的作风和学风。
2、根据所给资料,按照任务书中提出的范围和要求按时独立完成,不得延误,不得抄袭他人成果。
3、说明书应字迹清楚文字通顺,并附有各项设计成果表,摘引其他书籍或杂志的材料必须注明出处。
4、设计标准要求规范、实用、切合实际。
5、设计应严格按有关设计规范进行。
6、设计结束后,以个人为单位提交设计说明书一份(后附流程图)。
学生应完成的工作:1、在老师的帮助下完成题目设计。
2、学生查阅相关文献、资料制定实验路线,并有指导老师检查实验路线的合理性和可行性。
3、学生在实验室完成实验方案。
4、完成课程设计说明书的初稿,由指导老师帮助修改,最后定稿。
参考文献阅读:[1]李寅等著,高细胞密度发酵技术,化学工业出版社,2006-10-01,177~288.[2]陈坚,李寅,毛英鹰,等. 生物工程学报,1998 ,14(4) :452~455.[3]李民,陈常庆,朴勤,等. 生物工程学报,1998 ,14(3) :270~275.[4]杨汝燕,李民,陈常庆. 工业微生物,1998 ,28(3) :30~33.[5 ]李民,陈常庆,朴勤等,生物工程学报,1998 ,14 (3) :270~275.[6]杨汝燕,李民,陈常庆,工业微生物,1999 ,29(1) :25~28.[7]徐皓,李民,阮长庚,等. 工业微生物,1998 ,28(2) :20~25.[8]刘社际,葛永红,杨立明. 中国生物制品学杂志,1999 ,12 (1) :29 ~31.工作计划:2013.5.11分组并确认指导老师,在老师指导下查阅文献,确定题目。
发酵工艺:工程菌高密度发酵工艺开发策略8项(以大肠杆菌为例)利用重组DNA技术获取的生物药物在人类文明史上具有划时代的意义。
许多价值高产量低的功能蛋白如干扰素、白细胞介素、集落刺激因子、生长激素、胰岛素、人血白蛋白、蛋白酶等都在工程菌中获得了高效率表达。
由于工程菌高密度培养能够提高单位体积的产量,在工业生产上可以提高效率降低成本。
所以,高密度培养一直都是发酵工程师们所追捧的热点。
本文就工程大肠杆菌高密度发酵工艺开发中涉及的关键控制点加以探讨。
1工程菌种稳定可靠的菌种是工业化大生产的有力保障,直接关系到生产效率和成本高低。
不同于传统诱变育种模式,在对待工程菌菌种问题上,有人认为基因工程菌种构建完成后无需经过严格单克隆筛选,既节约时间成本又大大减少了工作量,这其实是一个认识误区。
这样做出来的菌种很难连续稳定传代50次以上,给中试放大以及后续的长期稳定生产留下了隐患。
业内一般以能否稳定遗传50代作为判断工程菌种优劣的一个标准。
发酵所需的接种量不是越大越好,要适当。
接种量过小导致适应期过长,菌种易提前老化,也增加了杂菌污染的风险。
接种量过大会过早引起溶氧不足,导致发酵失控。
且营养物质消耗过快也会影响后期正常生长。
一般大肠杆菌接种量遵循逐级增大的原则,并将最后一级的放大倍数控制在10倍左右。
种子培养一定要在最佳条件下进行,培养时间不宜过长,当种子生长至最佳状态时果断移种。
如果种子做的不好,其负面影响往往在发酵中后期会有所体现。
工程菌种培养会加入抗生素,不仅是为了抑制杂菌生长,更重要的是为了给菌种形成正向的抗性筛选压力,及时淘汰质粒丢失的菌株或者衰老的菌体,保证质粒携带菌群的正常生长与表达。
2高密度发酵培养基除了必须的碳源以外,有机复合氮源在蛋白表达阶段不可或缺。
有机复合氮源可提供丰富的氨基酸、小肽、嘌呤、嘧啶、维生素、生物素以及一些生物活性物质,能减轻细胞代谢负担,促进外源蛋白表达。
如果酵母膏和蛋白胨是以流加的方式添加时,存在一种非常有趣的代谢机制:当流加培养基中只有酵母膏时,重组蛋白不稳定;而当流加培养基中只有蛋白胨时,大肠杆菌难以再利用其所产生的乙酸。
很多企业或科研院所工作的朋友在做大肠杆菌表达某个蛋白时,常会发现某些有毒性的蛋白在普通的LB培养基中增殖速度缓慢或不能增殖。
如口蹄疫O型病毒3ABC,3个基因合在一起重组入PET系列表达载体时,在诱导前扩菌阶段细菌增殖缓慢。
这时很多人会认为出现这种情况的原因是遭到了噬菌体感染。
很多朋友也会遇到这样的问题,费了很大功夫将要表达的目的基因进行了密码子优化,然而最终结果还是不能表达所需蛋白。
了解自动诱导方法增加一种成功表达目的蛋白的机会!若你所要表达的目的蛋白不能表达,所有的条件(不同的诱导温度、不同的诱导时间、不同的诱导剂浓度)都进行了试验还是没有有所突破,这时你可以试一试采用大肠杆菌自诱导的方法。
我们知道很多蛋白在不加诱导剂的情况下有微量的表达,但是这微量表达的蛋白反而会对目的蛋白的大量表达产生抑制!还有不同抗性的表达质粒在长时间培养抗性消失时会发生不同情况的质粒丢失!特别是氨苄抗性的质粒!此时你也可以考虑采用联合自动诱导的方法。
本研究配方减少了传统的ITPG诱导过程,将扩菌过程和诱导过程相结合,利用培养基的不同组分被分别代谢用来促进细胞生长到高密度和自动诱导lac启动子驱动蛋白表达。
表达过程更便利,同时增加蛋白的可溶性及表达量,提高蛋白的表达效率。
减少IPTG对细菌的毒害作用!自动诱导培养基配方如下:胰蛋白胨20g酵母提取物10g丁二酸钠 5.4g二水柠檬酸钠0.3g甘油25ml葡萄糖0.5gAlpha-乳糖2gNa2HPO4 2.55gKH2PO4 3.4gNH4CL 2.68gNa2SO4 0.71gMgSO4.7H2O 0.493gFeCL3.6H2O 0.03g以上组分定容与1L蒸馏水中。
自动诱导操作步骤:1、10微升菌液加入10毫升培养基中,复苏过夜。
2、将复苏好的菌液接种入250毫升自动诱导培养基中。
3、220rpm 37度培养14-16h。
4、收集菌体,检测目的蛋白表达情况,并进行蛋白的纯化!。
大肠杆菌培养基配制及培养方法大肠杆菌(Escherichia coli)是一种常见的细菌,广泛用于分子生物学实验和基因工程研究中。
为了成功培养大肠杆菌,我们需要配制适合其生长繁殖的培养基,并采用正确的培养方法。
以下是大肠杆菌培养基的配制及培养方法的详细介绍。
一、大肠杆菌培养基的配制1. Luria-Bertani(LB)培养基LB培养基是最常用的培养基之一,其成分包括三个主要组成部分:氮源、碳源和盐类。
氮源:用于提供细菌所需的氮元素,可以使用氨基酸、含氮化合物等。
常用的氮源有氨基酸混合物、酵母提取物和酪蛋白水解物等。
碳源:用于提供细菌所需的碳元素,可以使用单糖、复糖、酒精、醇等。
常用的碳源有葡萄糖和乳糖等。
盐类:培养基中加入适量的盐类,以提供维持细菌生长所需的离子平衡,常用的盐类有氯化钠、磷酸二氢钠、氯化镁等。
将氮源、碳源和盐类按照一定比例混合,加入适量的蒸馏水中,调节pH值至7.0左右,然后用高压蒸汽灭菌。
2.M9培养基M9培养基是一种突变细菌筛选培养基,其主要成分是无机盐和碳源。
无机盐:使用硫酸铵、磷酸二氢钾、氯化钠等无机盐调配而成。
碳源:使用葡萄糖、蔗糖、乳糖等单糖或多糖。
按照一定比例混合无机盐和碳源,加入适量的蒸馏水中,调节pH值至7.0左右,然后用高压蒸汽灭菌。
二、大肠杆菌的培养方法1.培养前的预处理将所需的培养基配制好,装入洁净的培养皿或试管中,然后用高压蒸汽灭菌。
在培养大肠杆菌前,需要将冻存的菌株从-80℃的冰箱中取出,快速化解并接种至预先准备的LB或M9培养基中。
2.培养条件大肠杆菌的适宜生长温度为37℃,因此在培养过程中需要将培养皿放在37℃恒温培养箱中。
同时,还需控制培养时间和培养瓶内的氧气含量。
3.培养方法(1)液体培养将培养基加热至适温后,接种所需菌株,一般取两根菌体悬浮液放入新鲜的培养基中,使得初始菌体数约为10^7个/毫升。
随后放入37℃恒温培养箱中培养,每隔一段时间取样进行检测。
大肠杆菌发酵经验总结首先,补料速率与比生长速率直接影响着乙酸的生成速率和积累量(主要是补料速率与比生长速率影响发酵液中的残糖量,进而影响),所以适当的控制补料速率和比生长速率,对于控制乙酸的量有很好的效果。
其次,必须要保证充足的溶氧,并严格控制pH值,而且补酸碱的速率尽量缓和,不能太快;温度对于蛋白的表达也有很重要的影响,较低的发酵温度下所生产出的蛋白大多是有活性的,而较高的发酵温度下产生的蛋白大多一包涵体形式存在。
第三,选取合理的诱导时间非常重要,一般的诱导时间选在指数生长后期,而且诱导时的比生长速率最好能控制在0.2之内,选在此时诱导,1.将菌体的快速生长期与蛋白合成期分开,使这两个阶段互不影响,有利于蛋白的高表达;2.已经得到了大量的菌体,而且菌体的生物量基本接近稳定,不论是从动力学角度,还是能耗,物料成本方面,都比较合理。
第四,补料过程中的碳氮比也很重要。
若氮源过高,会使菌体生长过于旺盛,pH偏高,不利于代谢产物的积累,氮源不足,则菌体繁殖量少从而影响产量;碳源过多,则容易刑场较低的pH,抑制菌体生长,碳源不足,则容易引起菌体的衰老和自溶。
另外,碳氮比不当还会引起菌体按比例的吸收营养物质,从而直接影响菌体的生长和产物的合成。
根据自己的经验,一般情况下,对于一个稳定的发酵工艺下,如果总是在固定的发酵时间段出现溶菌现象,而且能排除噬菌体和染菌的可能性后,那就可能是因为碳氮比不合理造成的。
可以适当调整碳氮比。
大家讨论得较多的是关于代谢副产物乙酸对大肠杆菌发酵的影响,针对我们论坛所发的帖,我先总结以下几点,并作出相应解决措施。
一、代谢副产物-乙酸乙酸是大肠杆菌发酵过程中的代谢副产物,在多大的浓度下产生抑制作用各种说法不一,一般认为在好气性条件下,5~10g/L 的乙酸浓度就能对滞后期、最大比生长速率、菌体浓度以及最后蛋白收率等都产生可观测到的抑制作用。
当乙酸浓度大于10或20g/L 时,细胞将会停止生长,当培养液中乙酸浓度大于12g/L 后外源蛋白的表达完全被抑制。
大肠杆菌在各培养基的生长情况:
在普通琼脂平血板上长出灰白色露珠样光滑、隆起、边缘整齐的菌落。
在麦康凯琼脂平板上,形成中等大小的红色菌落。
在伊红美蓝琼脂平板上,形成带有金羼光泽的紫黑色小菌落。
在三糖铁琼脂培养蓉上,斜面底层呈现黄色,产生气体。
大肠杆菌可能存在部位:
肝脏、粪便、胆囊、肺、血液、脾脏、气管
大肠杆菌的分离鉴定
分离菌接种麦康凯培养基37 ℃24 h后,呈现边缘整齐或波状、稍突起,表面光滑湿润,直径1 mm~2 mm、粉红色或深红色的圆形菌落,在伊红美蓝琼脂上呈紫黑色带金属光泽的圆形菌落,在普通琼脂平板上呈灰白色,直径1.5 mm~2 mm的圆形菌FL) 落;细菌涂片染色检查为革兰氏阴性、大小一致的杆菌。
3株地方分离株分别接种到三糖铁培养基上,经37 ℃72 h培养,产酸、产气,不产生硫化氢。
生化特征为:分解葡萄糖、乳糖、甘露醇,产酸产气;分解阿拉伯糖;吲哚试验、甲基红试验呈阳性反应;尿素酶、明胶液化、柠檬酸盐利用试验,VP试验等呈阴性反应。
对分离的3株地方菌株分别用中国兽药监察所提供的大肠杆菌“O”抗原定型血清进行分型。
其中2株血清型分别是O2、O35,另1株未能分型。