乙醛作业1
- 格式:doc
- 大小:138.24 KB
- 文档页数:4


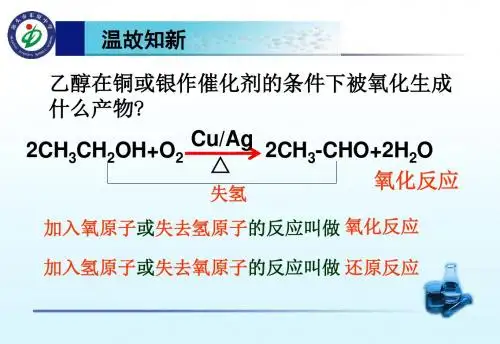
第三单元醛乙醛(一)教学目的 1、通过对乙醛性质的探究活动,学习醛的典型化学性质;2、知道甲醛的结构,了解甲醛在日常生活、工农业生产中的用途,以及甲醛对人体健康的危害;教学重难点醛的性质和应用教具准备 p79【实验1、2】仪器、试剂教学过程【复习提问】回忆乙醇催化氧化反应的本质,写出其反应的方程式。
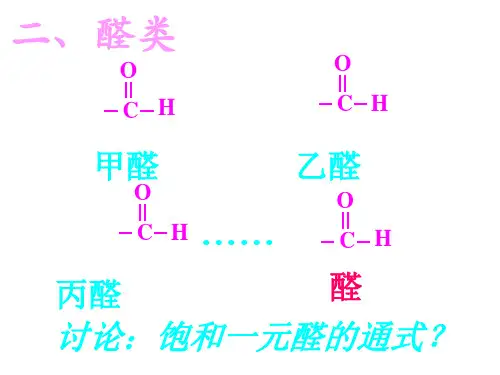
【讲授新课】一、醛的性质和应用1.乙醛的分子结构(1)乙醛的分子式、电子式、结构式、结构简式如下:___________________、____________________、___________________、__________________ (2)乙醛从结构上可以看成是______基和___ ___基相连而构成的化合物,其化学性质主要由_________________决定。
(3)醛类的结构可表示为______ ___,饱和一元醛的通式为____ _____或___ ____ 2.乙醛的物理性质(1)色、态、味:色气味的体;(2)密度:比水;(3)溶解性:乙醛与水、乙醇、乙醚、氯仿等互溶;(4)沸点:20.8℃,易挥发、易燃烧。
3.乙醛的化学性质【讲述】由醛基结构知道,醛基既有氧化性,又有还原性(1)加成反应(碳氧双键上的加成)写出化学方程式:【小结】 O OH通式:R-CHO+H2→R-CH2OH R1-C-R2+H2→R1-C-R2)(2)氧化反应 HA、燃烧:_________________________________________________________________B、催化氧化:_____________________________________________________________C、被弱氧化剂氧化①银镜反应(可用于__________________基的检验)实验注意事项:a.________________________________________________________________________b.________________________________________________________________________C.________________________________________________________________________d.________________________________________________________________________e.________________________________________________________________________化学方程式离子方程式:CH3CHO + 2[Ag(NH3)2]++2OH-→②乙醛与新制的氢氧化铜反应(可用于_______________基的检验)实验注意事项:a.________________________________________________________________________b.________________________________________________________________________C.________________________________________________________________________化学方程式:CH3CHO + 2Cu(OH)2→。





第2节醛第1课时作业1、下列分子中,既具有极性键又具有非极性键的分子是()A.CH2Cl2B.HCHOC.H2OD.CH2=CH-CH32、化学与生活密切相关。
下列说法不正确...的是()A.乙烯可作水果的催熟剂B.硅胶可作袋装食品的干燥剂C.福尔马林可作食品的保鲜剂D.氢氧化铝可作胃酸的中和剂3、下列化学用语正确的是()A.甲烷的球棍模型:B.羟基的电子式:C.乙醛的结构式:CH3CHO D.乙酸的结构简式C2H4O24、乙醛中具有的官能团是()A.羟基B.醛基C.羧基D.酯基5、一般情况下,下列官能团中既具有氧化性又有还原性的是()A.—OHB.—CHOC.—SO3HD.6、居室空气污染的主要来源之一是人们使用的装饰材料、胶合板、内墙涂料会释放出一种有刺激性气味的气态有机物,具有致癌作用,该气体是()A.乙烷B.氨气C.甲醛D.氯化氢7、下列关于乙醛的反应中,乙醛被还原的是()A.乙醛的银镜反应B.乙醛制乙醇C.乙醛与新制氢氧化铜的反应D.乙醛的燃烧反应8、下列反应中属于有机物被还原的是()A.乙醛发生银镜反应B.新制Cu(OH)2悬浊液与乙醛反应C.乙醛加氢制乙醇D.乙醛制乙酸9、据报道,不法商贩用甲醛溶液浸泡白虾仁,使之具有色泽鲜明、手感良好的特点,而这样做成的食物是有毒的。
下列关于甲醛的叙述不正确的是()A.甲醛是甲基跟醛基相连而构成的醛B.35%~40%的甲醛水溶液叫福尔马林C.福尔马林可用来浸制生物标本D.甲醛通常状况下为气体10、自然界中的许多植物中含有醛,其中有些具有特殊香味,可作为植物香料使用,例如桂皮含肉桂醛(),杏仁含苯甲醛(),下列说法错误的是()A.肉桂醛和苯甲醛互为同系物B.肉桂醛能发生加成反应、取代反应和加聚反应C.可用新制氢氧化铜悬浊液检验肉桂醛分子中的含氧官能团D.苯甲醛分子中所有原子可能位于同一平面内11、中央电视台曾报道纪联华超市在售的某品牌鸡蛋为“橡皮弹”,煮熟后蛋黄韧性胜过乒乓球,但经检测为真鸡蛋。

一、工作场所空气有毒物质测定—乙醛检测作业指导书乙醛的溶剂解吸-气相色谱法1 适应范围本指导书适应于工作场所空气的乙醛的检测及中心实验室所有岗位的操作人员。
2 引用标准GBZ/T 300.99—2017 工作场所空气有毒物质测定第99 部分:甲醛、乙醛和丁醛3 工作目的与要求3.1 确保操作人员的职业健康安全、设备财产安全和环境安全;3.2 熟知、熟练运用本指导书内容并严格执行。
4 工作原理及条件4.1 原理空气中的蒸气态乙醛用硅胶采集,水解吸后进样,经气相色谱柱分离,氢焰离子化检测器检测,以保留时间定性,峰高或峰面积定量。
4.2 仪器4.2.1 硅胶管,溶剂解吸型,内装400mg/200mg 硅胶。
4.2.2 空气采样器,流量范围为0mL/min~200mL/min。
4.2.3 溶剂解吸瓶,5mL。
4.2.4 微量注射器。
4.2.5 气相色谱仪,具氢焰离子化检测器,仪器操作参考条件:a) 色谱柱:30m×0.32mm×0.5μm,FFAP;b) 柱温:90℃;c) 气化室温度:150℃;d) 检测室温度:200℃;e) 载气(氮)流量:1mL/min;f) 分流比:10:1。
4.3 试剂4.3.1实验用水为蒸馏水,试剂为分析纯。
4.3.2 硫酸溶液,5%(体积分数)。
4.3.3 标准溶液:容量瓶中加入水,准确称量后,加入一定量的乙醛,再准确称量,用水定容。
由两次称量之差计算溶液的浓度,为标准贮备液。
临用前,用水稀释成750.0μg/mL 乙醛标准溶液。
或用国家认可的标准溶液配制5 样品的采集、运输和保存5.1 现场采样按照GBZ 159 执行。
5.2 短时间采样:在采样点,用硅胶管以100mL/min 流量采集≤15min 空气样品。
采样后,立即封闭硅胶管两端,置清洁容器内运输和保存。
样品在室温下可保存5d。
5.3 样品空白:在采样点,打开硅胶管两端,并立即封闭,然后同样品一起运输、保存和测定。

2019-2020年高一化学下册《乙醛》教案(1)
教学目标
知识技能:掌握醛类的概念,了解甲醛的结构及性质,初步了解酚醛树脂的制备方法、用途及缩聚反应的概念。
能力培养:通过醛类概念及性质的学习,了解甲醛的结构及性质,培养学生应用概念认识新事物及形成规律性认识的能力。
科学思想:通过甲醛性质的研究,进行结构决定性质,性质决定用途的化学思想的教育。
科学品质:调动学生学习醛类知识的兴趣,培养求知、进取的优良品德。
科学方法:通过乙醛——醛类——甲醛这一知识主线的学习,指导培养学生研究物质“特殊到一般,再由一般到特殊”的认识事物的方法。
重点、难点醛的概念、缩聚反应的概念以及酚醛树脂制备的化学方程式。
教学过程设计
附:随堂检测答案1.(B)
2.(1)①、⑤(2)⑤、⑥、⑦、⑧(3)⑥、⑧
(4)⑤、⑦、⑧(5)⑤、⑦。
《乙醛》教学设计一、课标解读醛类、酮是《普通高中化学课程标准(2017年版2020年修订)》选择性必修课程主题2“烃及其衍生物的性质与应用”的内容。
1.内容要求认识醛的组成和结构特点、性质、转化关系及其在生产、生活中的重要应用。
2.学业要求(1)能写出醛类和酮的官能团、简单代表物(乙醛、甲醛、苯甲醛、丙酮)的结构简式和名称;能够列举简单代表物(乙醛、甲醛、苯甲醛、丙酮)的主要物理性质。
(2)能结合分子结构特点,运用类比迁移的方法分析和推断其他醛的化学性质,并根据有关信息书写相应的化学方程式。
(3)能从官能团和结构变化的角度理解醇、醛、酸的转化关系。
能列举甲醛、苯甲醛和丙酮等代表物在生活中的应用,分析和探讨这些物质对人类健康和社会发展可能带来的双重影响。
二、教材分析本节内容的功能价值(素养功能):能结合醛、酮类物质的官能团及化学键极性特点分析和推断醛、酮类有机物的化学性质,培养学生类比迁移的能力。
人教版新教材在旧教材的基础上增加了醛类、酮两部分的内容。
旧教材内容中仅零散的涉及到甲醛的结构、性质和应用,丙酮仅作为拓展知识在“科学视野”中出现。
新教材系统的介绍了醛类代表物(甲醛、苯甲醛)、酮(代表物丙酮)。
新教材内容的改变带来的教学启示:教学时不能仅停留于认识乙醛的结构和性质,以及辨识醛与酮的层面,只要求学生掌握醛和酮的化学性质等碎片化知识;而应结合“醇、醛、酸”的转化关系,重视与氧化反应和还原反应等化学知识关联的结构化设计,充分发挥结构化知识对学生核心素养发展的重要作用,同时也为第五节“有机合成”的学习和完成本章最后的“整理与提升”奠定基础。
三、学情分析学生已有知识、能力等:学生在第二节课已经学习了醇类的典型代表物乙醇的物理性质和化学性质,初步了解了醇、醛、酸之间的相互转化。
但学生的类比迁移能力还有待加强。
特殊情况的应变能力不足,如乙醛的银镜反应和新制氢氧化铜反应的探究过程,需要学生反复实验,找到实验关键,能够根据实验现象,推断出反应方程式。
时遁市安宁阳光实验学校乙醛的结构和性质1.下列物质中既能使溴水和酸性KMnO4溶液褪色,又能发生银镜反应的是( ) A.CH3—CH=CH2 B.CH2=CH—CH2OHC.CH3CH2CH2OH D.CH2=CH—CHO【答案】D【解析】能发生银镜反应,则分子中必定含醛基(—CHO)。
2.关于丙烯醛(CH2=CH﹣CHO)的下列叙述中,正确的是()A.在丙烯醛分子中,仅含有一种官能团B.丙烯醛能使溴水褪色,但不能使酸性高锰酸钾溶液褪色C .丙烯醛能发生加聚反应,生成高聚物D.等物质的量的丙烯醛和丙醛完全燃烧,消耗等物质的量的O2【答案】C【解析】A.该有机物中含有醛基和碳碳双键两种官能团,故A错误;B.碳碳双键能与溴发生加成反应、能被酸性高锰酸钾溶液氧化还,醛基能被溴、酸性高锰酸钾溶液氧化,所以丙烯醛能使溴水、酸性高锰酸钾溶液褪色,故B错误;C.丙烯醛碳碳双键能发生加聚反应生成高分子化合物,生成高聚物,故C正确;D.1molCH2=CH﹣CHO消耗氧气为1mol×(3+﹣)=3.5mol,1molC3H6O消耗氧气为1mol×(3+)=4mol,则等物质的量的丙烯醛和丙醛完全燃烧,消耗氧气的物质的量不等,故D错误;答案为C。
3.甲醛、乙酸和葡萄糖组成的混合液中,碳元素的质量分数是( )A.27% B.52% C.40% D.无法计算【答案】C【解析】甲醛(CH2O)、乙酸(C2H4O2)、葡萄糖(C6H12O6)的最简式均为CH2O,故混合物中C、H、O元素质量之比为12:2:16=6:1:8,则混合物中碳元素质量分数为×100%=40%,故选C。
4.欲除漆包铜线表面的油漆,可将铜线放在酒精灯火焰上灼烧,再将其放入某种试剂中即可除净,该试剂最好是()A.醋酸 B.乙醇 C.硝酸 D.FeCl3溶液【答案】B【解析】将铜线放在酒精灯火焰上灼烧后,使漆熔化,油漆属于油脂类,放进乙醇中,乙醇可作为有机溶剂,将油漆溶解而除去,醋酸、硝酸、氯化铁溶液均不能将油漆溶解;故选B。
乙醛主要生产工艺乙醛,化学式为CH3CHO,为一种常见的有机化合物。
它是一种无色、可燃的液体,在日常生活和工业生产中具有广泛应用。
乙醛的主要生产工艺主要有蒸汽重整法、合成气加氧化法和煤气助渗法。
蒸汽重整法是乙醛的主要生产工艺之一。
该工艺以乙烯为原料,通过蒸汽重整反应得到合成气,再经过一系列的催化反应转化为乙醛。
首先,在高温下,将乙烯与水蒸汽进行重整反应,生成一氧化碳和氢气等合成气体。
其次,通过催化反应,将一氧化碳与水合成气体,然后经过再催化反应,将合成气体转化为乙醛。
合成气加氧化法是乙醛的另一种主要生产工艺。
该工艺以乙烷或乙炔为原料,通过氧化反应得到乙醛。
首先,将含有乙烷或乙炔的合成气与空气或氧气进行混合。
然后,在催化剂的作用下,进行氧化反应,生成乙醛。
这个工艺的优点是原料种类多样,适用范围广泛,可以利用多种石油和天然气等资源。
煤气助渗法是一种以煤气为原料生产乙醛的工艺。
该工艺通过烟煤和空气在高温下进行气化反应,产生含有乙醛的煤气。
首先,将烟煤粉末与空气混合,并在高温下进行气化反应,生成一种含有乙醛、甲醛和其他可燃气体的煤气。
接着,通过分离和净化,将煤气中的乙醛提取出来,并进行后续的加工和处理。
乙醛的主要生产工艺各有优缺点,适用于不同的生产条件和原料资源。
蒸汽重整法生产乙醛能够利用乙烯等石油化工原料,工艺相对成熟,但存在高压高温反应条件下的过程控制难度较大的问题。
合成气加氧化法可以利用多种石油和天然气资源,工艺相对简单,但存在合成气氧化成本较高的问题。
煤气助渗法可以利用煤炭等资源,具有较低的原料成本,但存在煤气中杂质较多,提取乙醛成本较高的问题。
总的来说,乙醛的生产工艺是多样的,工艺选择应根据实际情况和资源利用的可行性进行综合考虑。
随着科技的进步和经济的发展,乙醛的生产工艺也将不断更新和改进,以满足社会需求,并提高生产效率和产品质量。
1、居室空气污染的主要来源之一是人们使用的装修材料,它们会释放出一种有刺激性气味的气体,该气体是
A .甲烷
B .氨气
C .甲醛
D .二氧化硫 2、下列物质不.
属于醛类的是
C .CH 2===CH —CHO
D .CH 3—CH 2—CHO
3、催化氧化产物是的醇是
4、下列物质既能发生消去反应生成相应的烯烃,又能被氧化生成相应醛的是
A.CH 3OH B .CH 2OHCH 2CH 3
5、已知丁基共有四种。
不必试写,立即可断定分子式为C 5H 10O 的醛应有 A .3种 B .4种 C .5种 D .6种
6、下列配制银氨溶液的操作中,正确的是
A .在洁净的试管中加入1~2 mL AgNO 3溶液,再加入过量浓氨水,振荡,混合均匀
B .在洁净的试管中加入1~2 mL 稀氨水,再逐滴加入2% AgNO 3溶液至过量
C .在洁净的试管中加入1~2 mL AgNO 3溶液,再逐滴加入浓氨水至过量
D .在洁净的试管中加2% AgNO 3溶液1~2 mL ,逐滴加入2%稀氨水,边滴边振荡,至沉淀
恰好溶解时为止。
7、下列有关银镜反应的说法中正确的是
A.配制银氨溶液时氨水必须过量
B.1mol 甲醛发生银镜反应最多生成2molAg
C.银镜反应通常采用水浴加热
D.银镜反应后的试管一般采用浓硝酸洗涤 8、结构简式为
的物质不能发生的反应是
A .加成反应
B .水解反应
C .消去反应
D .氧化反应 9、下列反应不需要水浴加热的是
A.苯与溴的取代反应 B.苯的硝化反应 C.酚醛树脂的制备 D.乙醛的银镜反应10、下列关于有机物质制备说法正确的是()
A.等物质的量乙烷与氯气在光照条件下反应,可用这个方法制取一氯乙烷。
B.实验室制乙烯加热时,温度应慢慢上升,防止发生碳化。
C.实验室制乙炔收集到的气体往往有刺激性气味,这是由于乙炔中混有少量H
2
S等气体
D.在洁净的试管中加入1mL AgNO
3
溶液,再加入过量浓氨水,振荡制成银氨溶液。
11.(双选)下列各组混合物中,不能通过分液进行分离的是
A.溴乙烷和水B.甲苯和水C.乙醛和乙醇D.乙醛和水
12.(双选)举办“人文奥运”的一个重要体现就是禁止运动员服用兴奋剂。
有一种兴奋剂的
结构简式如右图,下列有关该物质的说法不正确
...的是
A.该分子中所有碳原子一定处于同一平面中
B.1mol该物质与足量浓溴水反应时,至少消耗4molBr
2
C.该物质属于酚类物质,遇到FeCl
3
溶液能发生显色反应
D.该物质能使酸性KMnO
4
溶液褪色,即可证明其分子必存在碳碳双键
姓名:
学号:
题 1 2 3 4 5 6 7 8 9 10 11 12 答
13、(1)(CH
3CH
2
)
2
C(CH
3
)
2
的名称为;
(2)2,6-二甲基-4-乙基辛烷的结构简式:。
(3)2-甲基-1,3-丁二烯的键线式为;
(4)分子中含氧官能团的名称是;该有机物发生加聚反应后,所得产物的结构简式为。
14、完成银镜反应实验:在AgNO
3溶液中逐滴加入氨水,开始时在AgNO
3
溶液中出现__________
反应的离子方程式为____ ________________,继续滴入氨水则____ ____,反
应的化学方程式为______________________________________________________________
边滴边振荡直滴到_____ _________为止.再加入乙醛溶液后,水浴中加热,现象是_______ _____,化学方程式为: ______________________________________________ 15、(2011·唐山一中月考)有A 、B 、C 三种烃的衍生物,相互转化关系如下:
其中B 可发生银镜反应,C 跟石灰石反应产生能使澄清石灰水变浑浊的气体. (1)A 、B 、C 的结构简式和名称依次是______________________________________、
________________、________________. (2)写出下列反应的化学方程式.
①A →B 的化学方程式为:_____________________________________________. ②B →C 的化学方程式为:_______________________________________________. ③B →A 的化学方程式为:______________________________________________.
16、关于银镜反应的实验操作步骤如下:
A .在试管中先注入少量NaOH 溶液,振荡,加热煮沸之后把NaOH 溶液倒去,再用蒸馏水洗净试管备用.
B .在洗净的试管里配制银氨溶液.
C .向银氨溶液中滴入3~4滴乙醛稀溶液.
D .加热.
请回答下列问题:
(1)步骤A 中加NaOH 溶液振荡,加热煮沸的目的是_____________________________ (2)简述银氨溶液的配制过程:__________________________________________
________________________________________________________________________. (3)写出乙醛发生银镜反应的化学方程式:_____________________________________ (4)银氨溶液久置可能会爆炸,直接排放会污染环境,且造成资源浪费,实验室从废液中回收银的实验流程如下:
废液――――――――――→加适量稀硝酸――――――→过量铁粉
――――――――――――→足量稀盐酸过滤、洗涤银粉 已知:[Ag(NH 3)2]+ Ag ++2NH 3
①写出废液与稀硝酸反应的离子方程式:__________________________________
②加入铁粉要过量的目的是___________________________________________. ③该实验过程中可能产生的大气污染物是________________________________.
乙醛作业1 答案
题 1 2 3 4 5 6 7 8 9 10 11 12 答
C
B
A
B
B
D
C
C
A
C
CD
AD
13、(1)3,3-二甲基戊烷 , (2)略
(3)
(4)醛基;
14、沉淀, Ag +
+NH 3·H 2O=AgOH ↓+NH 4+
,沉淀溶解,AgOH+2NH 3·H 2O=[Ag(NH 3)2]OH+2H 2O ,最初产生的沉淀刚好溶解 ,形成银镜.
15、解析:已知A 、B 、C 为烃的衍生物:A ――→氧化B ――→氧化
C ,说明A 为醇,B 为醛,C 为羧酸,且三者碳原子数相同.醇在浓H 2SO 4存在时加热至170℃产生的气体与溴水加成得1,2二溴乙烷,则A 为乙醇,B 为乙醛,C 为乙酸.
答案:(1)CH 3CH 2OH ,乙醇 CH 3CHO ,乙醛 CH 3 COOH ,乙酸
(2)①2CH 3CH 2OH +O 2――→催化剂
△
2CH 3CHO +2H 2O ②2CH 3CHO +O 2――→催化剂
△
2CH 3COOH ③CH 3CHO +H 2――→催化剂
△
CH 3CH 2OH 16、解析:银镜反应成功的关键之一是试管必须洁净,试管中先加入少量的氢氧化钠溶液,振荡,加热煮沸,目的就是除去试管内壁上的油污,保证试管的洁净;银氨溶液的配制一定要先加入硝酸银,然后边振荡试管边逐滴滴入稀氨水,至最初产生的沉淀恰好溶解为止.当加入稀硝酸时,会与氨气和氢氧根离子反应;从废液中回收银加入铁粉是为了将银离子置换为单质银,达到回收的目的,同时不造成重金属离子的污染.
答案:(1)除去试管内壁的油污
(2)向洁净的试管中加入2%硝酸银溶液,然后边振荡试管边逐滴滴入2%的稀氨水,至最初产生的沉淀恰好溶解为止
(3)CH 3CHO +2Ag(NH 3)2OH →CH 3COONH 4+2Ag ↓+3NH 3+H 2O (4)①[Ag(NH 3)2]++OH -+3H +=== Ag ++2NH +4+H 2O
②将银离子还原 ③NO。