化学反应速率和化学平衡的图像
- 格式:doc
- 大小:599.23 KB
- 文档页数:6







化学反应速率和化学平衡图像图像分析要领2SO2(g)+O2(g)2SO3(g) t随后逐渐增加,说明改变的条件是增加反应物的浓度。
CH4(g)+H2O(g)CO(g)+3H2(g)ΔH>0tmA(g)+nB(g)qC(g)+pD(g) “定一议二”。
m+n>q+p时2NO(g) + 2CO(g)N2(g)+2CO2(g) 先拐先平,先平者高。
T投料比图2SO2(g)+O2(g)2SO3(g) △H<01.b应对应物质的化学计量数之n2.T3.平衡向右移动,分数先增大后减小定位题组1.对于可逆反应:2SO 2(g)+O 2(g)2SO 3(g)△H<0,下列研究目的和示意图相符的是2.工业上可利用CH 4(g)+H 2O(g)CO(g)+3H 2(g)反应生产合成氨原料气H 2。
已知温度、压强和水碳比[)()(42CH n O H n ]对甲烷蒸汽转化反应的影响如下图:图1(水碳比为3) 图2(水碳比为3) 图3(800℃)(1)降低反应的水碳比平衡常数K__________(选填“增大”、“减小”或“不变”);升高温度,平衡向____________方向移动(选正反应或逆反应)。
(2)图2中,两条曲线所示温度的关系是:t 1_____t 2(选填>、=或<);图1中,在800℃、2MPa 比1MPa 时的甲烷含量_______(选填高、低或不变),3.甲醇被称为21世纪的新型燃料,工业上通过下列反应Ⅰ和Ⅱ,用CH 4和H 2O 为原料来制备甲醇。
(1)将1.0 mol CH 4和2.0 mol H 2O(g)通入反应室(容积为100 L),在一定条件下发生反应:CH 4(g)+H 2O(g) CO(g)+3H 2(g)……Ⅰ,CH 4的转化率与温度、压强的关系如图。
①已知100 ℃时达到平衡所需的时间为5 min 。
则用H 2表示的平均反应速率为________。


化学反应速率和化学平衡的图像
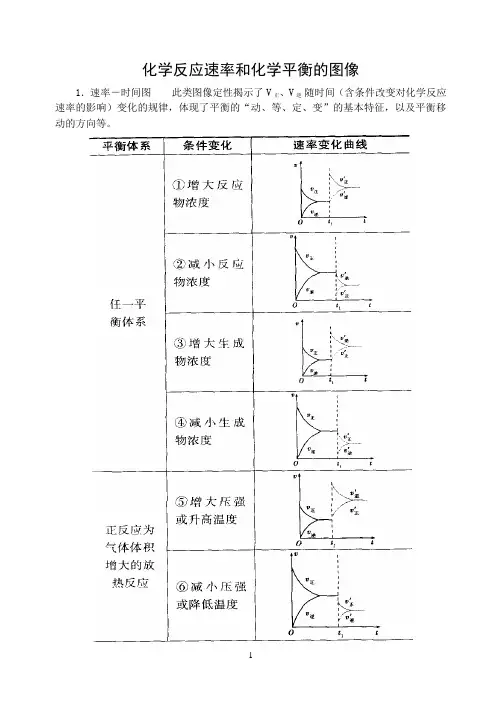
1.速率-时间图此类图像定性揭示了V正、V逆随时间(含条件改变对化学反应速率的影响)变化的规律,体现了平衡的“动、等、定、变”的基本特征,以及平衡移动的方向等。
2.含量―时间―温度(压强)图常见的形式有下图所示的几种(C%指某产物百分含量,B%指某反应物百分含量),这些图像的折点表示达到平衡的时间,曲线的斜率反映了反应速率的大小,可以确定T(p)的高低(大小),水平线高低反映平衡移动的方向。
3.恒压(温)线该类图像的纵坐标为物质的平衡浓度(c)或反应物的转化率( ),横坐标为温度(T)或压强(p),常见类型如下图:
小结
1.图像分析应注意“三看”
(1)看两轴:认清两坐标轴所表示的含义。
(2)看起点:从图像纵轴上的起点,一般可判断谁为反应物,谁为生成物以及平衡前反应进行的方向。
(3)看拐点:一般图像在拐点后平行于横轴则表示反应达平衡,如横轴为时间,由拐点可判断反应速率。
2.图像分析中,对于温度、浓度、压强三个因素,一般采用“定一议二”的方式进行分析。
化学反应速率和化学平衡的图像一、反应速率图象1.浓度(或物质的量)-----时间图象例1、一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如右图所示,下列描述正确的是A、反应开始到10s,用Z表示的反应速率为0.158mol/(L·s)B、反应开始时10s,X的物质的量浓度减少了0.79mol/LC、反应开始时10s,Y的转化率为79.0%D、反应的化学方程式为:X(g)+Y(g)Z(g)练习1.今有正反应放热的可逆反应,若反应开始经t1s后达平衡,在t2s时由于反应条件改变,使平衡破坏,到t3s时又达平衡,如图:(1)该反应的反应物是______(2)该反应的化学方程式为_________________(3)分析从t2到t3时曲线改变的原因是()A、增大了X或Y的浓度B、使用了催化剂C、缩小体积,使体系压强增大D、升高了反应温度2.速率--时间图象例 1. mA(g)+nB(g) qC (g);若增大压强,或升高温度,重新达到平衡v正、v逆变化如图,则△H___0,m+n___q例2:合成氨反应:N 2+3H 22NH 3 △H < 0 。
如图只改变某一条件(其他条件不变)时化学反应速率与时间的变化曲线。
请指出t1、t2、t3、t4、t5时刻分别改变什么条件?二、化学平衡图象1.百分含量(转化率)—温度(压强)—时间图像例1.在A (g )+B (g )=C (g )+D (g )的反应体系中,C 的百分含量和时间的关系如图所示,若反应分别在400℃和100℃下进行,所得曲线分别为Q 与P ,则正反应是放热反应的图为2、百分含量(或转化率)—压强—温度图像例2.对于反应A (s )+2B (g)3C (g )(正反应吸热),平衡混和物中C 的百分含量C%与外界条件x 、y 的关系如下图所示,则下列结论中正确的是A 、x 表示温度,y 表示压强,且y 1>y 2>y 3B 、x 表示压强,y 表示温度,且y 3>y 2>y 1C 、x 表示温度,y 表示压强,且y 3>y 2>y 1D 、x 表示压强,y 表示温度,且y 1>y 2>y 3A B CD三、其他类型的图象例1、下图是在其它条件一定时,反应2NO+O 22NO 2 ΔH=Q(Q <0)中NO 的最大转化率与温度的关系曲线。
图中坐标有A 、B 、C 、D 、E 5点,其中表示未达平衡状态且V 正>V 逆的点是 。
例2、将物质的量均为3.00mol 物质A 、B 混合于5L 溶器中,发生如下反应 3A +B 2C ,在反应过程中C 的物质的量分数随温度变化如图所示:(1)T 0对应的反应速率V 正和V 逆的关系是_____(用含“>”“<”“=”表示,下同);(2)此反应的正反应为______热反应;(3)X 、Y 两点A 物质正反应速率的大小关系是______________; (4)温度T <T 0时,C%逐渐增大的原因是________________________; (5)若Y 点的C 的物质的量分数为25%,则参加反应的A 的物质的量为_______;若Y 点时所耗时间为2min ,则B 物质的反应速率为__________。
练习1、在一定温度下发生反应:I 2(g )+H 2(g )2HI (g );△H <0并达平衡。
HI 的体积分数V (HI )随时间变化如图曲线(II )所示。
若改变反应条件,在甲条件下V (HI )的变化如曲线(I )所示。
在乙条件下V (HI )的变化如曲线(III )所示。
则甲条件、乙条件分别是①恒容条件下,升高温度; ②恒容条件下,降低温度; ③恒温条件下,缩小反应容器体积; ④恒温条件下,扩大反应容器体积; ⑤恒温恒容条件下,加入适当的催化剂A ①⑤,③B ②⑤,④C ③⑤,②D ③⑤,④ 2、下图表示反应A (气)+B (气)nC(气)(正反应放热)在不同条件下NO 转化率• ET 0C%T ℃YX反应混合物中C 的百分含量和反应过程所需时间的关系曲线。
下列有关叙述正确的是A 、若其它条件相同,a 比b 的温度高B 、a 表示有催化剂,b 表示无催化剂C 、若n =2,其它条件相同,a 比b 的压强大D 、反应由逆反应开始3、T ℃时,A 气体与B 气体反应生成C 气体。
反应过程中A 、B 、C 浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T 1和T 2时,B 的体积分数与时间的关系如图(Ⅱ)所示,则下列结论正确的是A 、在(t 1+10)min 时,保持其他条件不变,增大压强,平衡向逆反应方向移动B 、(t 1+10)min 时,保持容器总压强不变,通入稀有气体,平衡向逆反应方向移动C 、T ℃在相同容器中,若由0.3mol ·L —1 A 0.1 mol ·L —1 B 和0.4 mol ·L —1 C 反应,达到平衡后,C 的浓度仍为0.4 mol ·L —1D 、其他条件不变,升高温度,正、逆反应速率均增大,且A 的转化率增大 4、已知可逆反应aA +bB cC 中,物质的含量A%和C%随温度的变化曲线如图所示,下列说法正确的是A 、该反应在T 1、T 3温度时达到过化学平衡B 、该反应在T 2温度时达到过化学平衡C 、该反应的逆反应是放热反应D 、升高温度,平衡会向正反应方向移动 5、可逆反应aA (g )+bB (g )cC (g )+dD (g );ΔH 同时符合下列两图中各曲线的规律的是A 、a +b >c +d T 1<T 2 ΔH <0B 、a +b >c +d T 1<T 2 ΔH >0C 、a +b <c +d T 1>T 2 ΔH <0D 、a +b >c +d T 1>T 2 ΔH >06、在某容积一定的密闭容器中,有下列的可逆反应:A(g )+B (g )xC (g )(正反应放热)有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T 表示温度,P 表示压强,C%表示C 的体积分数)A 、P 3>P 4,y 轴表示B 的转化率B 、P3<P4,y轴表示B的体积分数C 、P3<P4,y轴表示混合气体的密度D、 P3>P4,y轴表示混合气体的平均mol质量7、600℃时,在一密闭容器中,将二氧化硫和氧气混合发生反应:2SO2(g)+O2(g )2SO3(g);△H<0。
反应过程中SO2、O2、SO3物质的量变化如图,下列说法不正确的是A、反应从0 min开始,到第一次平衡时,二氧化硫的转化率为40%B、反应进行到10min至15min的曲线变化可能升高了温度C、反应进行至20min时,曲线发生变化是因为通入了氧气D、在15-20min;25-30min内时反应处于平衡状态8、某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中P表示压强,T表示温度,n表示物质的量):根据以上规律判断,上列结论正确的是A、反应Ⅰ:△H>0,P2>P1B、反应Ⅱ:△H<0,T1<T2C、反应Ⅲ:△H>0,T2>T1;或△H<0,T2<T1D、反应Ⅳ:△H<0,T2>T19、可逆反应A+3B2C,在反应过程中,C的百分含量C%与温度的关系如右图所示。
(1)该反应是(吸热,放热)反应;(2)温度t<500℃时,C%逐渐增大的原因是;(3)温度t>500 t时,C%逐渐减小的原因是。
10、下列四个图中,曲线变化情况与所给反应(a、b、c、d均大于0)相对应的是()B、N2(g)+3H2(g)2NH3(g)△H=-bKJ•mol-1A、2SO2(g)+O2(g)2SO3(g)△H=-aKJ•mol-1C、N2O4(g)2NO2(g)△H=+cKJ•mol-1D、CO2(g)+C(s)2CO(g)△H=+dKJ•mol-111、氮及其化合物在工农业生产、生活中有着重要作用。
(1)在T℃时,将0.6molH2和0.4molN2置于容积为2 L的密闭容器中(压强为mPa)发生反应:3H2+N22NH3△H<0。
若保持温度不变,某兴趣小组同学测得反应过程中容器内压强随时间变化如图所示:8 min内分钟NH3的平均生成速率为mol·L-1·min-1。
(2)仍在T℃时,将0.6molH2和0.4molN2置于一容积可变的密闭容器中。
①下列各项能说明该反应已达到平衡状态的是(填序号)。
a.容器内N2、H2、NH3的浓度之比为l:3:2b.3v正(N2)=v逆(H2)c.3v正(H2)=2v逆(NH3)d.混合气体的密度保持不变e.容器中气体的平均相对分子质量不随时间而变化②该条件下达到平衡时NH3的体积分数与题(1)条件下NH3的体积分数相比(填“变大”“变小”或“不变”)。
③达到平衡后,改变某一条件使反应速率发生了如图所示的变化,改变的条件可能是。
a.升高温度,同时加压b.降低温度,同时减压c.保持温度、压强不变,增大反应物浓度d.保持温度、压强不变,减小生成物浓度。