化学平衡和速率图像
- 格式:pptx
- 大小:689.04 KB
- 文档页数:4




化学反应速率和化学平衡图像图像分析要领2SO2(g)+O2(g)2SO3(g) t随后逐渐增加,说明改变的条件是增加反应物的浓度。
CH4(g)+H2O(g)CO(g)+3H2(g)ΔH>0tmA(g)+nB(g)qC(g)+pD(g) “定一议二”。
m+n>q+p时2NO(g) + 2CO(g)N2(g)+2CO2(g) 先拐先平,先平者高。
T投料比图2SO2(g)+O2(g)2SO3(g) △H<01.b应对应物质的化学计量数之n2.T3.平衡向右移动,分数先增大后减小定位题组1.对于可逆反应:2SO 2(g)+O 2(g)2SO 3(g)△H<0,下列研究目的和示意图相符的是2.工业上可利用CH 4(g)+H 2O(g)CO(g)+3H 2(g)反应生产合成氨原料气H 2。
已知温度、压强和水碳比[)()(42CH n O H n ]对甲烷蒸汽转化反应的影响如下图:图1(水碳比为3) 图2(水碳比为3) 图3(800℃)(1)降低反应的水碳比平衡常数K__________(选填“增大”、“减小”或“不变”);升高温度,平衡向____________方向移动(选正反应或逆反应)。
(2)图2中,两条曲线所示温度的关系是:t 1_____t 2(选填>、=或<);图1中,在800℃、2MPa 比1MPa 时的甲烷含量_______(选填高、低或不变),3.甲醇被称为21世纪的新型燃料,工业上通过下列反应Ⅰ和Ⅱ,用CH 4和H 2O 为原料来制备甲醇。
(1)将1.0 mol CH 4和2.0 mol H 2O(g)通入反应室(容积为100 L),在一定条件下发生反应:CH 4(g)+H 2O(g) CO(g)+3H 2(g)……Ⅰ,CH 4的转化率与温度、压强的关系如图。
①已知100 ℃时达到平衡所需的时间为5 min 。
则用H 2表示的平均反应速率为________。

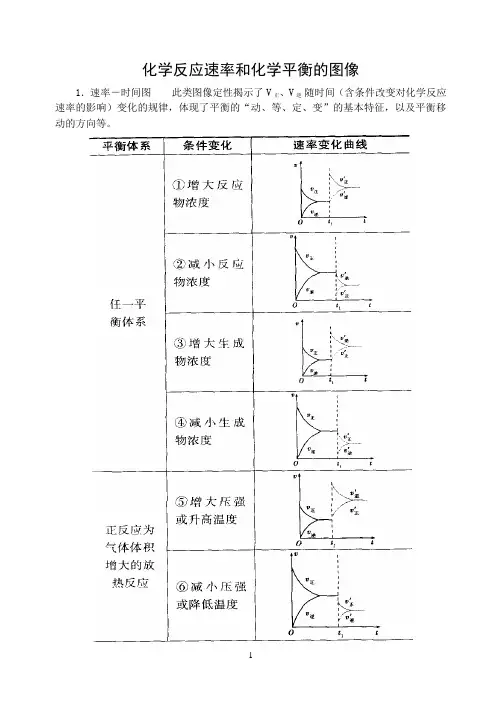
化学反应速率和化学平衡的图像
1.速率-时间图此类图像定性揭示了V正、V逆随时间(含条件改变对化学反应速率的影响)变化的规律,体现了平衡的“动、等、定、变”的基本特征,以及平衡移动的方向等。
2.含量―时间―温度(压强)图常见的形式有下图所示的几种(C%指某产物百分含量,B%指某反应物百分含量),这些图像的折点表示达到平衡的时间,曲线的斜率反映了反应速率的大小,可以确定T(p)的高低(大小),水平线高低反映平衡移动的方向。
3.恒压(温)线该类图像的纵坐标为物质的平衡浓度(c)或反应物的转化率( ),横坐标为温度(T)或压强(p),常见类型如下图:
小结
1.图像分析应注意“三看”
(1)看两轴:认清两坐标轴所表示的含义。
(2)看起点:从图像纵轴上的起点,一般可判断谁为反应物,谁为生成物以及平衡前反应进行的方向。
(3)看拐点:一般图像在拐点后平行于横轴则表示反应达平衡,如横轴为时间,由拐点可判断反应速率。
2.图像分析中,对于温度、浓度、压强三个因素,一般采用“定一议二”的方式进行分析。
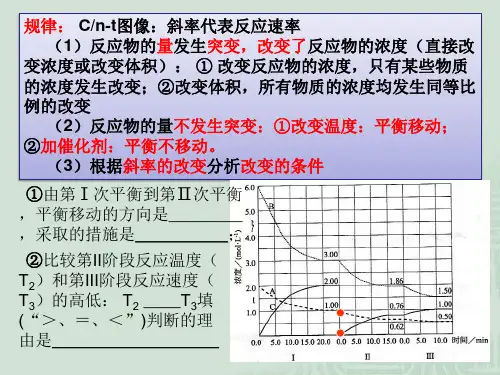



化学反应速率和化学平衡中的坐标图胡征善坐标图可以帮助理解和解决化学问题,在化学反应速率和化学平衡中会涉及各种坐标图。
使用坐标图时必须要明确横坐标、纵坐标、点、线甚至面的物理意义。
例如:横坐标是时间,纵坐标是反应速率,a点是刚开始反应瞬间正反应速率最大,0点表示刚开始时没有产物,逆反应速率为0,ab线是表示随着反应的进行,反应物浓度不断减小,正反应速率也不断减小;0b线表示随着反应进行,生成物浓度不断增大,逆反应速率不断增大,b点时表示在d时刻正反应速率与逆反应速率相等,b点是平衡点,随后反应物浓度和生成物浓度不随时间延长而变化。
Ab0d的面积(S ab0d)表示在0~d s之间由正反应消耗反应物的浓度c(反应物)= v(正)t mol/L,0bd的面(S0bd)积表示在0~d s之间由逆反应又生成反应物的浓度c′(反应物)= v(逆)t mol/L,而图中阴影部分即表示反应净消耗反应物的浓度即S ab0d—S0bd== c(反应物)—c′(反应物) ==[v(正)—v(逆)]t mol/L。
v—t图或c—t图等是分析化学反应速率和化学平衡问题的常用方法。
如:在建立化学平衡后的v—t图中,t 1时刻改变外界条件,一般而言,凡增大的因素(增大浓度、升高温度、增大压强、使用催化剂),反应速率增大;凡减小的因素(减小浓度、降低温度、减小压强、使用阻化剂),反应速率减小。
化学平衡是否移动,要视反应速率改变的程度,若改变的程度不同,化学平衡发生移动——何方大向何方移动,下图中“何方高向何方移动”;若同等程度改变(反应前后气体计量总数相等的反应改变压强或使用催化剂、阻化剂),平衡不移动。
下图中在t1时,快速地(不是缓慢地)改变外界条件,温度、压强和催化剂对正、逆反应速率的影响都是“跳跃式”改变,而浓度改变的瞬间,其中有一速率并没有改变,随后才改变。
对反应前后气体计量总数不等的反应,改变压强对计量总数大的一方影响大。